连翘叶不同溶剂提取物体外抗氧化活性研究
2016-03-18贾东升李荣乔谢晓亮温春秀崔施展刘铭河北省农林科学院经济作物研究所药用植物研究中心河北石家庄050051
贾东升,李荣乔,谢晓亮,温春秀,崔施展,刘铭(河北省农林科学院经济作物研究所,药用植物研究中心,河北石家庄050051)
连翘叶不同溶剂提取物体外抗氧化活性研究
贾东升,李荣乔,谢晓亮*,温春秀,崔施展,刘铭
(河北省农林科学院经济作物研究所,药用植物研究中心,河北石家庄050051)
摘要:比较连翘叶不同提取溶剂提取物的抗氧化活性。分别以水、60 %乙醇、80 %乙醇、无水乙醇、乙酸乙酯为溶剂制备连翘叶提取物,测定不同提取物中多糖、总酚和黄酮含量;以BHT为阳性对照,采用DPPH自由基(DPPH·)、羟基自由基(·OH)、超氧阴离子(O2-·)、ABTS自由基(ABTS+·)清除活性和铁离子还原能力(FRAP)法考察各溶剂提取物的抗氧化活性;考察提取物中活性物质含量与其活性的相关性。连翘叶不同溶剂提取物均具有抗氧化活性,均呈一定的量效关系,且不同溶剂提取物的抗氧化活性强弱顺序随评价方法的不同而不同。连翘叶不同溶剂提取物中总酚含量和黄酮含量均与·OH清除活性和铁离子还原能力具有较高的相关性,黄酮含量还与O2-·清除活性具有较高的相关性。连翘叶80 %乙醇提取物和60%乙醇提取物抗氧化活性相对较高。
关键词:连翘叶;抗氧化活性;多糖;总酚;黄酮
近年来自由基成为许多学者研究的热点,其通过氧化作用破坏细胞结构和功能,因此抗氧化剂研究越来越受到关注。目前常用抗氧化剂多为人工合成,相关研究发现,人工抗氧化剂可抑制体内代谢酶活性,过量食用可导致机体代谢紊乱,并且会致畸、致癌[1],因此天然抗氧化剂的研究具有重要意义。我国中药材资源丰富,分布广泛,含有多种抗氧化成分如多糖、多酚、黄酮等,从中药材中提取低毒、安全、有效的天然抗氧化剂已成为抗氧化剂发展的必然趋势。
连翘是我国传统的中药材,广泛分布于河北省太行山地区,果实是其主要入药部位,副产物连翘叶常常被废弃。有研究表明,连翘叶中含有丰富的多糖、多酚和黄酮类物质,是一种具有较大开发前景的天然抗氧化剂资源[2-5]。因此,本研究采用不同溶剂提取连翘叶,对提取物中的多糖、总酚和黄酮含量进行测定,考察不同溶剂提取物的抗氧化活性,并考察提取物中多糖、总酚和黄酮含量与其抗氧化活性的相关性,以期为连翘叶资源在食品、医药和日化领域的应用开发提供试验支持。
1试验材料
1.1仪器
DGX-92438-2型干燥箱:上海福玛实验设备有限公司;分析天平:METTLER TOLEDO;RE52CS-1旋转蒸发仪:上海亚荣生化仪器厂;FD-1B-50冷冻干燥机:北京博医康实验仪器有限公司;752PC型紫外可见分光光度计:上海光谱仪器有限公司;MK3型酶标仪:Thermo Fisher。
1.2试剂
连翘叶:2014年10月采摘于邯郸涉县连翘基地;没食子酸(批号:110831-201403)、芦丁标准品(批号:100080-201408):中国药品生物制品检定所;Folin-Ciocalteu试剂(分析纯)、1,1-二苯基-2-三硝基苯肼(DPPH,分析纯)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS,分析纯):Sigma;2,4,6-三吡啶基三嗪(TPTZ,分析纯):上海江莱生物科技有限公司;2,6-二叔丁基-4-甲基苯酚(BHT,分析纯):济宁宏明化学试剂有限公司;水为高纯水,其余试剂均为分析纯。
2试验方法
2.1连翘叶不同溶剂提取工艺
将新鲜连翘叶置于55℃干燥箱中干燥,粉碎过20目筛得连翘叶粉末,按1∶35(g/mL)料液比分别加入不同提取溶剂(蒸馏水、60 %乙醇、80 %乙醇、无水乙醇、乙酸乙酯),回流提取1 h,提取2次,抽滤,旋转蒸发浓缩至近干,冷冻干燥得不同溶剂提取物。
2.2多糖含量测定
采用苯酚-硫酸法测定连翘叶提取物中多糖的含量[2]。精密移取0.1 mg/mL葡萄糖标准溶液0.1、0.2、0.3、0.4、0.5、0.6、0.8、1.0 mL,置于具塞试管中,用蒸馏水稀释至1 mL,各加入6 %苯酚溶液1 mL,摇匀,迅速加入浓硫酸5 mL,沸水浴20 min,冷却至室温,于490 nm处测定吸光度,以吸光值为横坐标,葡萄糖浓度为纵坐标,绘制标准曲线。
多糖含量测定:以1 mL样品溶液代替葡萄糖标准溶液测定样品中多糖含量。
2.3总酚含量测定
Folin-Ciocalteu法测定[6]。
没食子酸标准曲线绘制:精密称取10.0 mg没食子酸标准品,溶于4 mL 50 %甲醇溶液,制备标准品溶液。准确吸取标准品溶液0.0、0.2、0.4、0.6、0.8、1.0 mL 于EP管中,用50 %甲醇补至1.0 mL。取不同浓度标准品溶液各0.2 mL,加入2.0 mL 50 % Folin-Ciocalteu试剂,混合后加入4.0 mL 0.2 g/L碳酸钠溶液,用蒸馏水定容至10.0 mL,充分振荡混匀后于25℃黑暗条件下温育2 h,在760 nm处的波长处测定吸光值。吸光值为横坐标,没食子酸浓度为纵坐标,绘制标准曲线。
总酚含量的测定:以0.2 mL样品溶液代替没食子酸标准溶液测定样品中总酚含量。
2.4黄酮含量测定
三氯化铝显色法[6]。
芦丁标准曲线绘制:精密称取17.5 mg芦丁标准品,溶于7 mL 50 %甲醇溶液,制备标准品溶液。准确吸取标准品溶液0.0、0.2、0.4、0.6、0.8、1.0 mL于EP管中,用50 %甲醇补至1.0 mL。取不同浓度的标准品溶液1 mL,加入0.1 g/L AlCl3200 μL,1 mol/L醋酸酐200 μL,加蒸馏水使反应体系为6.0 mL,充分振荡后于室温条件下放置30 min,在415 nm的波长处测定吸光值。以吸光值为横坐标,芦丁浓度为纵坐标,绘制标准曲线。
黄酮含量的测定:以1.0 mL样品溶液代替芦丁标准溶液测定样品中黄酮含量。
2.5抗氧化活性测定
2.5.1 DPPH·清除能力测定[6]
将连翘叶提取物配制成浓度分别为0.1、0.2、0.3、0.4、0.5、0.6 mg/mL的溶液,作为待测样品备用。取不同浓度样品2.0 mL,加入等体积0.09 mmol/LDPPH乙醇溶液,混匀后避光反应30 min,以乙醇代替样品为空白对照,于517nm波长处测定吸光值,DPPH·清除率按式(1)计算:

式中:A0为空白样品吸光值;As为待测样品吸光值。
2.5.2·OH清除能力的测定[7]
将连翘叶提取物配制成浓度分别为0.2、0.3、0.6、0.8、1.0、1.2 mg/mL的溶液,作为待测样品备用。取0.75 mol/L邻二氮菲无水乙醇溶液1 mL,加入磷酸缓冲液(pH 7.4)2 mL和去离子水1 mL,混匀后加入1 mL 0.75 mol/L的FeSO4,混匀,加入0.01 % H2O21 mL,37℃水浴60 min,536 nm下测其吸光值A损;以1 mL去离子水代替H2O2,吸光值为A未损;以1 mL样品代替去离子水,吸光值为A样;取2 mL磷酸缓冲液(pH7.4)和1 mL样品溶液,充分混匀后加入3 mL去离子水,吸光值为A参。取2 mL磷酸缓冲液(pH 7.4)加入4 mL去离子水,作为空白调零A空,·OH清除率按式(2)计算:

2.5.3 O2-·清除能力的测定[8]
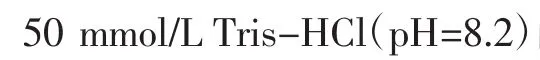
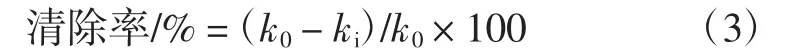
式中:k0为空白体系吸光值随时间的变化率;ki为样品体系吸光值随时间的变化率。
2.5.4 ABTS+·清除能力的测定[9]
将连翘叶提取物配制成浓度分别为0.1、0.2、0.3、0.4、0.5、0.6 mg/mL的溶液,作为待测样品备用。准确称取K2S2O40.504 7 g溶于1 L 7 mmol/L ABTS溶液中,于室温避光条件下放置12 h~16 h,制得ABTS反应液。取样品溶液1.0 mL,加入ABTS反应液1.5 mL,50 %甲醇2.5 mL,混匀,2 min后于745 nm处测定吸光值,以蒸馏水代替样品为空白对照,ABTS+·清除率按式(4)计算:

式中:A0为空白样品吸光度;As为待测样品吸光度。
2.5.5 FRAP法测定抗氧化能力[10]
标准曲线制作:取浓度分别为0.0、0.2、0.4、0.6、0.8、1.0 mmol/L FeSO4溶液各150 μL,分别加入4.5 mL FRAP试剂(由0.3 mol/L醋酸缓冲液25 mL、10 mmol/L TPTZ溶液2.5 mL、20 mmol/LFeCl3溶液2.5 mL组成),37℃水浴10 min,于593 nm处测定吸光值,以吸光值为横坐标,FeSO4浓度为纵坐标制作标准曲线。
将连翘叶提取物配制成浓度分别为0.2、0.4、0.6、0.8、1.0、1.2 mg/mL的溶液,作为待测样品备用。按标准曲线制作方法,以样品溶液代替FeSO4测定吸光值。样品抗氧化活性(FRAP值)以达到同样吸光度所需的FeSO4的毫摩尔数表示,1FRAP单位= 1.0 mmol/L FeSO4,样品的当量FeSO4值即FRAP值越大表示其抗氧化活性越高。
3结果与分析
3.1连翘叶固形物得率以及提取物中多糖、总酚和黄酮含量
多糖含量测定回归方程为Y=0.005 4X+0.046 3,R2=0.993;总酚含量测定回归方程为Y=11.73X-1.041,R2=0.997;黄酮含量测定回归方程为Y=29.17X+0.052,R2=0.994。
5种不同溶剂连翘叶提取物中固形物得率以及提取物中多糖、总酚和黄酮含量测定结果见表1。
表1连翘叶固形物得率以及提取物中多糖、总酚和黄酮含量Table 1 The solid recovery,polysaccharide,total phenols and flavonoids contents of different extracts from Forsythia suspensa leaves
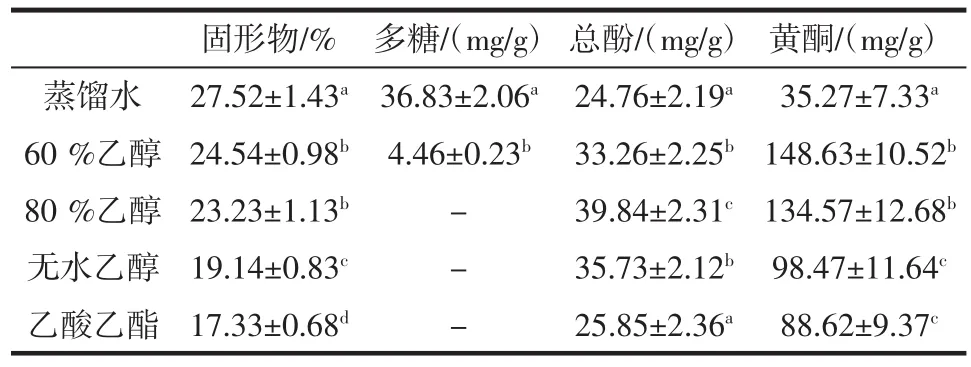
表1连翘叶固形物得率以及提取物中多糖、总酚和黄酮含量Table 1 The solid recovery,polysaccharide,total phenols and flavonoids contents of different extracts from Forsythia suspensa leaves
注:-表示成分未检出;同一列字母不同表示差异显著,P<0.05。
固形物/% 多糖/(mg/g)总酚/(mg/g)黄酮/(mg/g)蒸馏水 27.52±1.43a36.83±2.06a24.76±2.19a 35.27±7.33a60 %乙醇 24.54±0.98b4.46±0.23b 33.26±2.25b148.63±10.52b80 %乙醇 23.23±1.13b - 39.84±2.31c134.57±12.68b无水乙醇 19.14±0.83c - 35.73±2.12b98.47±11.64c乙酸乙酯 17.33±0.68d - 25.85±2.36a 88.62±9.37c
结果表明,连翘叶提取物中固形物、多糖、总酚和黄酮含量随提取溶剂的不同而不同。以蒸馏水为提取溶剂时,固形物得率最高,其次是60 %乙醇、80 %乙醇、无水乙醇、乙酸乙酯;水提取物中多糖含量最高,其次是60 %乙醇提取物,其余3种提取物中均未检测到多糖;以80 %乙醇为提取溶剂时,提取物中总酚含量最高,其次是无水乙醇提取物、60 %乙醇提取物、乙酸乙酯提取物、蒸馏水提取物;以60 %乙醇为提取溶剂时,提取物中黄酮含量最高,其次是80 %乙醇提取物、无水乙醇提取物、乙酸乙酯提取物、蒸馏水提取物。
3.2 DPPH·清除活性
连翘叶不同溶剂提取物的DPPH·清除活性见图1。
由图1可以看出,连翘叶不同溶剂提取物均具有DPPH·清除活性,在提取物浓度为0.1 mg/mL~0.6 mg/mL范围内,DPPH·清除率随提取物浓度的增加而升高,在80 %乙醇提取物浓度为0.6 mg/mL时清除率达到最大值90.64 %。
3.3 OH·清除活性
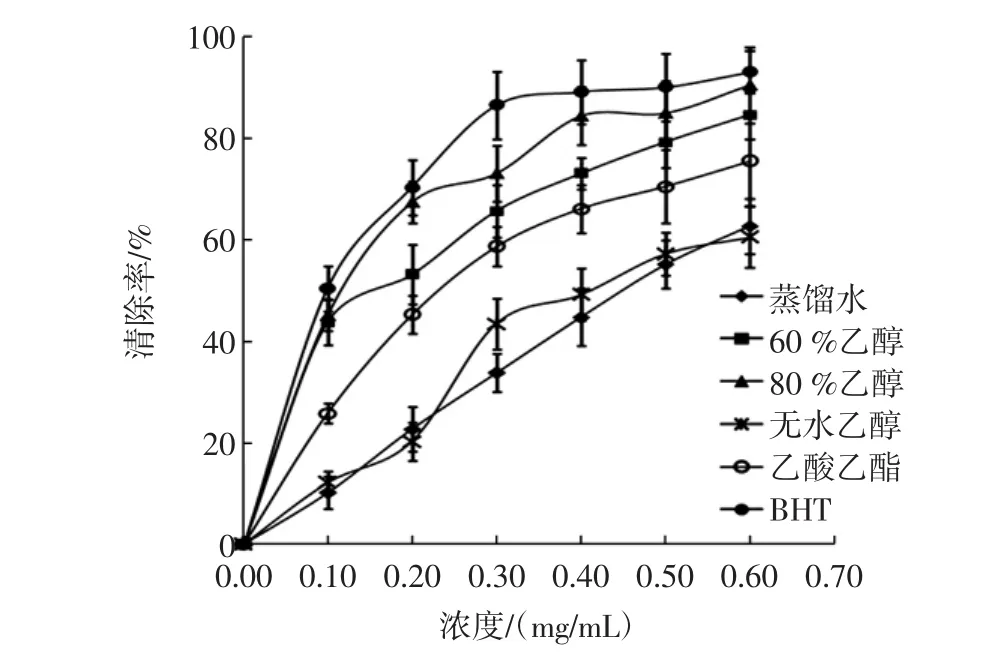
图1连翘叶不同溶剂提取物的DPPH·清除活性Fig.1 Comparison of the DPPH·scavenging activities of Forsythia suspensa leaves extracts with different solvents
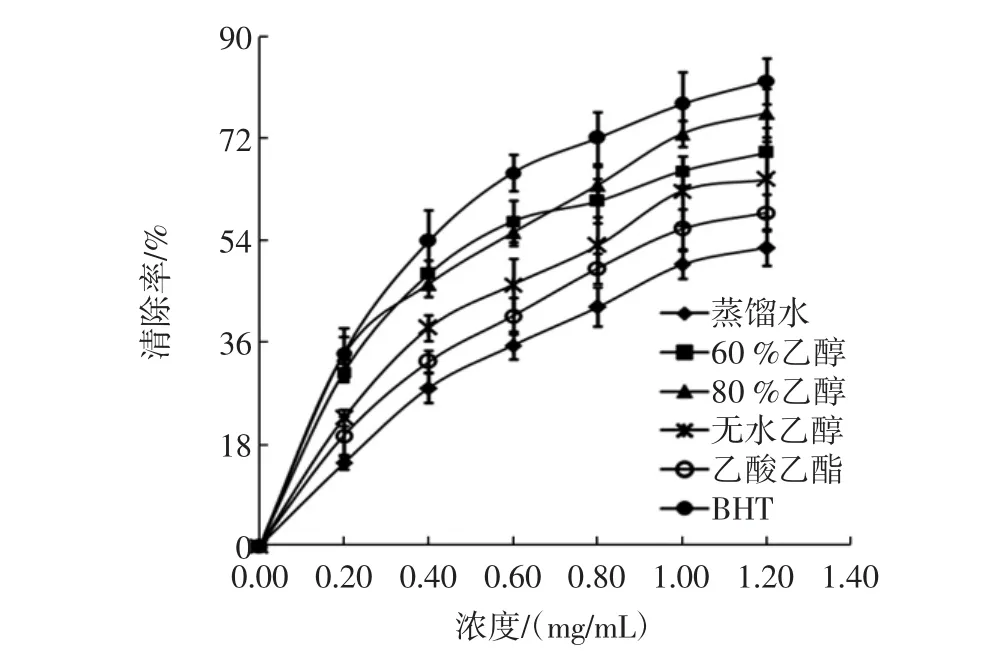
图2连翘叶不同溶剂提取物的·OH清除活性Fig.2 Comparison of the·OH scavenging activities of Forsythia suspensa leaves extracts with different solvents
连翘叶不同溶剂提取物的·OH清除活性见图2。由图2可以看出,连翘叶不同溶剂提取物均具有·OH清除活性,在提取物浓度为0.2 mg/mL~1.2 mg/mL范围内,·OH清除率随提取物浓度的增加而升高,在80 %乙醇提取物浓度为1.2 mg/mL时清除率达到最大值76.53 %。
3.4 O2-·清除活性
连翘叶不同溶剂提取物的O2-·清除活性见图3。
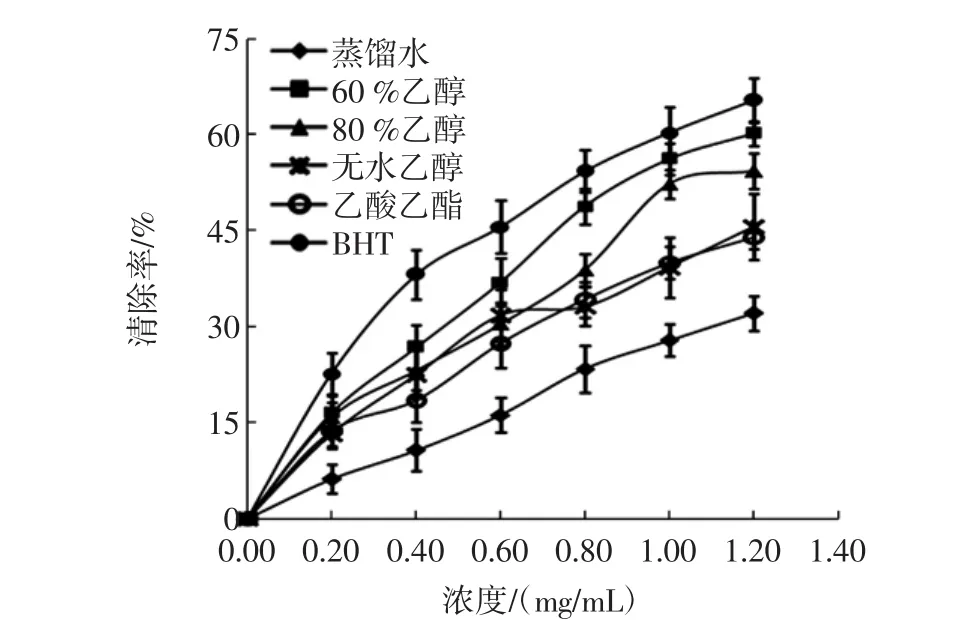
图3连翘叶不同溶剂提取物的O2-·清除活性Fig.3 Comparison of the O2-·scavenging activities of Forsythia suspensa leaves extracts with different solvents
由图3可以看出,连翘叶不同溶剂提取物均具有O2-·清除活性,在提取物浓度为0.2 mg/mL~1.2 mg/mL范围内,O2-·清除率随提取物浓度的增加而升高,在60 %乙醇提取物浓度为1.2 mg/mL时清除率达到最大值60.28 %。
3.5 ABTS+·清除活性
连翘叶不同溶剂提取物的ABTS+·清除活性见图4。

图4连翘叶不同溶剂提取物的ABTS+·清除活性Fig.4 Comparison of the ABTS+·scavenging activities of Forsythia suspensa leaves extracts with different solvents
由图4可以看出,连翘叶不同溶剂提取物均具有ABTS+·清除活性,在提取物浓度为0.1mg/mL~0.6mg/mL范围内,ABTS+·清除率随提取物浓度的增加而升高,在无水乙醇提取物浓度为0.6 mg/mL时清除率达到最大值86.23 %。
3.6 FRAP法测定抗氧化活性
FeSO4浓度回归方程:Y=0.832 1X+0.014 5,R2= 0.992。连翘叶不同溶剂提取物的铁离子还原能力见图5。
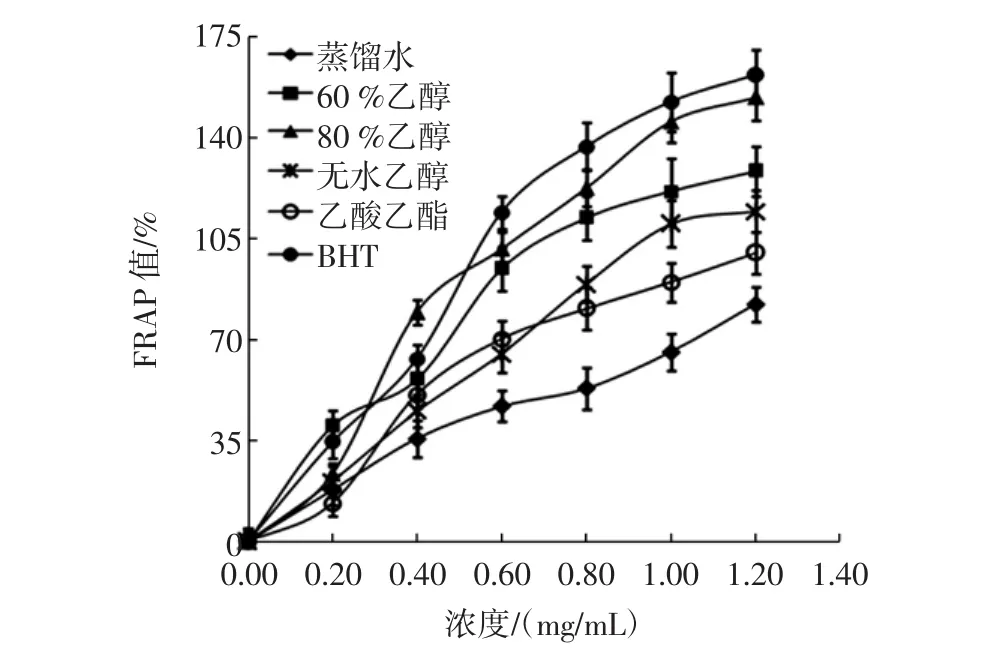
图5连翘叶不同溶剂提取物的铁离子还原能力Fig.5 Comparison of the ferric reducing antioxidant power of Forsythia suspensa leaves extracts with different solvents
由图5可以看出,连翘叶不同溶剂提取物均具有良好的抗氧化活性,在0.2 mg/mL~1.2 mg/mL范围内,各提取物抗氧化活性随提取物浓度的增加而升高,在80 %乙醇提取物浓度为1.2 mg/mL时抗氧化活性达到最大,FRAP值为154.28 %。
3.7连翘叶不同溶剂提取物中多糖、总酚、黄酮含量与抗氧化活性的相关性
连翘叶不同溶剂提取物中多糖、总酚、黄酮含量与抗氧化活性的相关系数见表2。
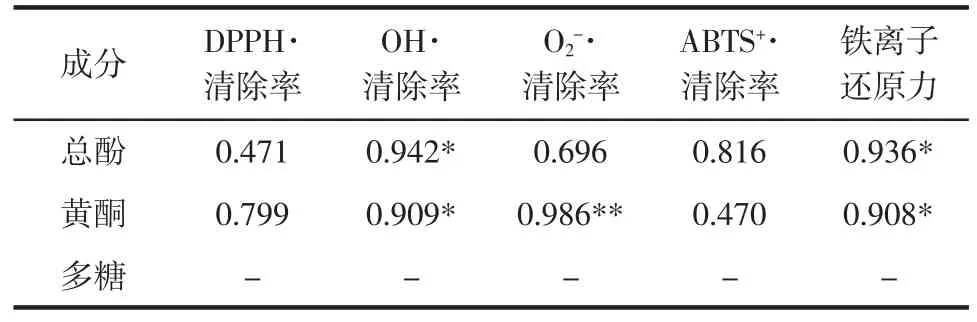
表2提取物中总酚、黄酮、多糖含量与抗氧化活性的相关性Table 2 The correlation between content of the polysaccharide,total phenols and flavonoids and the activity of different extracts from Forsythia suspensa leaves
从表2可以看出连翘叶不同溶剂提取物中总酚含量与·OH清除活性和铁离子还原能力具有较高的相关性,黄酮含量与·OH、O2-·清除活性和铁离子还原能力具有较高的相关性。
4结论与讨论
本研究分别采用蒸馏水、60 %乙醇、80 %乙醇、乙酸乙酯和无水乙醇作为提取溶剂制备连翘叶提取物,然后采用DPPH·、·OH、O2-·、ABTS+·清除活性和FRAP 法5种方法评价连翘叶不同溶剂提取物的抗氧化活性,试验结果表明连翘叶不同溶剂提取物均具有较强的抗氧化活性,均呈一定的量效关系,且不同溶剂提取物的抗氧化活性强弱顺序随评价方法的不同而不同。
多糖是生命有机体组成成分之一,是一类天然高分子化合物,近年来多糖已经成为当今医药领域的研究热点,多项研究表明天然植物多糖具有较强的抗氧化活性[11-12]。黄酮类化合物在植物中分布广泛,其抗氧化作用一直受到人们重视。另外,有相关研究报道酚类化合物是植物提取物具有抗氧化活性的物质基础,因此,本研究测定了连翘叶不同溶剂提取物中多糖、黄酮和总酚的含量,分析了黄酮和总酚的含量与抗氧化活性的相关性。结果表明总酚含量与·OH清除活性和铁离子还原能力具有较高的相关性,黄酮含量与·OH、O2-·清除活性和总抗氧化能力具有较高的相关性。因只有水提取物和60 %乙醇提取物中含有多糖,若仅根据这两种提取物中的多糖含量与这两种提取物的抗氧化活性来分析两者的相关性,则结果不具备代表性,因此本研究未对多糖含量与抗氧化活性的相关性进行分析。
当今消费者越来越重视自身健康水平,追求天然养生保健,从植物中提取天然抗氧化剂是食品、医药保健和日化行业的发展趋势。本研究表明连翘叶不同溶剂提取物有均有一定抗氧化活性,其中总酚和黄酮含量与其活性相关性较高,但仍有以下工作需要展开:①考察不同提取方法式对提取物活性的影响;②更换提取溶剂,研究提取物中多糖与其抗氧化活性的相关性;③测定提取物中其他活性成分,探讨其与抗氧化活性的相关性;④研究各活性成分的相互作用,进一步探讨抗氧化机理。
参考文献:
[1]龚艳振,徐亚键,刘华巍,等.天然抗氧化剂复配研究进展[J].食品科技,2012,37(6):264-267
[2]吕建平.连翘叶片多糖的提取、分离纯化及抗氧化性研究[D].临汾:山西师范大学,2014:1-11
[3]支旭然,苑霖,生宁,等.HPLC-MS/MS法测定不同采收期连翘叶中9种成分[J].中草药,2013,44(22):3231-3235
[4]杨建雄,杨晨,邱娟,等.连翘叶黄酮的体外抗氧化作用[J].天然产物研究与开发,2007,19(1):97-100
[5] Cui Y,Wang Q,Zhang L T,et al.Simultaneous quantificationof 14 bioactive constituents in Forsythia Suspensa by liquidchromatography-electrospray ionisation-mass spectrometry[J]. Phytochemical Analysis,2010,21(3):253-260
[6]董怡,林恋竹,赵谋明.溪黄草根不同溶剂提取物的抗氧化性[J].食品科学,2011,32(15):39-42
[7]李立,刘晔玮,李红兵.黑莓果渣不同溶剂抗氧化活性研究[J].食品工业科技,2011,32(3):116-118
[8]方玉梅,张春生,谭萍,等.金针菇黄酮类化合物的抗氧化性作用[J].食品研究与开发,2012,33(3):15-18
[9]刘雨潇,周骁昳,刘峰,等.玫瑰茄提取物多酚含量与抗氧化作用研究[J].食品研究与开发,2011,32(3):75-77
[10]田大年,黄宇.决明子茶中游离蒽醌含量及抗氧化能力的研究[J].食品研究与开发,2014,35(12):54-56
[11] Yasser F M,Kishk,Hanan M A,et al.Free-radical scavenging and antioxidative activities of some polysaccha-rides in emulsions[J].Food Science and Technology,2007,40(2):270-277
[12]葛霞,陈婷婷,蔡教英,等.青钱柳多糖抗氧化活性的研究[J].中国食品学报,2011,11(5):59-63
Study on Antioxidant Activity of Different Solvents Extracts of Forsythia suspensa Leaves
JIA Dong-sheng,LI Rong-qiao,XIE Xiao-liang*,WEN Chun-xiu,CUI Shi-zhan,LIU Ming
(Centre of Medicinal Plant Research,Institute of Cash Crops of Hebei Academy of Agriculture and Forestry Sciences,Shijiazhuang 050051,Hebei,China)
Abstract:The objective of this study was to explore the antioxidant activities of different solvent extracts of Forsythia suspensa leaves. The Forsythia suspensa leaves were extracted with distilled water,ethanol,60 % ethanol,80 % ethanol,ethyl acetate,respectively.The contents of polysaccharide,total phenolics and flavonoids were detected by the phenol -sulphuric acid method,Folin -Ciocalie method and the aluminium trichloride colorimetry method;the antioxidant activity was investigated by DPPH·clearance rate,·OH clearance rate,O2-·clearance rate,ABTS+·clearance rate and FRAP assays with BHT as positive control;the correlation between the contents of the active compounds and antioxidant properties was analyzed. All the five extracts exhibited antioxidant capacities in a dose-dependent manner,the five extracts exhibited different antioxidant abilities as the assessment methods were different.The content of total phenolics and flavonoids both had a highly significant correlation with the·OH clearance rate and the ferric reducing antioxidant power,the content of flavonoids also had a highly significant correlation with the O2-·clearance rate. The extracts that extracted by 80 % ethanol and 60 % ethanol had realitively higher antioxidant activity.
Key words:Forsythia suspensa leaves;antioxidant activity;polysaccharide;total phenolics;flavonoids
收稿日期:2015-10-22
DOI:10.3969/j.issn.1005-6521.2016.02.004
*通信作者:谢晓亮(1962—),男(汉),研究员,博士,主要从事中药资源、中药加工研究。
作者简介:贾东升(1982—),男(汉),硕士研究生,主要从事功能食品研究。
基金项目:河北省农林科学院青年基金项目(A2015050101);河北太行山区特色功能保健食品的开发研究(11231005D);河北省中药材产业体系项目(11232025D)
