直接测定壳聚糖脱乙酰度分析方法的比较
2016-02-14纪建华
纪 建 华
(汉中职业技术学院 药学与医学技术系,陕西 汉中 723000)
直接测定壳聚糖脱乙酰度分析方法的比较
纪 建 华
(汉中职业技术学院 药学与医学技术系,陕西 汉中 723000)
分别采用差示扫描量热法与红外吸收光谱法直接测定壳聚糖脱乙酰度,试验表明选择差示扫描量热曲线 295 ℃处放热分解峰峰面积作为计算参数的结果与红外吸收光谱中 A1320/A1420计算结果无统计学显著性差异,同时两种分析方法操作简便,分析时间短,故可满足相关工业生产实时分析要求。
壳聚糖;脱乙酰度;直接测定
壳聚糖是一种白色无定型,透明有光泽的天然高分子多糖化合物,因其具有良好的生物相容性和降解性等物理、化学和生物学性质,而在食品、环境、化工等领域广泛应用[1,2]。壳聚糖脱乙酰度(Degree of Deacetylation,DD %)指壳聚糖氨基上脱去乙酰基的百分比,是衡量壳聚糖性能的重要参数,直接影响其絮凝、络合金属离子及离子交换等能力[3]。
目前已有十几种分析测试方法被用于壳聚糖脱乙酰度的测定,各有优缺点。酸碱滴定法因操作简便、快速而被农业部确立为中国水产行业推荐标准[4],但在滴定前需用已知浓度的酸溶解,不能直接测定固体壳聚糖,也无法克服生产壳聚糖时吸附的残余酸碱对测定结果的干扰。
差示扫描量热法(DSC)[5]与红外吸收光谱法(IR)[6]操作简便,取样量小,测定范围广,可直接用于固体壳聚糖脱乙酰度的测定,无需提前用酸溶解,从而被广泛用于实验室分析。但对于DSC曲线上峰高与峰面积分别作为计算参数的测定结果,文献[5]未有相关的准确度与精密度评价。同时,红外吸收光谱法中分析峰与参比峰的选择,目前也没有统一的标准。本文通过选择两种分析方法不同的计算参数,直接测定壳聚糖脱乙酰度,探究最佳计算参数。
1 实验部分
1.1 试剂与仪器
不同脱乙酰度的壳聚糖样品购置于山东丰泰生物科技有限公司;盐酸、氢氧化钠、溴化钾均为分析纯;试验用水为蒸馏水。
微孔滤膜(天津津腾);FA1204B电子天平(上海精科);CJJ-781型磁力搅拌器;DZF型真空干燥箱;Scientz-50ND型冷冻干燥机;STA449F3型DSC/TGA同步热分析仪(德国耐驰);Nicolet 6700型傅里叶变换红外光谱仪(美国赛默飞)。
1.2 试验方法
1.2.1 样品制备
称取10.0 g壳聚糖样品,搅拌完全溶解于600 mL 0.5 mol/L 醋酸溶液中,通过0.45 μm滤膜过滤后,向滤液中滴加1.5 mol/L NaOH溶液至壳聚糖沉淀完全析出,依次使用蒸馏水与无水乙醇将其洗至中性,冷冻干燥取出,研磨均匀,通过100目筛过滤,放入真空干燥箱105 ℃下干燥6 h后,放置于干燥器中保存备用[7]。
1.2.2 差示扫描量热法
准确称取5 mg壳聚糖样品,放置于差示扫描量热仪内,升温速率5 ℃/min,氮气流速50 ~ 100 mL/ min,平行测定三次,在配套软件中分别计算295 ℃附近出现的放热分解峰的峰面积与峰高,通过下列公式[5,8],计算得到壳聚糖脱乙酰度。

1.2.3 红外吸收光谱法
将完全干燥至恒重的壳聚糖样品与溴化钾混合均匀压片,每片含壳聚糖20 mg,溴化钾200 mg,随即放入红外光谱仪中,设置试验参数为:分辨率4 cm-1,25 ℃下扫描20次,扫描范围4 000~400 cm-1,记录红外吸收光谱,采用ONNIC软件进行数据采集和分析。
2 结果与讨论
2.1 差示扫描量热法
随着温度的升高,壳聚糖DSC曲线,如图1所示。在295 ℃附近出现放热分解峰,归属于壳聚糖中 2-氨基-2-脱氧-β-D-葡萄糖的受热分解。在400 ℃附近出现放热分解峰,归属于壳聚糖中 2-乙酰氨基-2-脱氧-β-D-葡萄糖的受热分解。随着壳聚糖脱乙酰度的增大,295 ℃处放热分解峰的峰高与峰面积逐渐增大,而400 ℃处放热分解峰的峰高与峰面积则相应减少。

图1 壳聚糖差示扫描量热曲线Fig.1 The DSC curve of chitosan
2.2 红外吸收光谱法
壳聚糖红外吸收光谱如图2所示,在3 450 cm-1附近出现较宽的吸收谱带,归属于缔合形成氢键的-OH伸缩振动吸收峰与-NH2伸缩振动吸收峰的重叠;2 919 cm-1附近吸收谱带归属于-CH3伸缩振动;2 875 cm-1附近吸收谱带归属于-CH2伸缩振动;1 658 cm-1附近吸收谱带归属于酰胺中的C=O伸缩振动;1 565 cm-1附近吸收谱带归属于酰胺中的N-H弯曲振动;1 420 cm-1附近吸收谱带归属于-CH2、 -CH3弯曲振动;1 377 cm-1附近吸收谱带归属于-CH弯曲振动;1 320 cm-1附近吸收谱带归属于酰胺中的C-N伸缩振动;1 156 cm-1附近吸收谱带归属于糖环上不对称氧桥的伸缩振动;1 075、1 030 cm-1附近吸收谱带归属于C-O伸缩振动,896 cm-1附近吸收谱带归属于1,4-糖苷键上C-O伸缩振动,需特别注意的是,由于脱乙酰度的不同,谱图中各吸收谱带位置会出现不同偏移。分别选取1 658、1 320和3 450、1 420 cm-1附近吸收谱带为分析峰与参比峰,通过下列公式[6],求出壳聚糖脱乙酰度。


图2 壳聚糖差示扫描量热曲线Fig.2 The IR spectrum of chitosan
2.3 试验结果
差示扫描量热法与红外吸收光谱法测定壳聚糖脱乙酰度的结果见表1所示。由于DSC曲线上峰形对称性较差, H295作为计算参数时,容易引入系统误差,导致测定结果较A295作为计算参数时高。另外从表 1中可见,A1320/A1420测定结果明显高于A1655/A3450结果,与 A295计算结果相近。这是因为壳聚糖具有较强的吸水性,即使干燥充分,操作快速,1 500 cm-1附近-OH弯曲振动吸收峰与3 450 cm-1附近-OH伸缩振动吸收峰也会干扰 A1655/A3450测定结果。1 320 cm-1附近吸收峰因不受水份与-NH2的干扰,从而作为分析峰时具有较好的准确度,另外从图2中可见其吸收强度较弱,故在红外压片时,壳聚糖含量不应太低。
2.4 显著性检验
分别采用F检验法与t检验法比较差示扫描量热法A295与红外吸收光谱法A1320/A1420测定结果是否存在显著性差异,见表2所示。从表2中可见,由于F < F表,故而两种分析方法测定结果精密度没有显著性差异;t<t表也表明两种分析方法之间不存在显著性差异,测定结果较为接近。
3 结 论
本文通过差示扫描量热法与红外吸收光谱法直接测定固体壳聚糖脱乙酰度,考察了两种分析方法准确度与精密度。采用差示扫描量热法测定时,选用壳聚糖DSC曲线295℃附近放热分解峰的峰面积作为计算参数,可防止峰形对结果产生的影响。采用红外吸收光谱测定时,分别选用1 320 cm-1与1 420 cm-1附近吸收谱带作为分析峰与参比峰,避免了水份对测定结果的干扰。另外,两种分析方法操作简便、分析时间短,可直接用于固体壳聚糖脱乙酰度测定,故而可满足相关工业生产实时分析要求。
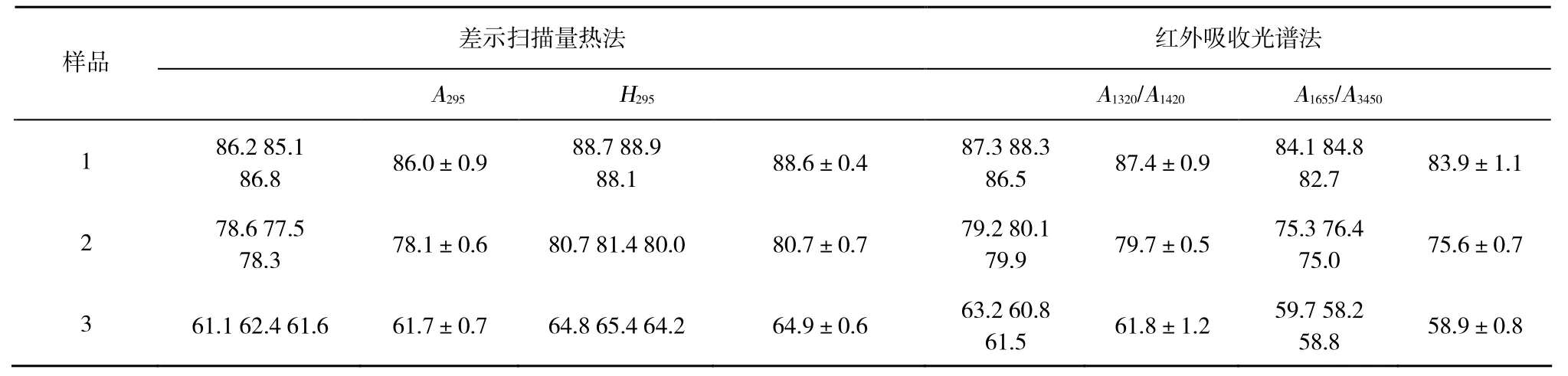
表1 差示扫描量热法与红外吸收光谱法测定结果的比较 (n=3)Table 1 Comparison of the results by DSC and IR (n=3)

表2 差示扫描量热法与红外吸收光谱法测定结果显著性检验(n=3)Table 2 Significance test of results by DSC and IR (n=3)
[1] 蒋挺大. 壳聚糖[M]. 北京:化学工业出版社,2001.
[2] 陈瑞华,王艳华,高婵娟. 粉煤灰负载壳聚糖处理印染废水的最佳实验条件[J]. 当代化工,2013(6):730-731.
[3] 王小红,马建标. 甲壳素,壳聚糖及其衍生物的应用[J].功能高分子学报, 1999(2):197-202.
[4] 中华人民共和国农业部. SC/T 3403-2004 [S]. 北京:中国标准出版社,2005.
[5] Garcia A I,Peniche-Covas C,Nieto J M.Determination of the degree of acetylation of chitin and chitosan by thermal analysis [J]. Journal of Thermal Analysis,1983,28:189-193.
[6] Kasaai M R. A review of several reported procedures to etermine the degree of N-acetylation for chitin and chitosan using infrared spectroscopy [J]. Carbohydrate Polymers,2008,71:497-508.
[7] Santos Z M,Caroni A L P F,Pereira M R,et al. Determination of deacetylation degree of chitosan:a comparison between conductometric titration and CHN elemental analysis [J].Carbohydrate Research,2009,344:2591-2595.
[8] Guinesi L S,Cavalheiro E T G. The use of DSC curves to determine the acetylation degree of chitin/chitosan samples [J]. Thermochimica Acta,2006,444:128-133.
Comparison of Two Analytical Methods for Direct Determination of Deacetylation Degree of Chitosan
JI Jian-hua
(Department of Pharmacology, Vocation and Technology College of Hanzhong, Shaanxi Hanzhong 723000,China)
The degree of deacetylaion of chitosan samples was directly determined by differential scanning calorimetry and infrared spectroscopy. The results show that there is no difference between the results calculated by the peak area at 295 °C in DSC curve and A1320/A1420in the IR spectrum. With merit of simplicity, convenience and quickness, they can meet the demand of corresponding industrial production real-time analysis.
chitosan; degree of deacetylation; direct determination
O 657
A
1671-0460(2016)12-2727-03
2016-05-08
纪建华(1982-),男,陕西汉中人,讲师,硕士,研究方向:从事药物分析研究。E-mail:jhjichemistry@sina.com。
