阿斯巴甜对果蝇中间神经元胆碱能突触电活动的影响
2015-12-16吴诗哲齐旻悦
王 琦 吴诗哲 齐旻悦
1(中山大学 中山医学院,广州510080)
2(中山大学 生命科学生命科学大学院,广州510275)
阿斯巴甜(Aspartame),学名天门冬酰苯丙胺酸甲酯,俗称甜味素,目前作为甜味剂和增味剂已在多个国家的食品工业中得到了广泛应用。近年来,随着食品安全问题日益得到重视,阿斯巴甜的生物安全问题再次引起了相关科研机构的关注[1]。因此,有必要利用电生理技术进行更进一步的细胞水平研究,通过分析不同剂量阿斯巴甜对神经元的自发放电、微小兴奋性突触后电流等生物电活动的影响,从而为进一步评估阿斯巴甜的生物安全性提供依据。
果蝇的嗅神经环路是果蝇研究最深入的系统之一,其解剖结构也已被详细描述[2,3],嗅神经环路可以调控其很多高级的行为,如求偶、觅食、学习记忆等,同时在解剖学和形态与功能方面,具有高度的保守性[4]。从果蝇的嗅神经环路入手,探究物质的神经毒性以及评估物质对果蝇中枢神经系统的影响是一种重要的实验手段[5]。
膜片钳技术是由德国生理学家Neher和Sakmann建立的一种以记录通过离子通道的离子电流反映离子通道活动的技术[6,7],是离子通道研究的“金标准”,可直接为分子水平的生物膜离子通道特性,如门控动力学特征、药理学特征、膜的通透性和选择性等提供实验证据。在具体的实验过程中,利用负反馈电子线路设计,可将已破膜的目标细胞(通常直径为数μm2)的膜电位钳制在一定水平,从而观察和测定流过膜通道的离子电流。1980年后,随着该技术的日臻完善,其在神经科学领域的应用逐渐流行,大大促进了神经药理、神经系统网络研究和形态学以及神经系统电生理特性等相关领域的发展。应用膜片钳记录在通道电流,可研究不同时间、不同部位、细胞膜内外等条件下不同浓度的单体物质对通道功能的影响。这对深入了物质理学特性,药物的生物安全性评估,以及对人和动物的生理功能影响,提供了分子水平的实验证据。在膜片钳的实验结果基础上可进一步研究相关通道蛋白质亚结构与功能的关系。
1 实验材料
1.1 果蝇品系与饲育
黑腹果蝇Drosophila melanogaster采用野生型Canton-S(CS),饲养环境为人工气候箱,温度为25±0.5℃,相对湿度为60±5%,光照周期为昼夜各12h循环光照;使用常规果蝇培养基饲育。配方如下:

表1 果蝇饲育培养基配方
制作步骤:(以800ml量为例)蔗糖52g,玉米粉68g,琼脂6g,双蒸水800ml,搅拌均匀;上述混合液放入电饭锅煮沸,间断开盖搅拌均匀,以防玉米粉沉淀结块;煮沸两次后加酵母粉5.6g搅拌均匀;再次沸腾后加丙酸4ml搅拌均匀;分装入培养瓶并塞紧海绵塞,防止外来果蝇飞入产卵,造成果蝇品系污染。
1.2 设备与耗材
果蝇培养人工气候箱:上海一恒牌 MGC-450HPY-2;激光共聚焦显微镜:德国Zeiss LSM710;膜片钳实验平台显微镜:日本Olympus BX51WI;解剖显微镜:德国Zeiss公司;放大器:美国Axon公司 Multiclamp 700B;数模转换器:美国Axon公司Digidata 1440A;显微操纵仪:美国Sutter MP225;浴槽:RC-26chamber;石英电极:美国Sutter公司。
1.3 实验试剂
1)果蝇全脑解剖用酶液:木瓜蛋白酶;激动剂为L-半胱氨酸(L-cysteine);蛋白酶冻存液配制:将纯度为≥99%的木瓜蛋白酶冰上分装为5μL/支,冻存于-20℃。
2)单细胞记录用细胞外液:
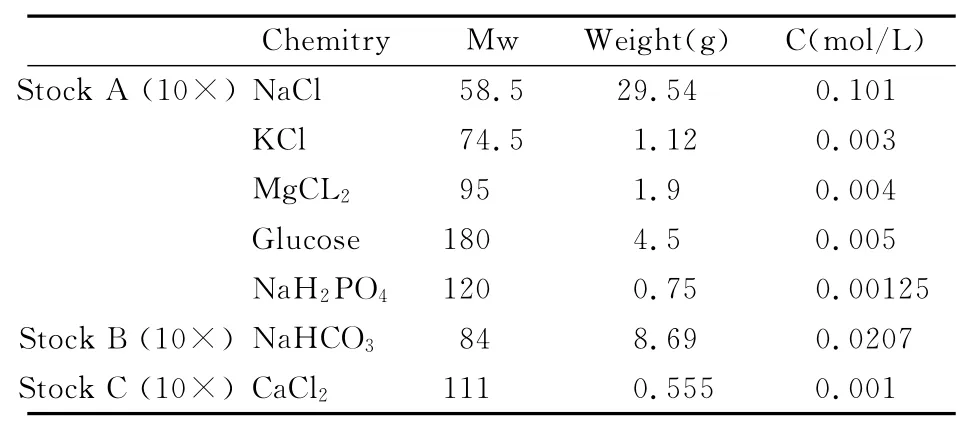
表2 单细胞记录用细胞外液母液配比(5L,pH=7.2,Osm=250)
上述母液存放于4℃保存,每次实验前配置细胞外液,方法如下(以100ml细胞外液为例):80ml超纯水+10ml Stock A+10ml Stock B+20μl Stock C,得到100ml实验用细胞外液。
3)果蝇细胞内液:
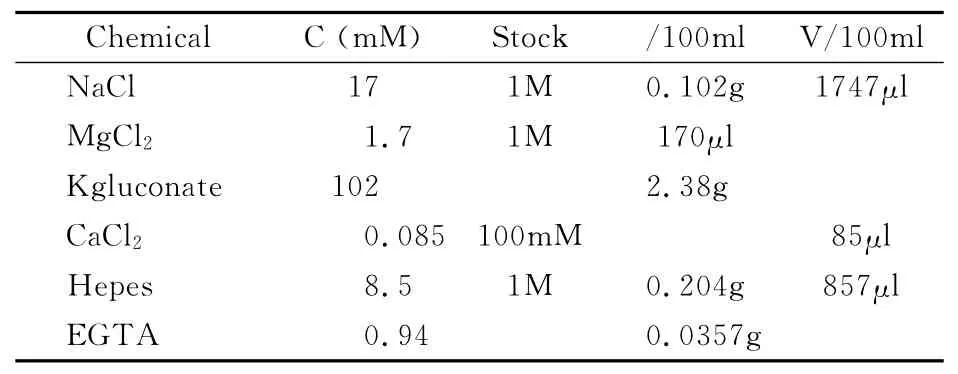
表3 单细胞自发放电记录用细胞内液配比(100ml,pH=7.2,Osm=235)
4)Confocal成像用液体:4%formadldehyde,0.01MPBS(pH7.4),Tris-PBS(含0.2%Tris-ton),PBST(含5%BSA),购于广州化学试剂厂;鼠源nc 82抗体,羊抗鼠 Alexa Fluor 488 抗体,Rhodamine-adidin染料,阿斯巴甜单体;购于Sigma试剂公司;
2 实验方法
2.1 实验前准备
将制备好的新鲜细胞外液通入氧气(95%O2+5%CO2)至氧饱和;预热电极拉制仪30min,并拉制电极使,确认膜片钳的刺激/记录电极表面镀有一层均匀的Agcl;,解冻提前分装并冻存的细胞内液一支;,制备蛋白酶激动液:用上述氧饱和的细胞外液加入L-半胱氨酸制备浓度为1μmol/L的激动液,充分混匀后静置备用;,配制解剖果蝇全脑用蛋白水解酶:解冻后加细胞外液稀释至70倍,按照体积比酶液∶激动液=8∶1的比例制备解剖用蛋白水解酶,充分混匀后静置备用。
2.2 果蝇全脑急性解剖
黑腹果蝇的三龄幼虫个体较大,脑组织最大,虫体包裹在透明的硬膜内,易于神经组织的定位和解剖,因此是研究中枢神经系统时常用的实验材料。本章实验果蝇全脑来自孵化前两天的三期幼虫。解剖体系使用当日配制并氧饱和的细胞外液。利用一次性注射器将三七幼虫的头部取下,剥去硬膜以及第二层膜后浸入配制好的木瓜蛋白酶酶液。静置3 min,剥离果蝇脑外壳,此时可见全脑神经组织包裹在气囊硬膜下。静置待酶液消化周围结缔组织鞘,轻轻剥离气囊,得到膜片钳记录用果蝇全脑脑片。利用细胞外液洗涤脑组织三次,移入记录浴槽并注入2ml细胞外液。利用特制的铂金丝hoder固定浴槽内的果蝇脑片,使待记录的功能区域暴露。此时可移入膜片钳操作台进行记录。在电生理记录过程中全程采用连续流动的含氧细胞外液灌流贯,并且保持浴槽液面平稳[8,9]。
2.3 电生理记录
使用HEKA Patchmaster记录软件。目标细胞形成GΩ级高阻封接,给与短暂负压破膜,待细胞状态稳定后,将细胞钳制在-70mV电位进行记录。选取细胞状态良好的数据。待电压钳电信号稳定后,加入TTX和PTX阻断钠离子通道产生的自发性和动作性电流以及GABA通道产生的抑制性电流,加入阻断剂3min以后读取数据,此时记录mEPSC。加入不同浓度阿斯巴甜溶液,3min后记录给药后mEPSC。
2.5 目标神经元的confocal成像
果蝇的PNs神经元confocal成像采用注射染料法:实验前将0.4%生物素(biocytin)加入果蝇内液。急性分离出果蝇全脑后在60倍水镜下找到果蝇的触角叶(Antennal Lobe,AL),位于 AL上层的神经元为PNs。把含有0.4%biocytin的内液充盈至微电极约1/3,轻弹电极中部,待尖端气泡完全排除后安装在电极夹持器上。用显微操纵器使电极尖端进入浴槽中细胞外液液面以下,给与适当正压并补偿液接电位。本章实验用微电极充盈细胞内液后尖端如水电阻在10~15MΩ范围。选取视野内细胞状态良好的作为目标细胞,通常要求胞体折光度好、胞体较规则、表面光滑有立体感的细胞,细胞周围无明显杂质。调节微电极至目标细胞附近,靠近并给予负压,此时微电极与目标细胞膜形成GΩ级的高封接电阻。持续2min以上,待细胞状态稳定,给予适当短暂负压,此时细胞破膜,若漏电流绝对值低于-50pA,且静息电位低于-40mV,认为细胞破膜成功且状态良好。维持该状态40min以上,使电极内液中的生物素充分扩散到目标细胞胞体,轻轻撤去电极,所得果蝇脑样本用于confocal成像实验。
果蝇脑样品置于200ml的4%福尔马林溶液中于4℃过夜固定(固定时长3h以上即可,过夜固定效果较好)。配制0.01MPBS溶液(pH=7.2±0.1)。利用该溶液将固定后的果蝇脑样品洗涤3次。漂洗后的样品置于200ml含0.2%Triton的PBST透明20min~30min。置于200ml含5%BSA的PBST终止反应。然后按照体积比10∶1加入鼠源抗体nc 82,该体系置于4℃孵育24h。孵育后的样品用PBS溶液重复洗涤,每次洗涤三次,中间间隔20min。按照体积比加入200∶1的羊抗鼠Alexa Fluor 488抗体、500∶1rhodamine-avidin染料、200∶1streptavidin-CY3抗体,静置于4℃孵育24h。按照上述重复洗涤的方法用PBS洗涤样本后制片、封片。于激光共聚焦显微镜下进行观察并拍照。所得数据在Imaris 6.4.2软件中进行3D重建并输出。
2.6 数据统计与分析
使用mini analysis数据分析软件进行分析:使用Fitmaster打开原始数据文件;将文件转换成ABF格式;用mini analysis软件读取转换后的文件,进行mEPSC分析。数据选取条件为:幅值小于20mV、rising time小于10ms、rising time大于decay time。被选取的信号被mini60计入统计并分析。P<0.05为差异有统计学意义,组间差异统计使用独立样本t检验。分析软件使用clampfit 10.0。图形和数据分析使用SPSS 11.0。数据输出和图像绘制使用 Origin 8.0、Microsoft Visio 2007。
3 实验结果
3.1 PNs神经元在果蝇全脑的激光共聚焦成像
图1为果蝇脑单个PN神经元的激光共聚焦实验结果。本实验所选择PNs神经元主要位于果蝇触角叶垂直上方,胞体直径约为10~20μm。该结果显示了果蝇PNs胞体位于Antenna Lobe,其投射可到达蘑菇体和外侧角。

图1 蝇PNs神经元的形态和位置
3.2 不同浓度阿斯巴甜对PNs神经元mEPSCs的影响

图2 加入不同浓度阿斯巴甜后果蝇PNs神经元mEPSCs的记录
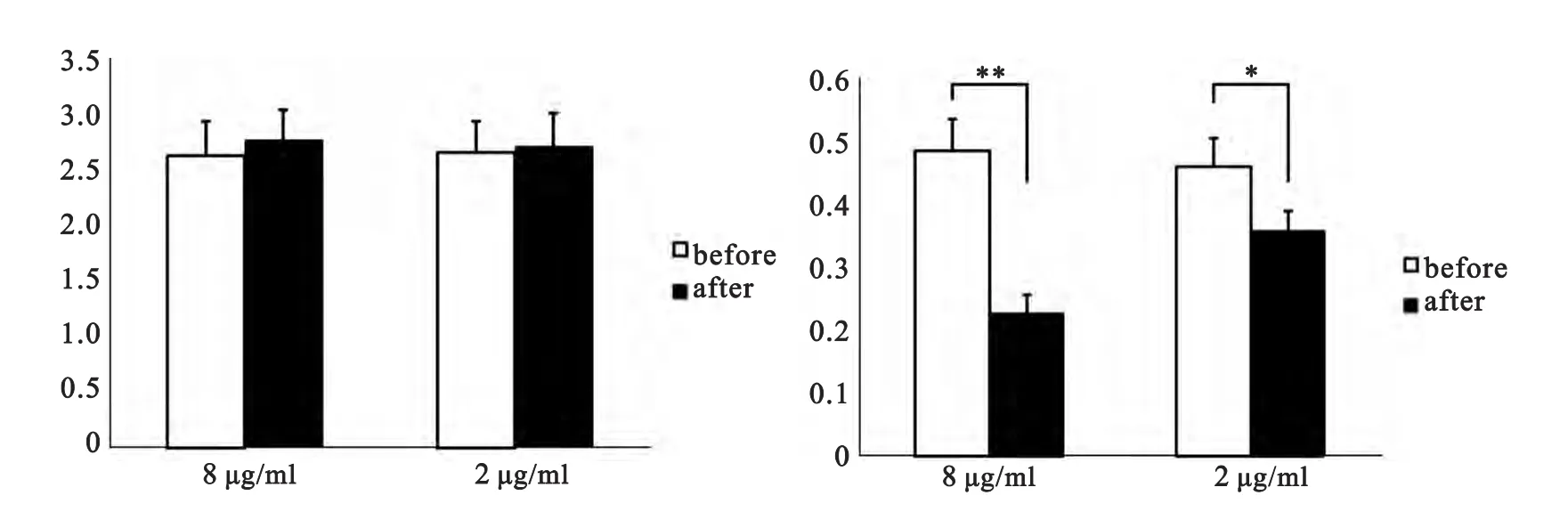
图3 不同浓度阿斯巴甜对果蝇PNs神经元mEPSCs的影响
本实验采用全细胞膜片钳记录方法,将外液灌流时加入TTX和PTX以阻断GABA受体,实验结果表明,给药3min后mEPSCs的幅值有如下不同:高浓度组 mEPSCs的幅值为(2.75±0.2)pA,与给药前(2.63±0.3)pA 相比没有统计学差异(P>0.05;n=12);低浓度组 mEPSCs的幅值为(2.68±0.2)pA,与给药前(2.66±0.2)pA相比差异无统计学意义(P>0.05;n=12);给药3min后 mEPSCs的频率有如下不同:高浓度组mEPSCs的频率为(0.21±0.03)Hz,与给药前(0.48±0.05)Hz相比频率明显降低且具有非常显著的统计学差异(P<0.01;n=12);低浓度组 mEPSCs的频率为(0.36±0.02)Hz,与给药前(0.45±0.03)Hz相比差异具有显著的统计学差异(P<0.05;n=12)(见图2、图3)。实验发现,高浓度的阿斯巴甜非常显著降低果蝇PNs的mEPSCs频率,而低浓度组降低效果较弱,但依旧具有统计学差异。两个浓度均对mEPSCs的幅值没有影响。
3.3 不同浓度阿斯巴甜对PNs神经元sAP的影响
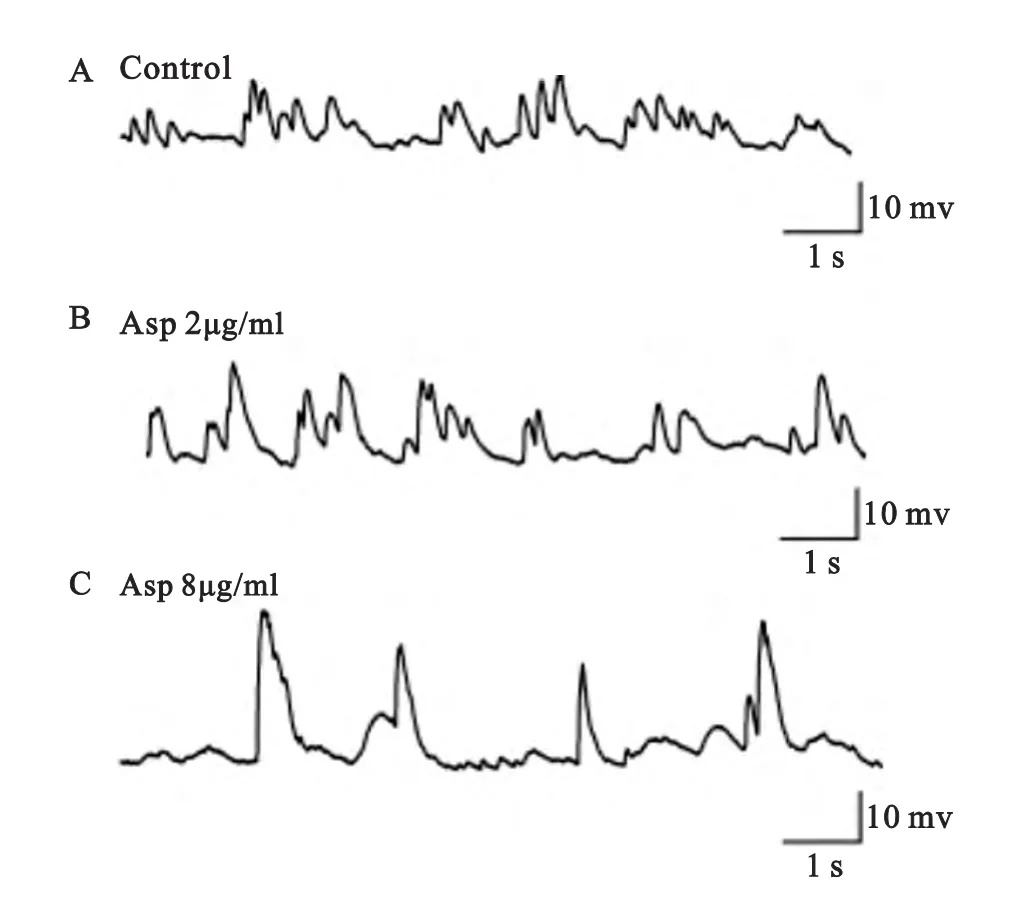
图4 加入不同浓度阿斯巴甜后果蝇PNs神经元sAP的记录
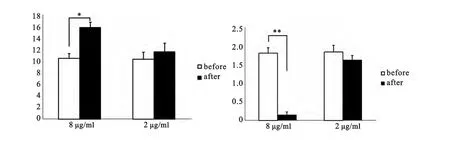
图5 不同浓度阿斯巴甜对果蝇PNs神经元sAP的影响
本实验采用全细胞膜片钳记录方法,记录给予不同浓度阿斯巴甜后果蝇投射神经元胆碱能突触电流钳模式下自发电活动,实验结果表明,给药3min后sAP的幅值有如下不同:高浓度组sAP的幅值为(15.7±0.5)mV,与给药前(10.8±0.4)mV 相比频率明显降低且具有显著的统计学差异(P<0.05;n=12);低浓度组sAP的幅值为(11.9±0.7)mV,与给药前(11.3±0.6)mV相比差异无统计学意义(P>0.05;n=12);给药3min后sAP的频率有如下不同:高浓度组sAP的频率为(0.13±0.08)Hz,与给药前(1.78±0.11)Hz相比频率明显降低且具有非常显著的统计学差异(P<0.01;n=12);低浓度组sAP的频率为(1.59±0.07)Hz,与给药前(1.79±0.13)Hz相比差异无统计学意义(P>0.05;n=12)(见图4、图5)。实验发现,给予急性分离的果蝇脑组织高浓度的阿斯巴甜后可以显著增加果蝇PNs的sAP幅值,同时非常显著降低sAP频率,而低浓度组在上述实验中均未表现出具有统计学意义的差异。
4 讨论
阿斯巴甜是食品工业广泛使用的人造甜味剂,有生化代谢研究表明其在人体内的肠道酯酶和肽酶的作用下可产生3种主要代谢产物:天门冬氨酸、苯丙氨酸和甲醇。虽然阿斯巴甜的安全性通过了多个国家相关食品安全部门的检验,但是越来越多的研究证据使得人们对它的安全性提出质疑。有欧洲的科研机构发现在给与大鼠一定量阿斯巴甜的条件下有引起实验动物多脏器肿瘤的风险,包括白血病、神经鞘瘤和淋巴细胞瘤。部分神经毒理学研究显示,高剂量的阿斯巴甜(>1000mg/kg)可以改变实验大鼠中枢神经系统中神经递质的水平[10,11],其原因可能是阿斯巴甜的代谢产物之一苯丙氨酸与其他中性氨基酸竞争性通过血-脑屏障,并因此改变大脑血液中苯丙氨酸与中性氨基酸的比值,增加脑内苯丙氨酸的水平,最终干扰中枢神经系统单胺类神经递质的传递[12]。此外,还有报道显示阿斯巴甜会引起偏头痛、老年痴呆症[13]等,因此在突触水平研究阿斯巴甜对离子通道的影响对于揭示其生物安全性有重要意义。
果蝇有四对染色体,包含人类基因80%的同源基因,而且这些同源基因的功能相似[14]。虽然果蝇的中枢神经系统简单却调控着如学习记忆、求偶、睡眠、抉择等一系列复杂的行为活动。在进化方面,果蝇的基因具有较高的保守性,因此利用果蝇为研究材料制造疾病模型已广泛应用在当前的转化医学研究中,以果蝇为模型研究神经系统的一些基本问题,是一个简捷而有效的途径[15-17]。本研究所用果蝇全脑组织由急性分离制得,基本保留了完整的神经网络包括胆碱能通路,符合实验需要。在果蝇脑的中央区,位于触角叶的投射神经元,即PNs约为200个,是嗅觉信息处理的二级神经元,可接收来自嗅觉神经元和中间神经元传递的信息。PNs既是胆碱神经元又是胆碱受体神经元,可接受来自嗅觉受体神经元的胆碱能突触传入信息和潜在的侧枝兴奋性输入,其轴突可进一步将投射到蘑菇体和外侧角,将信息整合并传达至果蝇的第三级嗅觉中枢。有研究者通过对果蝇PNs电活动的探究从而探讨神经药理学机制[18]。
突触的活动是神经系统实现其功能的重要基础和关键环节。对于突触后电流的研究,有助于进一步探讨不同神经元之间网络信号传递的发生,进一步揭示相关的生物学机制。突触可塑性与学习记忆有关,其中信号传递过程受到囊泡释放、突触后神经元响应等环节调控。全细胞记录的神经元电活动,在时间和空间上具有总和性。自发性电活动反映的是细胞膜所有离子通道电活动特性的总和,本实验中高浓度的阿斯巴甜对于sAP的幅值和频率均有显著影响,说明该人造甜味剂对果蝇中枢神经元细胞膜离子通道活动有一定的影响。昆虫的中枢神经系统内,主要兴奋性递质系统是胆碱能的,本研究所涉及的果蝇嗅神经环路属胆碱能系统,是果蝇学习记忆神经环路重要的组成部分,因此研究给药前后微小兴奋性突触后电流变化对探明药物作用机制和突触可塑性影响有重要作用。实验中,mEPSCs频率的变化说明了不同浓度阿斯巴甜对果蝇PNs的突触前膜释放乙酰胆碱的数量有影响,且高浓度的影响更为显著。因此,阿斯巴甜可通过调控果蝇神经系统胆碱能输入环路从而产生一定的生物学影响。考虑到mEPSCs与突触可塑性具有紧密联系,因此可推断阿斯巴甜可能对突触可塑性具有潜在的影响,该影响可能是这种人造甜味剂引起偏头疼和老年痴呆症的生物学机制之一。mEPSCs反映了突触前膜和突触后膜的调控,涉及囊泡释放与受体结合等多个生物化学过程,因此阿斯巴甜对神经中枢的影响可从相关离子通道的角度进一步深入探究[19,20]。
果蝇的嗅神经环路与其多个复杂的高级神经网络调控的行为密切相关。此外果蝇是研究脊椎动物的优良模式生物,它的嗅觉反映生理学和行为学的相关研究近年来是神经科学领域的重要课题[21],许多毒理学和转化医学的发现均以此为研究基础。本研究以触角叶为切入点,探讨人造甜味剂阿斯巴甜对果蝇中枢神经系统的影响,从而对评估其生物安全性提供可靠的参考。
[1] SCF.Opinion of the Scientific Committee on Food:update on the safety of aspartame[EB/OL].[2008-10-20].http://www.food.gov.uk/multimedia/pdfs/aspartameopinion.pdf.
[2] Su CY,Menuz K,Carlson JR.Olfactory perception:receptors,cells,and circuits[J].Cell,2009,139:45-59.
[3] Wilson RI,Turner GC,Laurent G.Transformation of olfactory representations in the Drosophila antennal lobe[J].Science,2004,303:366-370.
[4] Axel R.Scents and sensibility:A molecular logic of olfactory perception(Nobel lecture)[J].Angewandte Chemie International Edition,2005,44:6110-6127.
[5] Qiao J,Zou X,Lai D,Yan Y,Wang Q et al.Azadirachtin blocks the calcium channel and modulates the cholinergic miniature synaptic current in the central nervous system of Drosophila[J].Pest Management Science,2014,70(7):1041-1047.
[6] Hamill OP,Marty A,Neher E,et al Improved patch clamp techniques for high resolution current recording from cells and cell free membrane patches[J].P flugers Arch,1981,391:85-100.
[7] Sakmann B,Neher E.Single channel recording[M].Plenum Press,New York and Lond,1983.
[8] Gu H,O′Dowd,DK.Cholinergic synaptic transmission in adult Drosophila Kenyon cells in situ.The Journal of Neuroscience,2006,26,265.
[9] Gu H,O′Dowd,DK.Whole cell recordings from brain of adult Drosophila.Journal of Visualized Experiments,2007,6:248.
[10] Tollefson L.Monitoring adverse reactions to food additives in the us food and drug administration[J].Regulatory Toxicology and Pharmacology,1988,8(4):438-446..
[11] Lajth A.Aspartame consumption:Lack of effects on neural function[J].J Nutr Biochem,1994,5(6):226-283.
[12] Wurtmanr J.Neurochemical changes following high-dose aspartame with dietary carbohydrate[J].N Engl J Med,309(7):429-430,1985.
[13] Koehler SM,Glaros.The effect of aspartame on migraine beadche[J].Headache,1994,28:10-14.
[14] Adams MD,Celniker SE et al.The genome sequence of Drosophila melanogaster.[J]Science,2000,287:2185-2195.
[15] Keene AC,Waddell S.Drosophila olfactory memory:single genes to complex neural circuits[J].Nature Reviews Neuroscience,2007,8:341-354.
[16] Muqit MMK,Feany MB.Modelling neurodegenerative diseases in Drosophila:a fruitful approach[J].Nature Reviews Neuroscience,2002,3:237-243.
[17] Rubin GM,Lewis EB.A brief history of Drosophila′s contributions to genome research.Science,2012,287:2216-2218.
[18] Dongzhi Ran,Song Cai et al.Di(2-ethylhexyl)phthalate modulates cholinergic mini-presynaptic transmission of projection neurons in Drosophila antennal lobe[J].Food and Chemical Toxicology,2012,50:3291-3297.
[19] Simkus CRL,Stricker,C.The contribution of intracellular calcium stores to mEPSCs recorded in layer II neurones of rat barrel cortex[J].The Journal of Physiology,2002,545,521.
[20] Yamasaki M,Hashimoto K,Kano M.Miniature synaptic events elicited by presynaptic Ca2+rise are selectively suppressed by cannabinoid receptor activation in cerebellar Purkinje cells[J].The Journal of Neuroscience,2006,26,86.
[21] Su H,O′Dowd DK.Fast synaptic currents in Drosophila mushroom body Kenyon cells are mediated by alpha-bungarotoxin-sensitive nicotinic acetylcholine receptors and picrotoxinsensitive GABA receptors[J].Journal of Neuroscience,2003,23,9246-9253.
