体外培养条件下SCF与RA对昆明小鼠精原干细胞增殖的影响
2015-12-16余荣娇刘向国
刘 茜 余荣娇 张 凯 洪 燕 刘向国
(安徽中医药大学 组胚生物学教研室,合肥230008)
精原干细胞(spermatogonial stem cells,SSCs)是生长于生精小管上皮近基底膜区域的雄性生殖干细胞,是精子发生的起始细胞,它既能自我增殖,又能分化成为精母细胞,从而维持体内精子数量的恒定,对维持机体的繁殖能力起重要作用。SSCs是雄性动物中唯一能将遗传信息传递给后代的干细胞,具有很强的可塑性,但人们对其中许多发育和调控机制并不太了解。文献报道干细胞因子 (stem cell factor,SCF)[1]和维生素 A(VA)[2]对小鼠精原干细胞体外增殖发挥一定的作用,但两种因素之间有无交互作用尚无相关研究报道,笔者采用析因设计,对两者之间作用进行了研究,报道如下:
1 材料和方法
1.1 材料1.1.1 酶和试剂 DMEM 培养基、胎牛血清、非必需氨基酸、B-巯基乙醇、丙酮酸钠购自GIBCO BRL公司,胶原酶IV、胰蛋白酶、透明质酸酶、全反式维甲酸(all transretinoic acid,RA)、噻唑蓝(MTT)、二甲基亚砜(DMSO)购自SIGMA公司,Percoll为Pharmacia公司产品,L(+)谷氨酰胺购自中国医药公司;C-KIT受体试剂盒,SCF(stem cell factor)购自Invitrogen公司。
1.1.2 实验动物 7~8日龄的雄性昆明小白鼠,安徽医科大学实验动物中心提供。
1.2 方法
1.2.1 分离纯化小鼠精原干细胞 采用一步酶消化法[3],将离散的生精小管小段用含1%双抗的PBS漂洗2遍后移入离心管中,加入中性蛋白酶H,37℃消化20~30min,期间不时震荡离心管或用移液枪反复吹吸;待消化液中出现白色絮状漂浮物时收集消化液800r/min离心3min,去上清液后用DMEM洗涤1次,用mSSCs培养液重悬;将悬液用200目尼龙筛过滤,收集滤液,将其接种至含小鼠成纤维细胞饲养层的培养皿中。
1.2.2 精原干细胞培养 将细胞悬液接种于96孔培养板中,按照RA浓度(1g/L、2g/L和4g/L)和SCF浓度(20ng/ml、30ng/ml和40ng/ml)全面组合,实验共分9组,每组设3个重复,置于34℃、5%CO2、100%湿度条件下培养。待24h细胞贴壁后,除对照组外,各组分别加入事先配置好的不同生长因子和维甲酸的培养液。每隔8~12h观察细胞的存活及分裂增殖情况。在加入生长因子72h后对各组进行MTT检测。
1.2.3 MTT检测 0.25%胰蛋白酶消化单层培养细胞,用DMEM培养液制成单细胞悬液,以103~104个每孔的密度接种于96孔培养板中;37℃、5%CO2及100%湿度条件下培养3~5d后,每孔加入MTT溶液(5mg/ml)20uL,37℃孵育4h,终止培养,弃上清。每孔加入150μl DMSO,振荡10min。选择490nm波长,在酶联免疫检测仪上测定各孔的光吸收值,记录结果。
1.2.4 增殖的细胞作组织学染色行C-KIT受体鉴定。
1.3 统计学分析 采用SPSS 21.0进行统计分析,计量资料采用(±s)表示,采用析因设计方差分析,检验水准取α=0.05。
2 结果
2.1 培养24h后和72h后C-KIT受体检测结果
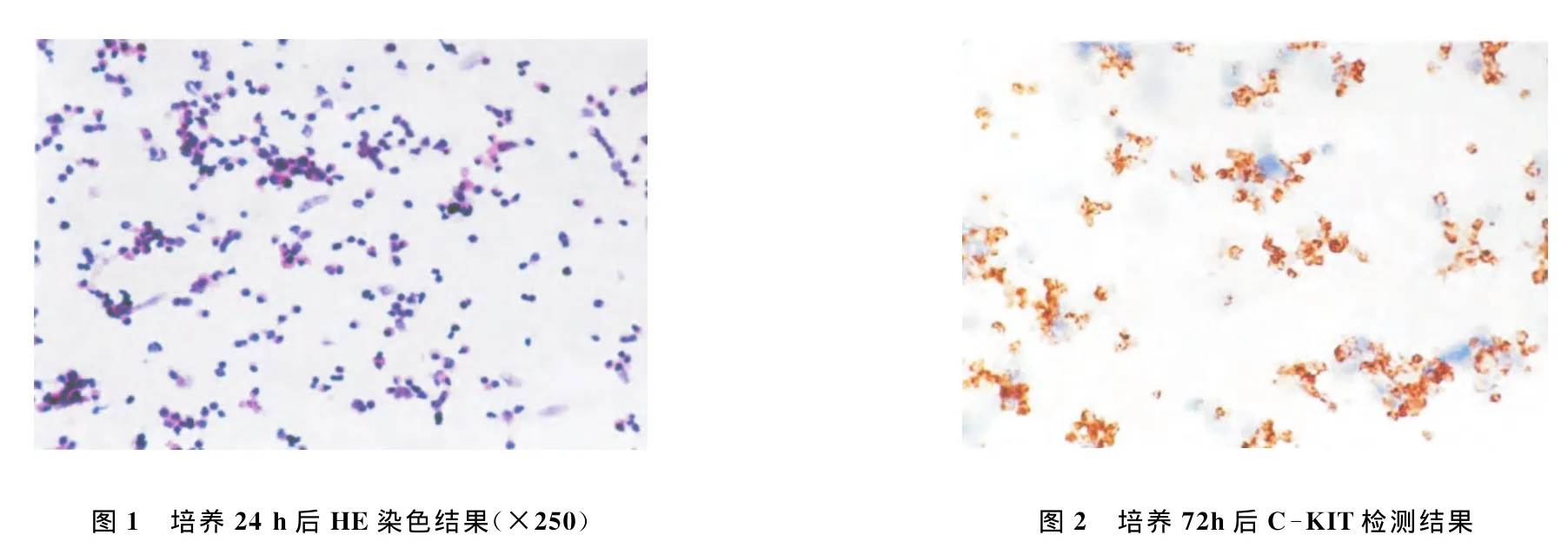
HE染色见增殖的精原干细胞为圆形,细胞大小均匀,胞体较小、核大而圆着色深,胞质浅染、核/质比高;而背景的基质细胞呈梭形,胞质着色相对较浅,见图1;C-KIT受体显示培养72h后的精原干细胞膜染成深黄褐色,胞质和细胞核不作色,背景基质细胞为阴性,见图2。
2.2 析因设计结果
2.2.1 SCF与RA主效应各水平组比较 固定RA因素影响,SCF各组OD值结果见表1;固定SCF影响,RA各组OD值结果见表2,图形展示见图3。
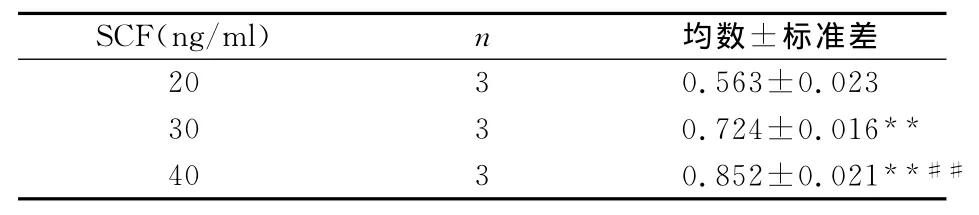
表1 SCF不同水平组OD值比较

表2 RA不同水平组OD值比较
2.3.2 两因素分析结果 SCF与RA各三水平全面组合,共9组,每组设置重复次数为3次,培养72h后,检测各培养样品的吸光度(OD)值,获得结果见表3。采用析因设计的方差分析进行统计学检验,方差齐性检验,F=1.801,P=0.143>0.05,符合方差齐性。析因设计方差分析,SCF检验对应F=80.508,P<0.01,RA检验结果F=22.355,P<0.01,SCF*RA 交互作用检验F=3.865,P=0.019<0.05,具体结果见表4。
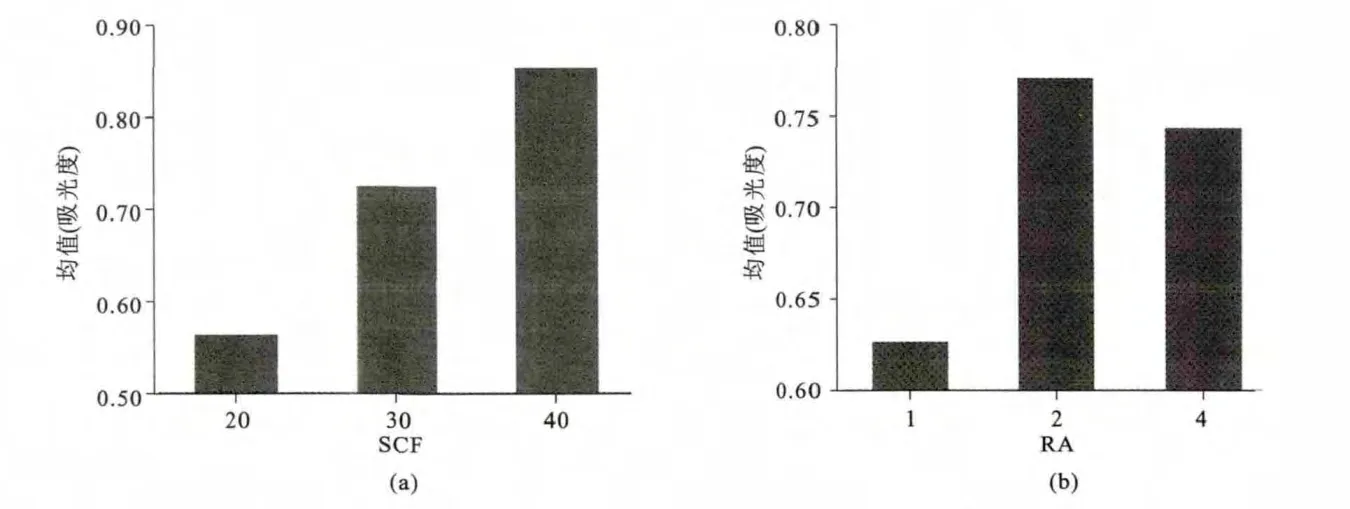
图3 SCF(a)与RA(b)主效应OD值比较
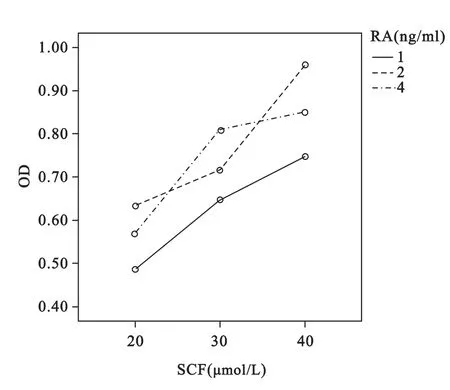
图4 SCF与RA交互作用图
表3 SCF与RA9种组合3次重复吸光度值(±s,n=3)
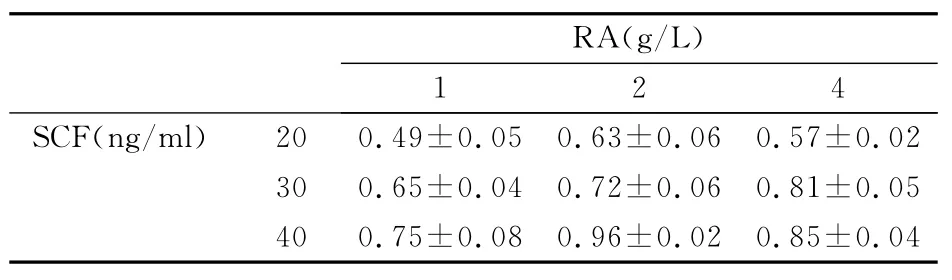
表3 SCF与RA9种组合3次重复吸光度值(±s,n=3)
RA(g/L)1 2 4 SCF(ng/ml) 20 0.49±0.05 0.63±0.06 0.57±0.02 30 0.65±0.04 0.72±0.06 0.81±0.05 40 0.75±0.08 0.96±0.02 0.85±0.04
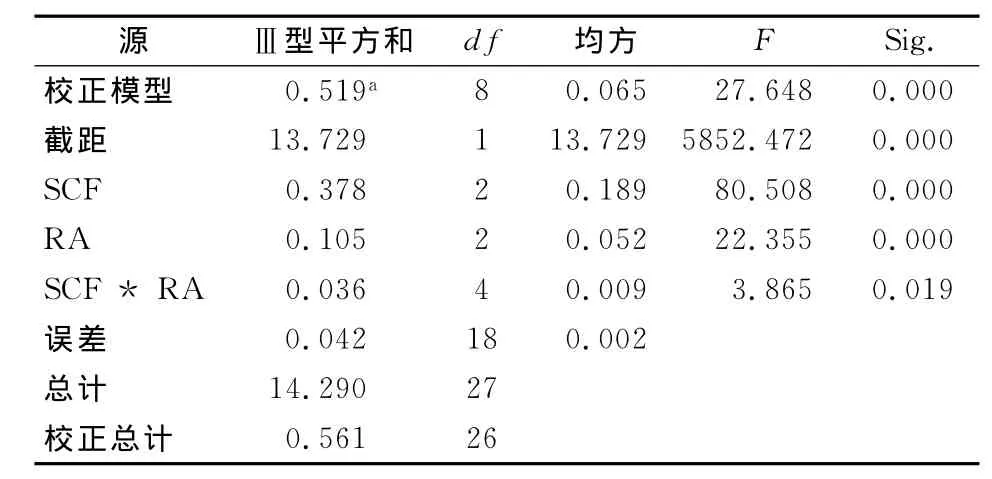
表4 SCF与RA析因设计ANOVA分析结果
3 讨论
精子发生是一个以精原干细胞(SSCs)为基础的复杂而高度有序的过程。精原干细胞具有永生化和多能化潜能,是精子形成的前体细胞,其自我更新和起始分化之间的平衡则是维持个体正常生育能力的关键。精原干细胞在睾丸等微环境中具有增殖与分化的能力,其终生扩增能力为雄性精子细胞源源不断产生所必需,对其增殖调控机制的研究成为研究男性不育途径之一。
众多文献发现在体外培养SSCs中,添加GDNF和 SCF[1]、维生素 A[2]、黄芪注射液[4]、枸杞多糖[5-6]、GDNF和 LIF[7]等,均可以促进精原干细胞的增殖。然而上述研究均在单因素研究的基础之上,没有考虑因素之间的交互作用。本研究选择SCF和VA为研究因素,两因素各设置3个水平,全面组合分成9组,采用析因设计方法分析两种因素之间是否存在交互影响。
研究结果发现当固定RA因素,SCF低、中、高三组吸光度值分别为0.563±0.023,0.724±0.016和0.852±0.021,三组之间比较,相互间差异均有统计学意义(P<0.01);当固定SCF因素,RA低、中和高三组吸光度值分别为0.626±0.026,0.770±0.019和0.743±0.023,中、高剂量组吸光度值高于低剂量组(P<0.01),中高剂量组间无差异(P>0.05)。结果再次证实SCF和RA均具有精原干细胞的体外增值作用。析因设计方差分析发现,SCF与RA之间交互作用分析,F=3.865,P=0.019<0.05,显示两种因素之间存在交互影响作用,两者浓度之间最佳组合为SCF高剂量与RA中剂量组。
SCF是一种作用广泛的多肽生长因子细胞因子,为c-kit受体的配体[8]。SCF促进小鼠SSCs分裂增殖的机制,可能是由于SCF弥补了体外环境中SCF的不足,SCF与小鼠SSCs膜上的c-k it酪氨酸激酶受体发生特异性结合,诱导该受体自动磷酸化,从而有利于其干细胞状态的维持和自增殖能力的调节。KIT配体是由支持细胞分泌的,KIT受体则存在于A型精原干细胞上,在B型及初级精母细胞为低水平表达,在精子细胞中不表达,因此C-KIT受体可作为A型精原干细胞的标志物,但该受体并不是精原干细胞特有的标志物,在其它干细胞中也有表达,故也常作为干细胞的一个常见的辅助检测指标。本研究在饲养层上增殖呈链状、团状的细胞的胞膜染色为阳性,胞质和胞核为阴性,这不仅提示C-KIT受体可作为检测精原干细胞的一个重要指标,同时也提示该受体在精原干细胞上是一种膜受体,该受体在体外培养过程中可能与外源性的配体SCF结合发挥调节作用[9]。维生素A参与胚胎的正常发育,并维持机体多种生理活动。目前关于维生素A对人类雄性生殖系统影响的研究尚比较匾乏,通过对啮齿动物维生素A缺乏或过多症的研究,表明维生素A对雄性生殖系统的发育和正常维持是必需的[10]。
精原干细胞体外增值影响因素较多,其机制也异常复杂,研究因素往往不是单一作用于受试对象,各因素之间或多或少都会相互影响,传统的单一因素设计的实验只能解决单一因素的作用,当其他因素发生变化时,其作用大小甚至方向均可能发生变化。本次研究采用3×3析因设计,研究了SCF与RA之间的交互作用,比以往的单一因素研究在实验设计上更加科学,然而因为影响SSCs增殖的影响因素很多,要充分研究它们之间的影响,寻求最佳的干预因素的组合,有待采进一步采用更为复杂的多因素实验设计如正交设计与均匀设计进行研究。
[1] 毕聪明,王珅,周铁忠,等.GDNF和SCF促进小鼠精原干细胞增殖与分化的研究[J].辽宁医学院学报,2009,03:193-195,289.
[2] 胡建新,孙兆林,何坚,等.维生素A对体外培养小鼠精原干细胞生长增殖的影响[J].中国组织工程研究与临床康复,2010,10:1791-1794.
[3] 宋锐,曹鸿国,陶勇,等.一种简便的小鼠精原干细胞分离培养方法[J].中国细胞生物学学报,2010,02:285-290.
[4] 余荣娇,洪燕,刘茜,等.黄芪注射液对大鼠精原干细胞增殖作用的影响[J].江西中医学院学报,2010,02:67-69.
[5] 刘慧莲.枸杞多糖对小鼠精原干细胞增殖作用的影响[J].安徽农业科学,2012,03:1490-1492.
[6] 马良宏,邱志军,闫圣男,等.枸杞多糖对精原干细胞体外增殖的影响[J].中国组织工程研究与临床康复,2011,23:4277-4281.
[7] 索丽娟,胡建宏,王鹏,等.GDNF和LIF对小鼠精原干细胞体外增殖的影响[J].西北农林科技大学学报(自然科学版),2012,04:1-7.
[8] Copeland NC,Gibert DJ,Cho BC,et al.Mast cell growth factor maps near the steel locus on mouse chromosome 10and is deleted in a number of steel alleles[J].Cell,1990;63:175-183.
[9] 徐富翠,吴绍华,郭勇,等.小鼠精原干细胞生物学特征的研究[J].泸州医学院学报,2006,03:191-195.
[10] Uvera G,Rouiler-Fabre V,Pairalllt C,et al.Regulation and perturbation of testicular functions by vitamin A[J].Reporduction,2002,124:173-180.
