血管周围干细胞在大鼠脂肪组织中的含量及其体外扩增后比例的变化
2015-11-25徐峰刘舒云彭江卢世璧孙逊尹合勇孙振余晓明肖波张金鑫袁玫许文静郭全义
徐峰,刘舒云,彭江,卢世璧,孙逊,尹合勇,孙振,余晓明,肖波,张金鑫,袁玫,许文静,郭全义
·论著·
血管周围干细胞在大鼠脂肪组织中的含量及其体外扩增后比例的变化
徐峰,刘舒云,彭江,卢世璧,孙逊,尹合勇,孙振,余晓明,肖波,张金鑫,袁玫,许文静,郭全义
目的 探索大鼠脂肪组织中血管周围干细胞(PSCs)在脂肪组织细胞中所占的比例,以及体外培养扩增后的大鼠脂肪间充质干细胞(ADSCs)中 PSCs比例的变化,为组织工程自体细胞移植修复骨和软骨损伤的实验研究提供可能的新型种子细胞。
方法 取大鼠的脂肪组织用 II型胶原酶消化得到血管基质成分(SVF)并且体外培养扩增大鼠ADSCs至 P3代,用细胞计数仪及流式细胞仪检测 SVF细胞密度、活细胞比例、PSCs含量,检测 ADSCs中PSCs的含量并与CD45–SVF细胞中 PSCs含量进行比较。
结果 经细胞计数仪分析,每只大鼠约 3 ml脂肪组织消化所得 SVF中活细胞比例为(69.31±6.57)%,可收获活细胞(40.69±6.81)×106个。经流式细胞仪检测,每只 SD大鼠 3 ml脂肪组织中平均可以得到 PSCs活细胞为(1.60± 0.59)×106个,血管外周细胞为(0.18±0.04)×106个,血管外膜细胞为(1.42±0.57)×106个。而体外平面培养扩增的 P3代ADSCs中,PSCs及各细胞亚群的比例并没有随着细胞的扩增而改变(P>0.05)。
结论 大鼠脂肪组织中含有 PSCs,可以直接通过流式分选获取大量 PSCs,不进行体外扩增即可望满足骨和软骨组织工程种子细胞的需要。
血管周围干细胞; 脂肪间充质干细胞; 流式细胞术
目前,血管周围干细胞(perivascular stem cells,PSCs)成为种子细胞新的研究热点[1],其在骨组织工程研究中对骨缺损的良好修复能力已经得到了证实[2-3],血管外周细胞(pericytes)体外研究证实亦有较强成软骨能力[4],可以大量分泌血管内皮生长因子(VEGF)、血小板源性生长因子(PDGF-BB)等生长因子[5],是一种崭新的、具有潜力的组织工程种子细胞。血管周围干细胞位于大、中、小以及毛细血管周围,被认为是一种未分化的纯净的间充质干细胞[3]。PSCs包括两个干细胞亚群[2-3],分别为位于毛细血管等最小血管周围的血管外周细胞和存在于较大血管周围的血管外膜细胞(adventitial cells)。血管外周细胞的细胞表面标记为 CD146+、CD45–、CD34–;血管外膜细胞的表面标记为 CD146–、CD45–、CD34+。Crisan等[1]发现在人的肌肉、脂肪、骨髓、肾脏、胰腺、肝脏、胎盘、心脏、皮肤、肺、脑、肠、眼睛、脐带组织中均有血管外周细胞的存在,而其他物种体内是否存在血管周围干细胞PSCs却少见报道。而大鼠作为骨和软骨组织工程研究中常用的实验动物,其体内是否存在血管周围干细胞 PSCs尚未见报道。所以本研究旨在探索大鼠脂肪组织中是否存在血管周围干细胞 PSCs和其在脂肪组织细胞中所占的比例,以及探索在平面培养扩增的大鼠脂肪来源的间充质干细胞 ADSCs中血管周围干细胞 PSCs所占的比例的变化情况,为组织工程自体细胞移植修复骨和软骨损伤的实验研究提供理论支持。
1 材料与方法
1.1 材料
1.1.1 试剂 I型胶原酶、II型胶原酶为美国Sigma公司产品;DMEM、PBS液、培养皿、50 ml离心管、25 cm2培养瓶、75 cm2培养瓶、胰蛋白酶均为美国 Corning公司产品;胎牛血清为北京元亨圣马生物技术公司产品;双抗购自碧云天生物技术有限公司;CD146-APC荧光标记流式抗体购自美国 R&D公司;CD34-PE-Cy7荧光标记流式抗体购自美国 Santa Cruz公司;CD45-PE荧光标记流式抗体、CD90-PE荧光标记流式抗体、血细胞裂解液购自美国 BD公司;CD29-PE荧光标记流式抗体、CD44H-PE荧光标记流式抗体购自美国eBioscience公司。
1.1.2 实验动物 SD大鼠 16只,4周龄,雄性,由解放军总医院动物中心提供;SPF级,许可证号:SCXK(京)2012-0001。
1.1.3 实验仪器 70目滤网、流式管、流式细胞仪购自美国 BD公司;磁力搅拌器购自德国 IKA公司;Cellometer Auto T4全自动细胞计数分析仪购自深圳达科为生物技术有限公司。
1.2 方法
1.2.1 分离 SD 大鼠脂肪组织血管基质成分SVF 取16只 4周龄雄性SD大鼠随机分成8批,每批 2只,脱颈处死后常规备皮,于 75% 酒精中浸泡消毒 15 min,无菌操作下取每只大鼠双侧腹股沟处脂肪置于培养皿中,每批 2只大鼠可得脂肪组织约 6 ml,将得到的脂肪组织用 PBS液反复冲洗 3遍,用眼科剪充分剪碎后转移入无菌小玻璃瓶中,加入用DMEM配制好的无菌的1 mg/ml II型胶原酶 20~30 ml,再放入磁力搅拌器转子,在 37℃ 恒温箱中,转子转速以 120 r/min于磁力搅拌器上消化 45 min。将所得液体转入 50 ml离心管中,以 1800 r/min速度离心 5 min去除上层液体,将下层的细胞沉淀加入 5 ml血细胞裂解液重新吹打悬浮,于室温中静置 10 min后以1800 r/min速度离心,弃上清,加入大量 PBS液和沉淀混匀,用 70 μl滤网过滤后得到单细胞悬液,用 PBS液洗涤 3遍后,加入 1 ml PBS液重新悬浮即得到脂肪组织血管基质成分 SVF。
1.2.2 全自动细胞计数分析仪进行细胞计数和活细胞比例分析 取每批所得血管基质成分 SVF 20 μl液体用台盼蓝染色,用全自动细胞计数分析仪按照说明书操作分别进行细胞密度、活细胞比例分析。
1.2.3 SD大鼠脂肪来源的间充质干细胞 ADSCs的平面培养和传代 取每批脂肪组织所得一半的SVF,以 1800 r/min速度离心 5 min,弃上清,将下层细胞沉淀加入适量含 10%胎牛血清、1%双抗的 DMEM重新吹打悬浮细胞后接种于 25 cm2培养瓶中。于 5%CO237℃ 恒温细胞培养箱中培养,于 24 h后进行首次半量换液,以后每 3天换一次液。当细胞融合达到 80%时传代,用 PBS液冲洗 3遍,胰蛋白酶消化细胞后用含 10% 胎牛血清的 DMEM终止消化,按 1∶3比例传代,直至传到 P3代,胰蛋白酶消化后用含 10%胎牛血清的 DMEM终止消化,以 1800 r/min速度离心5 min,弃上清,细胞计数板计数后加入适量 PBS液重新吹打悬浮,制备成 1×107个/ml单细胞悬液待用。
1.2.4 用流式细胞仪鉴定 SD大鼠脂肪来源的间充质干细胞 ADSCs取第一批 ADSCs单细胞悬液,分别吸取 100 μl液体加入 5只流式管中,一只为阴性对照,其余 4只分别加入 CD90-PE、CD29-PE、CD44H-PE和 CD45-PE荧光抗体,室温下于暗室中孵育 15 min,再加入 PBS液洗涤,于 1800 r/min离心 5 min后小心去除上清液,加入 PBS液重新吹打悬浮为单细胞悬液,用流式细胞仪检测。
1.2.5 用流式细胞仪分析鉴定血管外周细胞、血管外膜细胞以及血管周围干细胞的比例 将 8批脂肪组织所得 SVF和所得 8批 P3代 ADSCs单细胞悬液分别加入流式管中,再分别加入CD146-APC、CD34-PE-Cy7和 CD45-PE荧光抗体,于室温下在暗室中孵育 15 min,再加入 PBS液后混匀,以 1800 r/min速度离心 5 min,去除上清液,加入 PBS液吹打悬浮为单细胞悬液,用流式细胞仪检测其中血管外周细胞(CD146+、CD45–、CD34–)、血管外膜细胞(CD146–、CD45–、CD34+)和血管周围干细胞 PSCs(以上两者之和)的比例。用统计学软件计算每只大鼠所得 3 ml脂肪组织所含 PSCs活细胞数、所得 SVF中 PSCs所含比例,以及比较 CD45–SVF细胞和 P3代ADSCs中PSCs和各细胞亚群的含量差异。
1.3 统计学处理
采用统计学处理软件 SPSS13.0进行统计学处理。正态分布的连续变量以± s 描述,两组间的比较采用独立样本 t检验;非正态分布的连续变量以 M(Q1~Q3)描述,组间比较采用Mann-Whitney U非参数检验进行统计学分析。P<0.05为差异具有统计学意义。
2 结果
2.1 各组脂肪组织消化所得 SVF细胞密度和活细胞比例
用全自动细胞计数分析仪检测后进行统计分析:每只大鼠 3 ml脂肪组织所得 SVF中细胞密度平均为(118.14±20.53)×106个/ml,其中活细胞比例为(69.31±6.57)%,所以每只大鼠 3 ml脂肪组织消化后所得 SVF中的总细胞数平均为(59.07±10.26)×106个,其中活细胞数平均为(40.69±6.81)×106个。
2.2 SD大鼠 ADSCs的平面培养及鉴定
细胞培养 1 d首次换液后倒置显微镜下观察,镜下见细胞贴壁,细胞呈圆形、多角形或短梭形,大小不一,有的呈簇样分布(图 1A)。3~5 d细胞融合达 80% 之后以 1∶3传代,传代后细胞生长速度加快,2~3 d融合可达 80%。直至细胞传到P3代后纯化,细胞形态均一,趋于长梭形(图 1B),多角形和圆形细胞少见。
用流式细胞仪检测 P3代 ADSCs细胞表型(图 2):CD90阳性率达 94.02%(图 2A),CD29阳性率达 99.51%(图 2B),CD44阳性率达 94.02%(图 2C),CD45表达阴性 94.41%(图 2D),可鉴定所培养细胞表型符合ADSCs特征,确实为ADSCs。
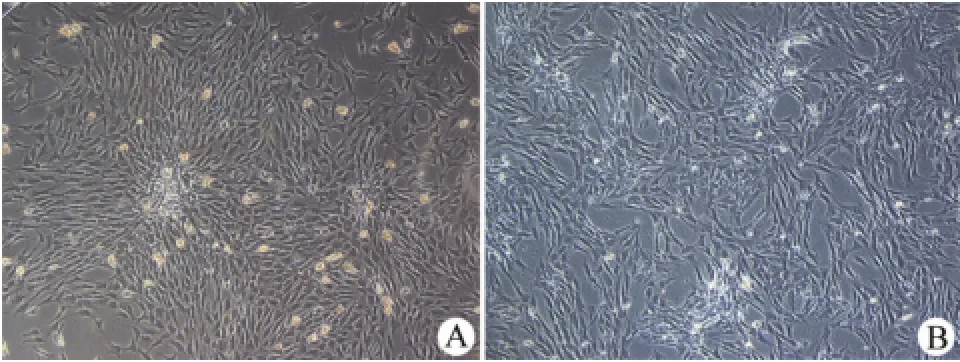
图1 ADSCs倒置显微镜下图像(×100)(A:P0代;B:P3代)Figure 1 ADSCs image observed with inverted microscope (×100)(A:P0;B:P3)
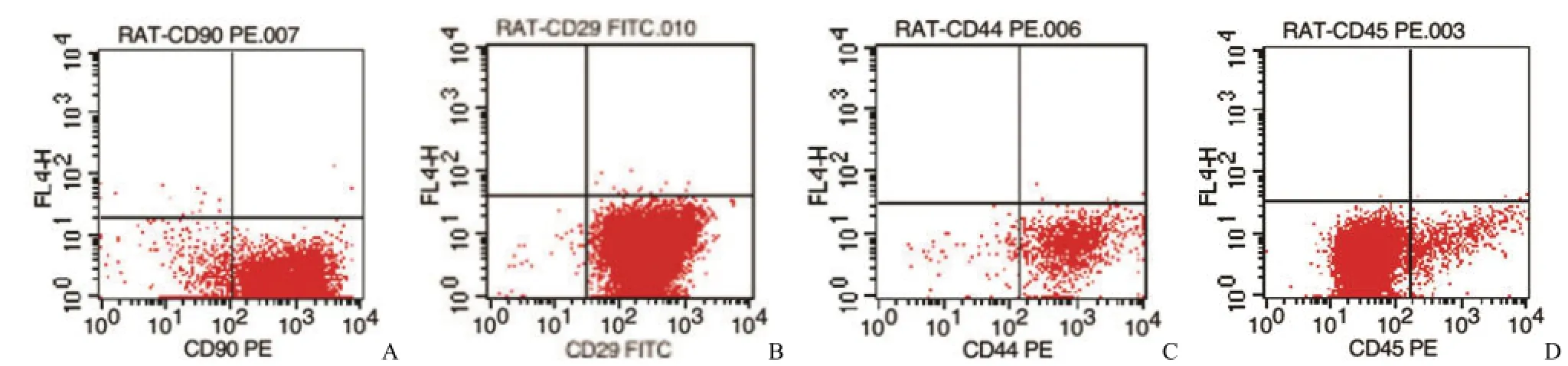
图2 P3代ADSCs流式细胞术检测(A:CD90+细胞为 94.02%;B:CD29+细胞为 99.51%;C:CD44+细胞为 94.02%;D:CD45–细胞为 94.41%)Figure 2 P3ADSCs detected by flow cytometry(A:Cells of CD90+are 94.02%;B:Cells of CD29+are 99.51%;C:Cells of CD44+are 94.02%;D:Cells of CD45–are 94.41%)
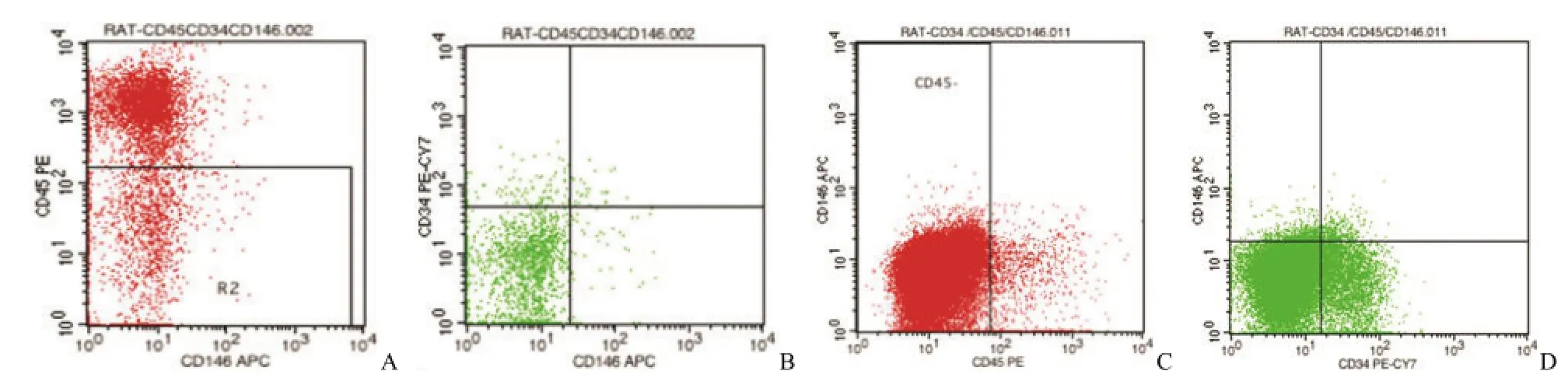
图3 流式细胞术检测 PSCs比例(A:SVF中 CD45–细胞比例为 24.56%;B:血管外周细胞占 CD45–SVF细胞的比例为 2.65%,血管外膜细胞占 CD45–SVF细胞的比例为 5.77%;C:P3代 ADSCs中 CD45–细胞的比例为 94.41%;D:血管外周细胞占 CD45–ADSCs的比例为 2.53%,血管外膜细胞占 CD45–ADSCs比例为 14.38%)Figure 3 The proportion of PSCs tested by flow cytometry(A:Proportion of CD45–cells in SVF is 24.56%;B:Proportion of pericytes in CD45–SVF cells is 2.65%,the proportion of adventitial cells in CD45–SVF cells is 5.77%;C:Proportion of CD45–cells in ADSCs is 94.41%;D:Proportion of pericytes in CD45–ADSCs cells is 2.53%,the proportion of adventitial cells in CD45–ADSCs cells is 14.38%)
2.3 血管外周细胞、血管外膜细胞以及血管周围干细胞 PSCs的比例
用流式细胞仪分别检测 8批 SVF和 P3代ADSCs中 PSCs的含量(图 3),经统计分析后可知:每只 SD大鼠 3 ml脂肪组织消化所得 SVF 中 CD45–细胞比例平均为(27.00±7.16)%,血管外周细胞所占比例平均为(0.67±0.19)%,血管外膜细胞所占比例平均为(5.37±2.51)%,血管周围干细胞 PSCs(即两者之和)所占比例平均为(6.04±2.64)%,每只 SD大鼠 3 ml脂肪组织中平均含有 PSCs活细胞为(1.60±0.59)×106个,血管外周细胞为(0.18±0.04)×106个,血管外膜细胞为(1.42±0.57)×106个。在 CD45–的 SVF细胞中血管外周细胞所占比例平均为(2.51±0.46)%,血管外膜细胞所占比例平均为(19.98±8.21)%,PSCs所占比例平均为(22.49±8.43)%。SD大鼠P3代 ADSCs中 CD45–细胞比例平均为(95.30± 1.77)%,血管外周细胞所占比例平均为(2.22± 0.44)%,血管外膜细胞所占比例平均为(14.27± 2.74)%,PSCs所占比例平均为(15.74±2.95)%。但传代培养扩增后 ADSCs中各个 PSCs亚群与直接消化后所得 CD45–SVF细胞中各个 PSCs亚群相比并没有统计学差异(P>0.05),说明在体外平面培养扩增的 P3代 ADSCs中,PSCs及各细胞亚群的比例并没有随着细胞的扩增而改变。
3 讨论
种子细胞、支架材料和生长因子是组织工程的三要素,而种子细胞的选择更是决定组织工程修复骨和软骨损伤成败的关键因素之一。目前,骨和软骨组织工程实验研究中常用的种子细胞有同种异体骨髓来源的间充质干细胞 BMSCs[6]、同种异体脂肪来源的间充质干细胞 ADSCs[7]以及软骨细胞[8]。然而,这些异体的种子细胞虽然在修复中起到了一定的效果,但目前的干细胞培养方法无法在短时间内大量分离出纯净、均一的间充质干细胞,且细胞在体外培养传代的过程中明显影响干细胞的基因变化[9],从而影响增殖分化等功能,影响组织工程修复的效果。所以寻找一种纯净的、均一的容易大量获取的自体来源的干细胞来作为组织工程修复骨和软骨损伤的种子细胞成为新的研究方向。而用流式细胞分选术直接分选脂肪组织中的间充质干细胞可以短时间内大量获得种子细胞,且无需经过长时间体外培养扩增,减少了风险,是目前获取种子细胞的理想方法和研究热点。
血管周围干细胞 PSCs已被发现在人体内广泛存在,几乎存在于人体每个器官的大、中、小和毛细血管周围,尤其在脂肪组织中含量较高,可以达到 40% 左右[3],适合经过分选大量获得。且PSCs被认为是纯净的、均一的间充质干细胞,其修复骨缺损效果已得到认可,体外成软骨能力较好[4],是理想的骨和软骨组织工程种子细胞。但其体内对软骨损伤的修复能力尚需动物实验来验证,而在以大鼠为实验动物的实验研究中,尚需从大鼠脂肪组织中分离获取 PSCs,然而大鼠脂肪中是否含有 PSCs以及其含量尚不清楚。通过本研究发现,每只 SD大鼠 3 ml脂肪组织中平均可获得PSCs(1.60±0.59)×106个,可以通过流式细胞分选短期获得足量细胞而不用经过长期体外培养扩增。因为大鼠腹股沟脂肪组织中含有大量的淋巴细胞,造成 CD45–细胞比例不高。虽然 SD大鼠的脂肪组织中 PSCs含量较人脂肪组织中 PSCs含量少,只有(6.04±2.64)%,但大鼠脂肪组织中所含脂滴少于人抽脂术所得脂肪,且细胞体积小于人脂肪细胞,故相同体积脂肪组织中大鼠细胞数多于人的细胞数。虽然大鼠脂肪组织中所含 PSCs比例较低,但是绝对数目依然较多。
综上所述,本研究表明大鼠脂肪组织中含有PSCs,虽然所含比例较人脂肪组织中少,但可以满足以大鼠为模型进行 PSCs为种子细胞的组织工程修复病损组织的研究。
[1] Crisan M,Yap S,Casteilla L,et al.A perivascular origin for mesenchymal stem cells in multiple human organs.Cell Stem Cell,2008,3(3):301-313.
[2] James AW,Zara JN,Corselli M,et al.An abundant perivascular source of stem cells for bone tissue engineering.Stem Cells Transl Med,2012,1(9):673-684.
[3] James AW,Zara JN,Zhang X,et al.Perivascular stem cells:a prospectively purified mesenchymal stem cell population for bone tissue engineering.Stem Cells Transl Med,2012,1(6):510-519.
[4] Farrington-Rock C,Crofts NJ,Doherty MJ,et al.Chondrogenic and adipogenic potential of microvascular pericytes.Circulation,2004,110(15):2226-2232.
[5] Chen CW,Montelatici E,Crisan M,et al.Perivascular multi-lineage progenitor cells in human organs:regenerative units,cytokine sources or both?Cytokine Growth Factor Rev,2009,20(5-6):429-434.
[6] Zhu W,Chen K,Lu W,et al.In vitro study of nano-HA/PLLA composite scaffold for rabbit BMSC differentiation under TGF-β1 induction.In Vitro Cell Dev BiolAnim,2014,50(3):214-220.
[7] Liu B,Cui L,Liu GP,et al.Tissue-engineering bone with ADSCs and coral scaffold for repairing of cranial bone defect in canine.Chin J Plast Surg,2009,25(3):204-208.(in Chinese)
刘波,崔磊,刘广鹏,等.自体脂肪干细胞复合珊瑚修复犬颅骨标准缺损的初步研究.中华整形外科杂志,2009,25(3):204-208.
[8] Dahlin RL,Kinard LA,Lam J,et al.Articular chondrocytes and mesenchymal stem cells seeded on biodegradable scaffolds for the repair of cartilage in a rat osteochondral defect model.Biomaterials,2014,35(26):7460-7469.
[9] Schack LM,Noack S,Weist R,et al.Analysis of surface protein expression in human bone marrow stromal cells:new aspects of culture-induced changes,inter-donor differences and intracellular expression.Stem Cells Dev,2013,22(24):3226-3235.
Methods Stromal vascular fraction(SVF)was isolated by collagenase type II digestion from the SD rat adipose tissue and ADSCs was cultured in vitro until P3.The cell density of SVF cells,the proportion of living cells and the proportion of PSCs in SVF were measured by the cell counter and flow cytometry(FCM).The proportion of PSCs in ADSCs was compared with that in CD45–SVF cells.
Results The proportion of live cells in SVF isolated from each 3 ml of rat adipose tissue was(69.31±6.57)%,reaching(40.69± 6.81)×106cells.There were(1.60±0.59)×106of PSCs,(0.18±0.04)×106of pericytes and(1.42±0.57)×106of adventitial cells obtained from each 3 ml of rat adipose tissue by the flow cytometry sorting.In the in vitro cultured P3of ADSCs,the proportions of PSCs and cell subsets were not significantly changed(P>0.05).
Conclusion This research suggests that there are enough PSCs in the adipose tissue of rat and the content of PSCs from flow cytometric sorting in the tissue may meet the needs of seed cells for bone and cartilage tissue-engineering without in vitro culture.
Proportion of perivascular stem cells(PSCs)in adipose tissue of rat and the content changes of PSCs inADSCs
XU Feng,LIU Shu-yun,PENG Jiang,LU Shi-bi,SUN Xun,YIN He-yong,SUN Zhen,YU Xiao-ming,XIAO Bo,ZHANG Jin-xin,YUAN Mei,XU Wen-jing,GUO Quan-yi
Objective To explore the proportion of PSCs in adipose tissue cells of rat and the proportion changes of PSCs in ADSCs which were cultured in vitro.This research aims to provide potential new seed cells for autologous cell transplantation to repair the injuries of bone and cartilage in tissue-engineering.
Perivascular stem cells;Adipase derived stem cells;Flow cytometry
GUO Quan-yi,Email:doctorguo@163.com
10.3969/cmba.j.issn.1673-713X.2015.02.001
国家自然科学基金(81472092);国家高技术发展研究计划(863计划)(2012AA020502)
100853北京,解放军总医院骨科研究所(徐峰、刘舒云、彭江、卢世璧、孙逊、尹合勇、孙振、余晓明、肖波、张金鑫、袁玫、许文静、郭全义);300071天津,南开大学医学院(孙逊、尹合勇);154007黑龙江,佳木斯大学研究生院(张金鑫)
郭全义,Email:doctorguo@163.com
2014-12-24
www.cmbp.net.cn 中国医药生物技术,2015,10(2):97-101
Author Affiliations:Orthopaedic Research Institute,General Hospital of People's Liberation Army,Beijing 100853,China(XU Feng,LIU Shu-yun,PENG Jiang,LU Shi-bi,SUN Xun,YIN He-yong,SUN Zhen,YU Xiao-ming,XIAO Bo,ZHANG Jin-xin,YUAN Mei,XU Wen-jing,GUO Quan-yi);School of Medicine,Nankai University,Tianjin 300071,China(SUN Xun,YIN He-yong);Graduate School,Jiamusi University,Heilongjiang 154003,China(ZHANG Jin-xin)
www.cmbp.net.cn Chin Med Biotechnol,2015,10(2):97-101
