紫苏叶多糖纯化工艺的研究
2015-10-24沈萃谢三都徐芳高宁林晓燕
沈萃,谢三都,徐芳,高宁,林晓燕
(福建师范大学闽南科技学院,福建泉州362332)
紫苏叶多糖纯化工艺的研究
沈萃,谢三都*,徐芳,高宁,林晓燕
(福建师范大学闽南科技学院,福建泉州362332)
研究了Seveage法对紫苏叶多糖的脱蛋白工艺。结果表明,氯仿与正丁醇的体积比为4∶1,样液与Seveage试剂的体积比为1∶1,时间为30 min,次数为4次,紫苏叶多糖的脱蛋白率为72.1%,多糖损失率为17.3%。紫苏叶多糖提取液经活性炭脱色、Seveage脱蛋白后通过DEAE-纤维素柱层析,采用蒸馏水、0.2、0.4、0.6、0.8、1.0 mol/L NaCl洗脱液进行洗脱,分离得到紫苏叶多糖Ⅰ(PLPⅠ)3.18μg/mL、紫苏叶多糖Ⅱ(PLPⅡ)4.64 μg/mL、紫苏叶多糖Ⅲ(PLPⅢ)12.22 μg/mL、紫苏叶多糖Ⅳ(PLPⅣ)26.36 μg/mL、紫苏叶多糖Ⅴ(PLPⅤ)32.63 μg/mL、紫苏叶多糖Ⅵ(PLPⅥ)62.52 μg/mL六个紫苏叶多糖组分。
紫苏叶;多糖;脱蛋白;DEAE-纤维素;柱层析
紫苏[Perilla frutescens(L.)Britt.],又名白苏、赤苏、红苏、野苏等,属双子叶植物纲、唇形科、紫苏属的一年生草本植物,被划入中国卫生部首次颁布的药食两用的60种中药之一[1-3]。现代药理学研究结果表明,紫苏已经分离鉴定出百余种化学成分[4],归结为挥发油类[5]、脂肪酸类[6]、黄酮类[7]、酚酸类[8]、甾醇类[7]、维生素类[9]、苷类[10]、色素类[11]和萜类化合物[12]等,具有解热镇静[13]、抗炎[14]、抗过敏[15]、止血[16]、降血糖[16]、降血脂[17]、抑菌[18]、止呕[17]、抗微生物[19]、抗氧化[20]、促进记忆[21]等多方面的生物活性。张卫明等[3]的研究结果表明,紫苏成熟叶片中含有17.68%的粗蛋白,幼叶中的粗蛋白含量高达28.14%。
本文以紫苏叶多糖脱色液为原料,以紫苏叶多糖脱蛋白率和多糖损失率为指标,在单因素的基础上,采用正交试验优化Seveage法对紫苏叶多糖脱蛋白的最佳工艺条件;在此基础上,为进一步提高紫苏叶多糖的纯度,采用DEAE-纤维素层析柱对紫苏叶多糖进行柱层析分离,获得较高纯度的紫苏叶多糖。本研究结果可为紫苏叶多糖的进一步研究提供技术参考。
1材料与方法
1.1材料与试剂
紫苏,采摘自泉州南安市野生紫苏。
正丁醇、氯仿、牛血清蛋白标准品、考马斯亮蓝G-250、无水乙醇、葡萄糖标准品、柠檬酸缓冲液、苯酚、浓硫酸、氯化钠等均为分析纯;DEAE-Cellulose:上海恒信化学试剂有限公司。
1.2主要仪器
UV-2802S紫外可见分光光度计:龙尼柯上海仪器有限公司;HH-8型数显恒温水浴锅:江苏省金坛市荣华仪器制造有限公司;TDL-40B型台式离心机:上海安亭科学仪器厂;PHS-3C型pH计:上海精密科学仪器有限公司;EG823LC-NA型微波炉:佛山市顺德区美的微波电器制造有限公司;SBS-160自动收集器、HL-2S恒流泵:上海沪西分析仪器厂有限公司;1.6× 50 cm中压特制玻璃层析柱:福州鑫裕华实验仪器有限公司。
1.3方法
1.3.1紫苏叶多糖的提取工艺流程
紫苏叶→清洗、沥干→干燥→粉碎、过筛→提取→紫苏叶多糖溶液
1.3.2紫苏叶多糖损失率的测定
以葡萄糖标准样为基准,采用苯酚-硫酸法[22]测定紫苏叶多糖含量。所得标准曲线为Y=0.002 2X+0.023,Y表示吸光度OD490nm值;X表示葡萄糖溶液浓度,(μg/mL),R2=0.999 3,表明在0 μg/mL~40 μg/mL范围内葡萄糖溶液浓度与吸光度呈良好的线性关系。
参照葡萄糖标准曲线绘制的测定方法测定紫苏叶多糖提取液脱蛋白前后多糖含量,并按下列公式计算紫苏多糖损失率:
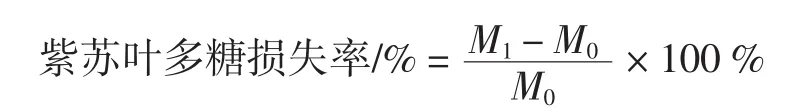
式中:M0表示脱蛋白前紫苏叶多糖质量,g;M1表示脱蛋白后紫苏叶多糖质量,g。
1.3.3紫苏叶多糖脱蛋白率的测定
1.3.3.1蛋白质含量的测定
以牛血清蛋白作为标准品,参照张永彬[23]等的方法,采用考马斯亮蓝法测定蛋白质的含量,所得标准曲线方程为:Y=568.2X-0.000 5,R2=0.999 2,表明在0~100 μg范围内牛血清白蛋白质量与吸光度OD值呈良好的线性关系。式中:X表示牛血清蛋白质量,μg;Y表示吸光度值。
1.3.3.2紫苏叶多糖脱蛋白率的测定
将经微波辅助提取获得的紫苏叶多糖提取液经活性炭脱色后,采用Seveage试剂进行脱蛋白,参照1.3.3.3中蛋白质含量测定方法并根据以下公式计算紫苏叶多糖脱蛋白率:
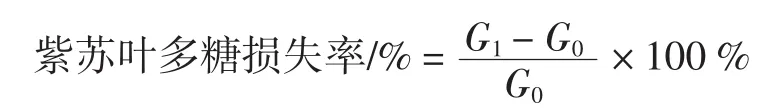
式中:G0表示脱蛋白前紫苏叶多糖的蛋白质质量,μg;G1表示脱蛋白后紫苏叶多糖的蛋白质质量,μg。
1.3.4紫苏叶多糖脱蛋白工艺的单因素实验
以紫苏叶多糖脱蛋白率和紫苏叶多糖损失率为测定指标,进行Seveage试剂对紫苏叶多糖脱蛋白的单因素实验。
1.3.4.1氯仿∶正丁醇实验
分别添加氯仿∶正丁醇(体积比)为1∶1、2∶1、3∶1、4∶1、5∶1的Seveage试剂各100 mL于200 mL紫苏叶多糖脱色液,在温度为30℃条件下恒温振荡30 min后,3 000 r/min离心5 min,取上清液;沉淀物重复脱蛋白1次,合并上清液,测定紫苏叶多糖脱蛋白率和多糖损失率。
1.3.4.2样液∶Seveage试剂实验
紫苏叶多糖脱色液与Seveage试剂(氯仿∶正丁醇=3∶1)的比例分别为1∶1、2∶1、3∶1、4∶1,在温度为30℃条件下恒温振荡30min后,3000r/min离心5min,取上清液;沉淀物重复脱蛋白1次,合并上清液,测定紫苏叶多糖脱蛋白率和多糖损失率。
1.3.4.3脱蛋白时间
紫苏叶多糖脱色液与Seveage试剂(氯仿∶正丁醇=3∶1)的比例为2∶1,在温度为30℃条件下分别恒温振荡30、40、50、60、70、80 min后,3 000 r/min离心5 min,取上清液;沉淀物重复脱蛋白1次,合并上清液,测定紫苏叶多糖脱蛋白率和多糖损失率。
1.3.4.4脱蛋白次数
紫苏叶多糖脱色液与Seveage试剂(氯仿∶正丁醇=3∶1)的比例为2∶1,在温度为30℃条件下分别恒温振荡30 min后,3 000 r/min离心5 min,取上清液,测定紫苏叶多糖脱蛋白率和多糖损失率;沉淀物重复脱蛋白1、2、3、4次,合并上清液,测定紫苏叶多糖脱蛋白率和多糖损失率。
1.3.5正交试验优化紫苏叶多糖脱蛋白工艺
在单因素试验的基础上,以紫苏叶多糖脱蛋白率和紫苏叶多糖损失率作为指标,选取L9(34)正交表对A氯仿∶正丁醇(mL∶mL)、B样液:Seveage试剂(mL∶mL)、C时间(min)和D次数进行优化试验,确定紫苏叶多糖脱蛋白的最优工艺条件。正交因素水平编码设计见表1。

表1 试验因素和水平表Table 1Factors and levels of the experiment
1.3.6紫苏叶多糖的纯化
将紫苏叶多糖提取液经活性炭脱色、Seveage脱蛋白后通过阴离子交换柱DEAE-cellulose(1.6×50 cm),依次采用蒸馏水和0.2、0.4、0.6、0.8、1.0 mol/L的NaCl溶液梯度各300 mL作为洗脱液对样品进行洗脱,洗脱速度1.0 mL/min,每管12 mL,分步收集,采用苯酚-硫酸法[22]每隔5管检测多糖含量,有零管时检测该管前后两管的多糖含量。
1.3.7数据处理
采用DPS2.0数据处理软件对正交试验结果进行极差分析和方差分析。
2结果与分析
2.1不同氯仿与正丁醇比例对紫苏叶多糖脱蛋白效果的影响
不同氯仿与正丁醇比例对紫苏叶多糖脱蛋白效果的影响见图1。

图1 不同比例的氯仿与正丁醇对紫苏叶多糖脱蛋白效果的影响Fig.1Effect of the different chloroform and 1-butanol ratio on deproteinization of perilla leaf polysaccharide
如图1所示,紫苏叶多糖的脱蛋白率随氯仿与正丁醇比例的增加,先增大后减小。当氯仿与正丁醇比例为3∶1时,脱蛋白率达到最大值为55.8%;继续加大二者比例,脱蛋白率反而下降。这是因为Sevage法是氯仿与正丁醇协同作用而达到脱蛋白的目的,其中,正丁醇起促进蛋白变性的作用;氯仿使变性后的蛋白在氯仿相和水相间形成一层胶状物通过震摇、离心从而脱除[24]。因此,氯仿比例增加时,紫苏叶多糖的脱蛋白率随之增加,但氯仿量增加的同时正丁醇的量在减少导致这种协同作用效果减弱而引起脱蛋白率下降[24]。紫苏叶多糖损失率随氯仿与正丁醇比例的增加,先下降后上升。当氯仿与正丁醇比例为4∶1时,多糖损失率达到最小值为12.9%。综合脱蛋白率和多糖损失率,氯仿与正丁醇比例宜选择3∶1。
2.2样液与Sevage试剂不同比例对紫苏叶多糖脱蛋白效果的影响
紫苏样液与Sevage试剂不同比例对紫苏叶多糖脱蛋白效果的影响见图2。

图2 不同比例的样液与Seveage试剂对紫苏叶多糖脱蛋白效果的影响Fig.2Effect of the different sample solution and Seveage ratio on deproteinization of perilla leaf polysaccharide
如图2所示,当样液与Seveage试剂的比例为2∶1时,紫苏叶多糖的脱蛋白率最高为57.2%,多糖损失率最低为17.3%,低于其它组。因此,样液与Seveage试剂的比例为2∶1时脱蛋白效果较佳。
2.3脱蛋白时间对紫苏叶多糖脱蛋白效果的影响
脱蛋白时间对紫苏叶多糖脱蛋白效果的影响见图3。

图3 脱蛋白时间对紫苏叶多糖脱蛋白效果的影响Fig.3Effect of the removal time on deproteinization of perilla leaf polysaccharide
如图3所示,随着脱蛋白时间的延长,紫苏叶多糖的脱蛋白率逐渐增加,多糖损失率呈先下降后增加的趋势。当脱蛋白时间为30 min时,脱蛋白效果较好,此时蛋白脱除率达到55.1%,而多糖损失率仅为11.03%。
2.4脱蛋白次数对紫苏叶多糖脱蛋白效果的影响
脱蛋白次数对紫苏叶多糖脱蛋白效果的影响见图4。
如图4所示,紫苏叶多糖的脱蛋白率随着脱蛋白次数的增加而增加,当脱蛋白次数达到3次时,脱蛋白率达到62.9%;继续增加次数,因为Seveage试剂主要脱除溶液中的游离蛋白,当脱蛋白次数达到3时,溶液中的游离蛋白已基本脱除,使得脱蛋白率未有明显上升。而脱蛋白次数为2次时,多糖损失率最低为3.7%。综合脱蛋白效果,脱蛋白次数应选择3次为宜。

图4 脱蛋白次数对紫苏叶多糖脱蛋白效果的影响Fig.4Effect of the removal protein cycle numbers re-moving on of perilla leaf polysaccharide
2.5紫苏叶多糖脱蛋白工艺的确定
紫苏叶多糖脱蛋白正交试验结果与分析如表2所示。

表2 正交试验结果与分析Table 2The results and analysis of orthogonal experiment
根据表2正交试验结果,对于Seveage试剂对紫苏叶多糖的脱蛋白而言,脱蛋白率越高越好而多糖损失率越低越好。通过对k值的比较可知,选择A3、B1、C3、D1为Seveage试剂对紫苏叶多糖脱蛋白率的最优工艺条件,经测定紫苏叶多糖脱蛋白率为73.6%;选择A1、B2、C2、D3为Seveage试剂对紫苏叶多糖损失最小的工艺条件,经测定紫苏多糖损失率为9.6%。
从直观分析发现,单独分析紫苏叶多糖的脱蛋白率和多糖损失率的最优工艺条件并不一致。因此,必须根据因素的影响主次,综合考虑,才能确定最佳工艺条件。Seveage试剂对紫苏叶多糖的脱蛋白率而言,比较各列的极差结果R值,可以发现RA>RB>RC>RD,即在试验所设定的因素中,氯仿:正丁醇对紫苏叶多糖脱蛋白率的影响最大,其次是样液:Seveage试剂和时间,最后是次数。Seveage试剂脱蛋白对紫苏叶多糖造成的损失而言,比较各列的极差结果R值,可以发现RC>RB>RD>RA,即在试验所设定的因素中,时间对紫苏叶多糖损失率的影响最大,其次是样液∶Seveage试剂和次数,最后是氯仿∶正丁醇。对于因素A,即氯仿∶正丁醇,其对脱蛋白率的影响排第一位而对多糖损失影响排最后一位,故取A3;对于因素B,即样液:Seveage试剂,其对脱蛋白率和多糖损失率均排在第二位,此时应取B1或者B2,当取B1时,取A1、B1、C2、D3条件下测定紫苏叶多糖损失率为25.8%,增加了16.2%;当取B2时,取A3、B2、C3、D1条件下测定紫苏叶多糖脱蛋白率为47.3%,减少了26.3%。因此,因素B应该取B1。对于因素C,即时间,其对脱蛋白率的影响排最后一位而对多糖损失率影响排第一位,故取C2。对于因素D,即次数,其对脱蛋白率的影响排在最后一位,而对多糖损失率的影响排第三位,故取D3。
综上述,紫苏叶多糖脱蛋白的最佳工艺条件应为氯仿与正丁醇比例为4∶1、样液与Seveage试剂比例为1∶1、脱蛋白时间为30 min、脱蛋白次数为4次,在此条件下紫苏叶多糖脱蛋白率为72.1%,多糖损失率为17.3%。
为判断上述4个因素对紫苏叶多糖脱蛋白率试验结果的影响程度,根据极差分析结果可知脱蛋白次数对紫苏叶多糖脱蛋白率的影响最小,故将该因素D当作空白项,应用DPS2.0数据处理系统对正交试验结果进行方差分析,利用F值和P值来检验各因素对试验指标的影响程度,分析结果见表3。
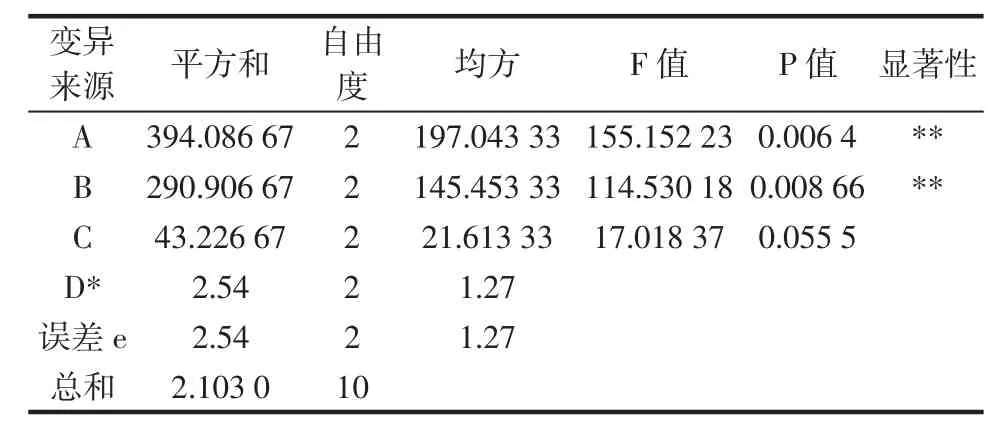
表3 方差分析表Table 3Table of analysis of variance
由表3可以看出,根据F值和P值的大小,因素A、B的影响极显著,因素C的影响不显著,因素D作为空白项。
为判断上述4个因素对紫苏叶多糖损失率试验结果的影响程度,根据极差分析结果可知氯仿与正丁醇的比例对紫苏叶多糖损失率的影响最小,故将该因素A当作空白项,应用DPS2.0数据处理系统对正交试验结果进行方差分析,利用F值和P值来检验各因素对试验指标的影响程度,分析结果见表4。

表4 方差分析表Table 4Table of analysis of variance
由表4可以看出,根据F值和P值的大小,因素C的影响显著,因素B、D的影响不显著,因素A作为空白项。
2.6紫苏叶多糖的DEAE-纤维素柱层析分离
紫苏叶多糖经DEAE-纤维素柱层析分离后,所得结果见图5。

图5 紫苏叶多糖提取液经DEAE-纤维素柱层析的洗脱Fig.5Elution profile of the extraction solution of perilla leaf polysaccharide on DEAE-Cellulose column
如图5所示,紫苏叶多糖提取液经活性炭脱色和Seveage试剂脱蛋白后通过DEAE-纤维素柱层析,分别以蒸馏水、0.2、0.4、0.6、0.7、1.0 mol/L NaCl溶液梯度洗脱,分离得到6个峰,收集各峰对应的洗脱液,分别得到六个紫苏叶多糖样品:紫苏叶多糖Ⅰ(PLPⅠ)、紫苏叶多糖Ⅱ(PLPⅡ)、紫苏叶多糖Ⅲ(PLPⅢ)、紫苏叶多糖Ⅳ(PLPⅣ)、紫苏叶多糖Ⅴ(PLPⅤ)、紫苏叶多糖Ⅵ(PLPⅥ)。采用苯酚-硫酸法测定洗脱液中紫苏叶多糖含量(体积均为1 mL),结果如表5所示。
由表5可知,紫苏叶多糖提取液经DEAE-Cellulose柱层析分离出来的多糖质量总和与原液中多糖质量相近,说明经不同浓度洗脱液洗脱后,样液中的多糖已基本流出层析柱;紫苏叶多糖提取液经不同洗脱液浓度洗脱后分离得到的六个组分中多糖含量分别为PLPⅠ为3.18 μg/mL、PLPⅡ为4.64 μg/mL、PLPⅢ为12.22μg/mL、PLPⅣ为26.36μg/mL、PLPⅤ为32.63μg/mL、PLPⅥ为62.52 μg/mL。

表5 洗脱液中紫苏叶多糖的质量Table 5The content of perilla leaf polysaccharide in eluant
3结论
Seveage法去除紫苏叶多糖中的蛋白质的最佳工艺条件为氯仿与正丁醇的体积比为4∶1,样液与Seveage试剂的体积比为1∶1,时间为30min,次数为4次,紫苏叶多糖的脱蛋白率为72.1%,多糖损失率为17.3%。
紫苏叶多糖提取液经活性炭脱色、Seveage脱蛋白后通过DEAE-Cellulose柱层析,再用蒸馏水、0.2、0.4、0.6、0.8、1.0 mol/L NaCl洗脱液进行洗脱,分离得到紫苏叶多糖Ⅰ(PLPⅠ)、紫苏叶多糖Ⅱ(PLPⅡ)、紫苏叶多糖Ⅲ(PLPⅢ)、紫苏叶多糖Ⅳ(PLPⅣ)、紫苏叶多糖Ⅴ(PLPⅤ)、紫苏叶多糖Ⅵ(PLPⅥ)六个紫苏叶多糖组分,其多糖含量分别为PLPⅠ为3.18μg/mL、PLPⅡ为4.64μg/mL、PLPⅢ为12.22μg/mL、PLPⅣ为26.36μg/mL、PLPⅤ为32.63 μg/mL、PLPⅥ为62.52 μg/mL。紫苏叶多糖经柱层析分离所得六个组分仍需进一步纯化,其结构特征、分子量、理化特性等有待进一步的测定。
[1]陆洁静,任文彬.紫苏的研究概况[J].农产品加工·学刊,2009(6):32-34
[2]李海丽,史晓蓉.紫苏的应用现状及发展前景[J].农业科技与装备,2011(7):66-67,71
[3]张卫明,石雪萍.紫苏全草营养成分测定[J].食品研究与开发,2009,30(2):132-135
[4]邹盛勤,刘坤,陈武.紫苏不同部位中乌索酸和齐墩果酸的含量比较[J].食品工业科技,2008,29(04):284-286
[5]薛山.紫苏精油的研究新趋势[J].中国食品添加剂,2011(1):199-204
[6]李鹏,朱建飞,唐春红.紫苏的研究动态[J].重庆工商大学学报(自然科学版),2010,27(3):271-275
[7]王玉萍,杨峻山.紫苏类中药化学和药理的研究概况[J].中国药学杂志,2003,38(4):250-253
[8]Youyuan Peng,Jiannong Ye,Jilie Kong.Determination of phenolic compounds in perilla frutescens L.by capillary electrophoresis with electrochemical detection[J].J Agric Food Chem,2005(53):8141-8147
[9]刘月秀,张卫明.紫苏属植物的研究与利用[J].中国野生植物资源,1996(3):24-27
[10]马尧,庄云.紫苏不同部位总黄酮含量测定[J].安徽农业科学,2010,38(33):18775-18776
[11]张鑫,张志军,李会珍,等.紫苏叶花青素的提取及测定[J].食品研究与开发,2009,30(9):187-190
[12]郭群群,杜桂彩,李荣贵.紫苏叶挥发油抗菌活性研究[J].食品工业科技,2003,24(9):25-27
[13]张旭,吴卫,郑有良,等.紫苏属植物中不同部位无机元素及维生素分析[J].时珍国医国药,2008,19(6):1383-1385
[14]SanbongiC,TakanoH,OsakabeN,etal.Rosmarinicacidinperillaextract inhibits allergic inflammation induced by mite allergen,in a mousemodel[J].Clinical&experimentalallergy,2004,34(6):971-977
[15]王钦富,王永奇,于超,等.炒紫苏子醇提取物对过敏模型小鼠的抗过敏作用及机制[J].中草药,2006,37(10):1532-1535
[16]刘娟,雷焱霖,唐友红,等.紫苏的化学成分与生物活性研究进展[J].时珍国医国药,2010,21(7):1768-1769
[17]朱建明,魏艳.紫苏油的研究现状及应用前景[J].中国中医药信息杂志,2001,8(10):33-34
[18]黄丹,刘达玉.紫苏提取物抑菌特性研究[J].食品工业,2007,28(3):11-13
[19]Kawahata T,Otake T,Mori H,et al.A novel substance purified from Perilla frutescens Britton inhibits an early stage of HIV-1 replication without blocking viral adsorption[J].Antivir Chem.Chemother. 2002,13(5):283-288
[20]Qiao S,Li W,Tsubouchi R,et al.Rosmarinic acid inhibits the formation of reactive oxygen and nitrogen species in RAW264.7 macrophages[J].Free radical research,2005,39(9):995-1003
[21]天瑶,金安娜,陈轶玉,等.紫苏油对衰老小鼠脑组织GSH含量的影响[J].中国油脂,2004,29(2):68-70
[22]丁保金,金丽琴,吕建新.多糖的生物活性研究进展[J].中国药学杂志,2004,39(8):561-564
[23]张永彬,范玉华,毕彩丰.考马斯法测定棉籽蛋白发酵液中蛋白质含量[J].河南化工,2011,28(9/10):46-49
[24]赵梅,丁霄霖.甘薯糖蛋白脱游离蛋白的研究[J].食品与生物技术学报,2006,25(1):89-91
Study on Purification Process of Perilla Leaf Polysaccharide
SHEN Cui,XIE San-du*,XU Fang,GAO Ning,LIN Xiao-yan
(Minnan Science and Technology Institute,Fujian Normal University,Quanzhou 362332,Fujian,China)
The conditions of deproteinization from perilla leaf polysaccharide were studied by using Seveage method.The result showed that the best operation condition was that,chloroform and1-butanol ratio of 4,sample liquid and Sevage liquid ratio of 1,protein removal time of 30 minutes and protein removal cycle numbers of 4,which the deproteinization rate was 72.1%and the loss ratio of polysaccharide was 17.3%.After decolor by activated charcoal and deproteinizate by Seveage,the extracting solution of perilla leaf polysaccharide could be separated by DEAE-cellulose column chromatography,and gradiantly eluted with distilled water,0.2,0.4,0.6,0.8,1.0 mol/L NaCl eluant to all can get six components named PLPⅠ3.18 μg/mL,PLPⅡ4.64 μg/mL,PLPⅢ12.22 μg/mL,PLPⅣ26.36 μg/mL,PLPⅤ32.63 μg/mL,PLPⅥ62.52 μg/mL.
perilla leaf;polysaccharide;deproteinization;DEAE-Cellulose;column chromatography
10.3969/j.issn.1005-6521.2015.11.026
2013-12-11
国家级大学生创新性实验计划项目(201212992006)
沈萃(1990—),女(汉),学士,研究方向:食品科学。
谢三都(1984—),男(汉),讲师,硕士。
