伪狂犬病毒截短VP5蛋白原核表达与鉴定
2015-03-18山东畜牧兽医职业学院山东潍坊261061
门 鹏 (山东畜牧兽医职业学院 山东 潍坊 261061)
伪狂犬病病毒(Pseudorabies virus, PRV)是一种α-疱疹病毒,可引起牛、羊、猫、马等家畜和多种野生动物产生以发热、奇痒及脑脊髓炎为特征的急性致死性传染病。猪是PRV的自然宿主和贮存宿主,感染后可引起母猪发生流产、产木乃伊胎儿和死胎,对新生的仔猪常引起神经症状或腹泻,并大批死亡,病死率甚至高达100%[1,2]。因此,伪狂犬病是养猪业的一种重要繁殖障碍性传染病给养猪业造成极大的经济损失[3,4]。动物感染该病毒后可以终生带毒,呈现潜伏感染的特征,但在应激因子的刺激下潜伏感染的病毒基因组被激活,重新产生感染性病毒粒子,导致动物发病,并传播给其它动物。疫苗免疫只能阻止猪发病和出现临床症状,但不能控制PRV的潜伏感染与重新激活。
PRV具有典型的疱疹病毒的病毒粒子结构,病毒粒子直径约为110~150nm,位于胞浆内带囊膜的成熟病毒粒子的直径约150~180nm[5]。成熟的病毒粒子分四层,最外层是由宿主细胞衍生而来的脂质双层囊膜,囊膜上镶嵌着病毒编码的蛋白,多为糖蛋白,是动物机体免疫系统识别的主要靶抗原;病毒囊膜里面是一层非晶体状蛋白样结构;第三层结构为由162个壳粒组成的衣壳,是一个等24面体;最中心的是核酸蛋白核心,它含有线状双链DNA的基因组,G+C含量高达73%。
PRV具有广泛的细胞嗜性,可以在多种传代细胞增殖并引起CPE,如BHK-21、VERO、PK-15等。通过电镜观察细胞培养的病毒粒子可以看到有部分病毒具有完整的囊膜结构,有一部分病毒只具有核衣壳和内部结构,因此,核衣壳蛋白可以比较全面的反应所以病毒粒子在细胞中的情况,可以被用来作为病毒粒子的检测标准。核衣壳蛋白VP5是稳定的病毒粒子结构蛋白,在病毒粒子中占有很大比例[6]。本研究对PRV bartha疫苗株VP5基因进行克隆,并原核表达获得病毒VP5截短蛋白,以期为PRV的流行变异、细胞生物学研究及病原检测提供技术支持。
1 材料与方法
1.1 病毒、细胞和试剂 猪伪狂犬病bartha活疫苗购自成都天邦生物制品有限责任公司;BHK-21细胞由本实验室保存;DmEm培养液购自gibio,无支原体初生牛血清购自杭州四季青生物材料有限公司;DH5α感受态细胞、BL-21感受态细胞购自大连宝生物有限公司;Axyprep DNA 凝胶回收试剂盒,质粒小题试剂盒均购自AXYGEN;琼脂糖凝胶购自BIOWEST;其他常用试剂均为国产分析纯。
1.2 病毒增殖 用含10%牛血清的DmEm培养BHK-21细胞,待细胞长成单层后,除去培养基,用PBS(pH7.2)洗单层细胞1次,接种PRV,37℃吸附1h后,加入维持液(含2%牛血清的DmEm),继续在37℃培养约48h,待细胞病 变达80%以上时,反复冻融细胞3次,收获病毒悬液,按常规方法测定其TCID50。
1.3 PRV基因组DNA提取 取反复冻融的PRV病毒液500µl于1.5ml离心管中,加入蛋白酶K 5µl,按照试剂盒说明提取病毒DNA。
1.4 VP5蛋白生物学特性分析及基因扩增 根据GenBank公开的伪狂犬病毒VP5基因序列,对vp5表达蛋白生物特性进行分析。选取VP5蛋白亲水区1-398位氨基酸设计引物,引物序列如下:PRV-VP5 F: 5'-ttaagaattcatggagcgcccg gccatcctgccg-3';PRV-VP5R: 5'-taattaagcttgtacggcacctgcgtg gcctggta-3'引物中下划线部分为酶切位点 :EcoR I与Hind III。引物由上海生工生物工程技术服务有限公司合成。
反应体系:5×Buffer 10μl,dNTP mixture4μl,模板1μl,ddH2O 32.5μl,DNA Polymerase0.5μl,上、下游引物各1μl,共50μl。反应条件:94℃预变性3min;95℃ 10s,55℃15s,72℃90s,共30个循环;最后72℃延伸10min。产物Axyprep DNA凝胶回收试剂盒进行回收。
1.5 VP5原核表达载体的构建 上述胶回收所得产物和pET-28a载体同时用限制性内切酶EcoR I与Hind III 进行双酶切,分别切取VP5基因目的条带与pET-28a载体条带,切胶回收。回收产物连接过夜,连接产物转化DH5α感受态细胞,筛选阳性克隆,提取质粒酶切鉴定,获得 重组质粒,命名为VP5-pET28。
1.6 重组VP5蛋白的表达 重组质粒VP5-pET28转化BL21表达菌活化培养,挑取阳性克隆,接种于2ml LB培养液中,于37℃振荡过夜;次日取100μl菌液,接种于2ml LB培养液中,于37℃振荡培养3h,加入IPTG使其终浓度为1.5mmol/L,20℃诱导12h,取样进行12% SDS-PAGE分析。同时收集菌体,以5ml/g湿菌的比例加入超声缓冲液,于冰浴中超声破菌(功率300W,超声3s,间隔3s,共10min)。离心,分别收集上清和沉淀,SDS-PAGE分析重组蛋白的表达形式。
1.7 重组蛋白的大量纯化 将阳性菌株接种到1L LB培养基内,按照1.6方法大量诱导蛋白表达。收集菌体,将菌体裂解液沉淀悬于Binding Buffer(0.15m NaCl,20mm Tris-Cl,5mm咪唑,pH7.9)中,洗涤,于冰浴中超声破菌(功率300W,超声3s,间隔3s,共40min)。12000rpm离心30min,分别收集上清和沉淀,取上清,经孔径为0.45μm的滤膜过滤,并负载上Ni-Agarose His柱,用15倍柱体积的Binding Buffer 冲洗柱子,5倍柱体积的Eluting Buffer (0.15m NaCl,20mm Tris-Cl,500mm咪唑)洗脱,分步收集。取各管收集液1ml,进行SDS-PAGE分析。
1.8 表达产物的Western blot分析 表达产物经SDSPAGE后,电转移至PVDF膜上,用5%脱脂奶粉封闭2h,分别加入阳性PRV血清及抗HIS单克隆抗体,4℃孵育过夜;PBST洗涤,加入HRP标记的羊抗鼠IgG(1:3000稀释),室温作用1h;DAB显色,观察结果。
2 结果
2.1 VP5基因扩增产物的鉴定 VP5基因PCR扩增产物经1%琼脂糖凝胶电泳分析,可见约1215bp的特异性条带,大小与预期相符,见图1。
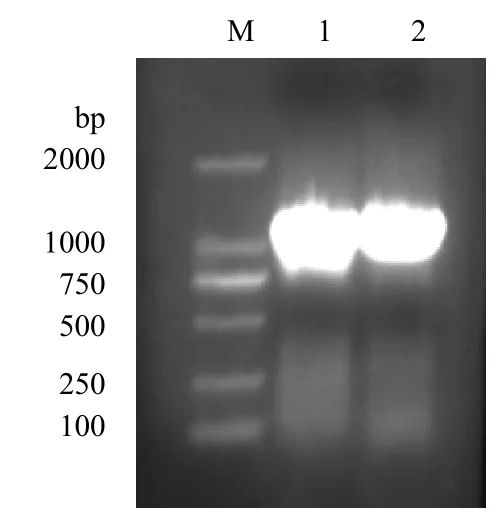
图1 VP5基因PCR扩增产物鉴定 m.DL2000 maeker;
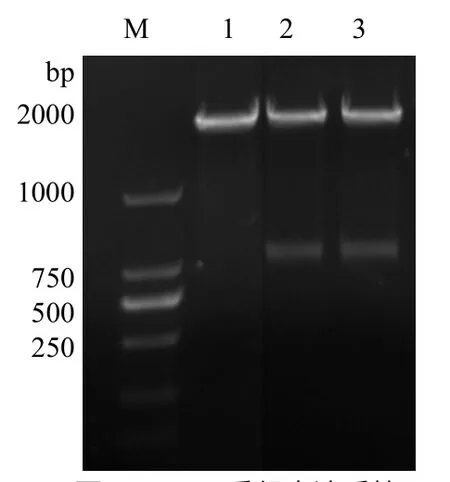
图2 PPE68重组表达质粒 双酶切产物的鉴定
2.2 重组表达质粒的鉴定 琼脂糖凝胶电泳分析显示,重组表达质粒 pET-28a-VP5的PCR产物可见1215bp的目的基因片段,经EcoR I和Hind III双酶切,可见约5400bp的载体片段和1215bp的目的基因片段,见图2。双向测序结果与VP5基因编码序列完全一致。
2.3 表达产物的SDS-PAGE分析 将测序正确的阳性质粒转化表达菌BL21,诱导表达VP5蛋白。SDS-PAGE分析显示,BL21/pET-28a(+)-VP5的诱导表达产物可见相对分子质量约45KD的蛋白条带,为上清表达。见图3(第4泳道)。而BL21/pET-28a(+)-VP5未加IPTG诱导表达组及BL21/pET-28a(+)的诱导表达产物没有明显的表达条带。经胶扫描分析,目的蛋白约占菌体总蛋白的61%。融合蛋白主要以可溶性形式存在。
2.4 重组蛋白的Western blot分析 Western blot分析显示,重组蛋白可以与PRV阳性血清及his单克隆抗体反应,在相对分子质量约45KD处可见特异的反应条带,与VP5融合蛋白预期相符(图4)。

图3 诱导产物表达鉴定

图4 VP5蛋白免疫原性鉴定
3 讨论
(1)PRV是一种α-疱疹病毒,可引起多种家畜和野生动物的伪狂犬病。除猪以外的其它动物表现为致死性感染。猪是PRV的天然宿主和贮存宿主,常呈流行性感染。成年猪表现为隐性感染和呼吸道症状,母猪流产、产死胎和木乃伊胎,公猪表现为睾丸炎。仔猪表现发热、昏迷和神经症状,死亡率很高。PRV感染猪后可建立潜伏感染,主要潜伏在猪的神经组织中,此时在猪体内检测不到病毒,但在应激因子的刺激下潜伏感染的病毒基因组被激活,重新产生感染性病毒粒子,导致动物发病,并传播给其它动物。(2)近年来流行病学调查显示,我国猪场伪狂犬病的感染率很高[7]。自2013年以来,伪狂犬病毒野毒在各个猪场被广泛检测到,造成了伪狂犬病的发生,病猪死亡率很高[8-10]。本实验室从不同地区分离了几株野毒株,并进行了基因序列分析。本实验成功构建了PRV核衣壳蛋白VP5截短基因重组表达质粒,原核表达并纯化了重组VP5蛋白,纯化后的重组蛋白纯度较 高,为伪狂犬病毒特异性诊断抗原的开发及疫苗的研制奠定了基础。
[1]Se nf W, Seffner W.Experiences with Aujeszky's disease with special reference to some cases in sheep and cattle.monatshefte fur veterinarmedizin, 1966, 21:58-64.
[2]Sh ope RE.Pseudorabies as a contagious disease in swine.Science, 1934, 80:102-103.
[3]李春华, 王英, 蒋凤英等.猪伪狂犬病研究进展[J].动物医学进展, 2008, 29:68-72.
[4]童光志, 陈焕春.伪狂犬病流行现状及我国应采取的防制措施[J].中国兽医学报, 1999, 19:1-2.
[5]Pomeranz LE, Reynolds AE, Hengartner CJ.molecular biology of pseudorabies virus: impact onneurovirology and veterinary medicine.microbiology and molecular biology reviews, 2005, 69:462-500.
[6]向骏, 程安春, 汪铭书.疱疹病毒衣壳蛋白及其组装研究进展[J].中国农业科学, 2010, 43:22.
[7]Pedersen K, Bevins SN, Baroch JA, et al.Pseudorabies in feral swine in the United States, 2009-2012.Journal of wildlife diseases, 2013, 49:709-713.
[8]An TQ, Peng Jm, Tian ZJ, et al.Pseudorabies virus variant in Bartha-K61-vaccinated pigs, China, 2012.Emerging infectious diseases, 2013, 19:1749-1755.
[9]白挨泉, 王晓清, 甄劲松等.广东部分集约化猪场猪伪狂犬病毒野毒感染的血清学调查[J].中国畜牧兽医, 2005, 32: 55-57.
[10]Yu X, Zhou Z, Hu D, et al.Pathogenic pseudorabies virus, China, 2012.Emerging infectious diseases, 2014, 20: 102-104.
