地锦叶斑病病原菌的鉴定及其生物学特性1)
2015-03-10高国平邓秋越王红王月谢皖豫马腾飞
高国平 邓秋越 王红 王月 谢皖豫 马腾飞
(沈阳农业大学,沈阳,110161)
地锦叶斑病病原菌的鉴定及其生物学特性1)
高国平 邓秋越 王红 王月 谢皖豫 马腾飞
(沈阳农业大学,沈阳,110161)
结合传统形态学和分子生物学方法对地锦(Parthenocissustricuspidata)叶斑病病原菌进行了鉴定,并在室内纯培养条件下,采用生长速率法研究了病原菌在不同培养基、pH值、温度、光照、碳源和氮源条件下菌丝生长和菌落形态。结果显示:病原菌为马卡假尾孢(PseudocercosporamacadamiaeDeighton);病原菌生长较适培养基为PDA培养基和20%地锦植物煎汁的PDA培养基,适宜pH值为6.0~7.0,菌丝生长适宜温度范围为25~30 ℃,最适碳源为蔗糖,最适氮源为酵母粉,最佳光照条件为全黑暗。
地锦;叶斑病;马卡假尾孢;生物学特性
We identified the leaf spot fungus ofParthenocissustricuspidataby the means of combining the traditional morphological and molecular biological methods, and we studied the effects of medium, pH, temperature, light, carbon and nitrogen resources on mycelium growth and colony morphology by growth rate method. The pathogenic bacterium wasPseudocercosporamacadamiaeDeighton. The optimum medium for the mycelium growth was PDA medium and PDA medium withParthenocissustricuspidataextract. The optimum pH was 6-7, and the optimum temperature for mycelia growth was 25 ℃-30 ℃. The mycelium grew best on media with sucrose as carbon source, yeast as nitrogen resource and the optimum photoperiod was in darkness.
地锦(Parthenocissustricuspidata),别名爬山虎,为葡萄科(Vitaceae)地锦属(Parthenocissus)多年生大型落叶木质藤本植物[1],具有极强的生态适应性、耐旱性和吸附攀援能力,因而是具有观赏性和装饰性的园林绿化植物[2]。但近些年来,在地锦叶片上常常发生一种叶斑病害,该病害能引起叶片叶斑、叶枯、早落,严重影响其观赏价值和生长存活。国内外对于该植物病害的研究报道较少,特别对病原菌生物学特性的研究也鲜有报道。本研究采用形态学和分子鉴定技术相结合的方法[3-4],对地锦叶斑病病原菌进行鉴定,并在室内菌丝纯培养条件下开展了病原菌生物学特性试验,在理论上和实践上对掌握该病原菌及其病害具有重要意义。
1 材料与方法
1.1 病原菌的分离与鉴定
采样与分离纯化:从野外采集病症明显的地锦叶片,在实验室内无菌操作条件下采用组织分离法,将分离材料消毒后移至提前准备好的PDA培养基内,经分离纯化后置于冰箱内4 ℃保存备用[5-6]。
传统形态学鉴定:首先对病原菌子实体形态进行观察和描述,然后用常规切片镜检法制作病理切片,根据形态及孢子特征初步鉴定病原物种类[7-8]。
分子生物学鉴定:采用CTAB法提取基因组DNA[9]。用引物ITS1/ITS4对供试材料的rDNA ITS序列进行PCR扩增,ITS1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′[10]。反应体系为DNA模板1 μL,引物各2 μL,Master Mix 25 μL,加dd H2O至50 μL。反应条件为94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共设35个循环,4 ℃保存。PCR反应结束以后各取2.5 μL产物电泳(1%琼脂糖)检测。目的片段回收方法参照TaKaRaAgaroseGelDNA PurificationKitVer.2.0切胶。序列测定工作由大连宝生物工程有限公司完成。将测得的ITS序列用GenBank中的BLAST序列比对工具进行目的序列比对[11-12]。
1.2 生物学特性研究
用孔径为0.6 cm的打孔器打取保存于PDA平板的菌落外缘菌饼,接种于供试培养基上,每个不同处理设5个重复,培养4 d后采用生长速率法十字交叉测量菌落直径,求出净生长直径(菌落直径)[13]。
培养基:分别选用马铃薯葡萄糖琼脂培养基、麦芽糖琼脂培养基、查式培养基、牛肉膏蛋白胨培养基、燕麦片琼脂培养基、玉米粉琼脂培养基、地锦煎汁琼脂培养基、20%地锦煎汁PDA培养基,将病原菌菌落接种于供试培养基中,置于培养箱中25 ℃恒温培养[14]。
pH值:用调配好的HCL(1 mol·L-1)和NaOH(1 mol·L-1)调节PDA培养基pH值[15]。pH值分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0。将病原菌菌落接种于不同pH值PDA培养基上,置于培养箱中25 ℃培养。
温度:将病原菌菌落接种于PDA培养基上,置于培养箱中5、10、15、20、25、30、35 ℃恒温培养。
光照:将病原菌菌落接种于PDA培养基上,置于25 ℃恒温下全光照、12 h光照/12 h黑暗交替、全黑暗条件下培养。
碳源:以Czapek培养基为基础配方,分别选择蔗糖、葡萄糖、果糖、乳糖、麦芽糖、木糖、淀粉作为碳源制作培养基,同时设无碳培养基对照,置于培养箱中25 ℃培养。
氮源:以Czapek培养基为基础配方,分别选择氯化铵、硝酸铵、酵母粉、甘氨酸、L-甲硫氨基酸、L-谷氨酸、蛋白胨、草酸铵为氮源,同时设无氮培养基对照,置于培养箱中25 ℃培养。
2 结果与分析
2.1 菌种鉴定
2.1.1 形态鉴定
斑点生于叶的正背两面,近圆形至不规则形,直径2.0~10.5 mm,常多斑愈合,初期仅为褐色小点,外具浅青黄色至浅黄褐色晕圈,后期叶面斑点褐色至黑褐色,叶背斑点褐色至深灰褐色。属于无性型真菌。子实体叶两面生,以生于叶背为主。菌丝体内生。子座小,叶表皮下生,近球形,褐色至暗褐色,直径15.0~40.0 μm(图1A)。分生孢子梗多根紧密簇生,褐色至暗褐色,宽度不规则,向顶略变细,直立或稍弯曲(图1B)。单生分生孢子梗青黄褐色,分生孢子倒棍棒-圆柱形,近无色至浅青黄色,直立至弯曲,顶部近尖细至钝,基部倒圆锥形平截,3~15个隔膜,每个细胞内有1至多个大小不等的油滴,孢子大小(31.0~90.0)μm×(3.0~8.0)μm(图1C)。根据其形态特征,查阅国内已有资料[16-17],未见与该种形态完全相同的描述。但根据子座、分生孢子、分生孢子梗等特点,可确定为假尾孢菌属(Pseudocercospora)的一个种。
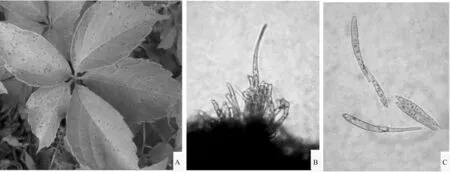
A.发病症状;B.分生孢子梗形态;C.分生孢子形态。
2.1.2 分子生物学鉴定
PCR扩增产物通过1%琼脂糖凝胶电泳检测,显示图象清晰,条带明显。经扩增得到547 bp片段(图2)。
测得菌株的ITS区段的DNA序列:
ATGATCGGGCTCGGCCCGATCCTCCCACCCTT
TGTGTACCTACCTCTGTTGCTTTGGCGGGCCGCGGT
CCTCCGCGGCCGCCCCCCTCCCCGGGGGGGTGGCC
AGCGCCCGCCAGAGGACCATCAAACTCCAGTCAGT
AAACGATGCAGTCTGAAAAACATTTAATAAACTAA
AACTTTCAACAACGGATCTCTTGGTTCTGGCATCGA
TGAAGAACGCAGCGAAATGCGATAAGTAATGTGAA
TTGCAGAATTCAGTGAATCATCGAATCTTTGAACGC
ACATTGCGCCCTTTGGTATTCCGAAGGGCATGCCTG
TTCGAGCGTCATTACAACCCTCAAGCTCTGCTTGGT
ATTGGGCACCGTCCTTTGCGGGCGCGCCTCAAAGA
CCTCGGCGGTGGCGTCTTGCCTCAAGCGTAGTAGA
ACATACATCTCGCTTCGGAGCGCAGGGCGTCGCCC
GCCGGACGAACCTTCTGAACTTTTCTCAAGGTTGAC
CTCGGATCAGGTAGGGATACCCGCTGAACTTAAGC
ATATCAAAATCGGGAGGAA
应用以上测序结果在国际GenBank中进行对比分析,从数据库中比对到相似度100%的马卡假尾孢菌(PseudocercosporamacadamiaeDeighton),登录号为EU541881。因此,在形态学鉴定描述的基础上结合分子生物学检测结果,最后确定地锦叶斑病病菌为马卡假尾孢,为中国植物病害真菌新记录种。
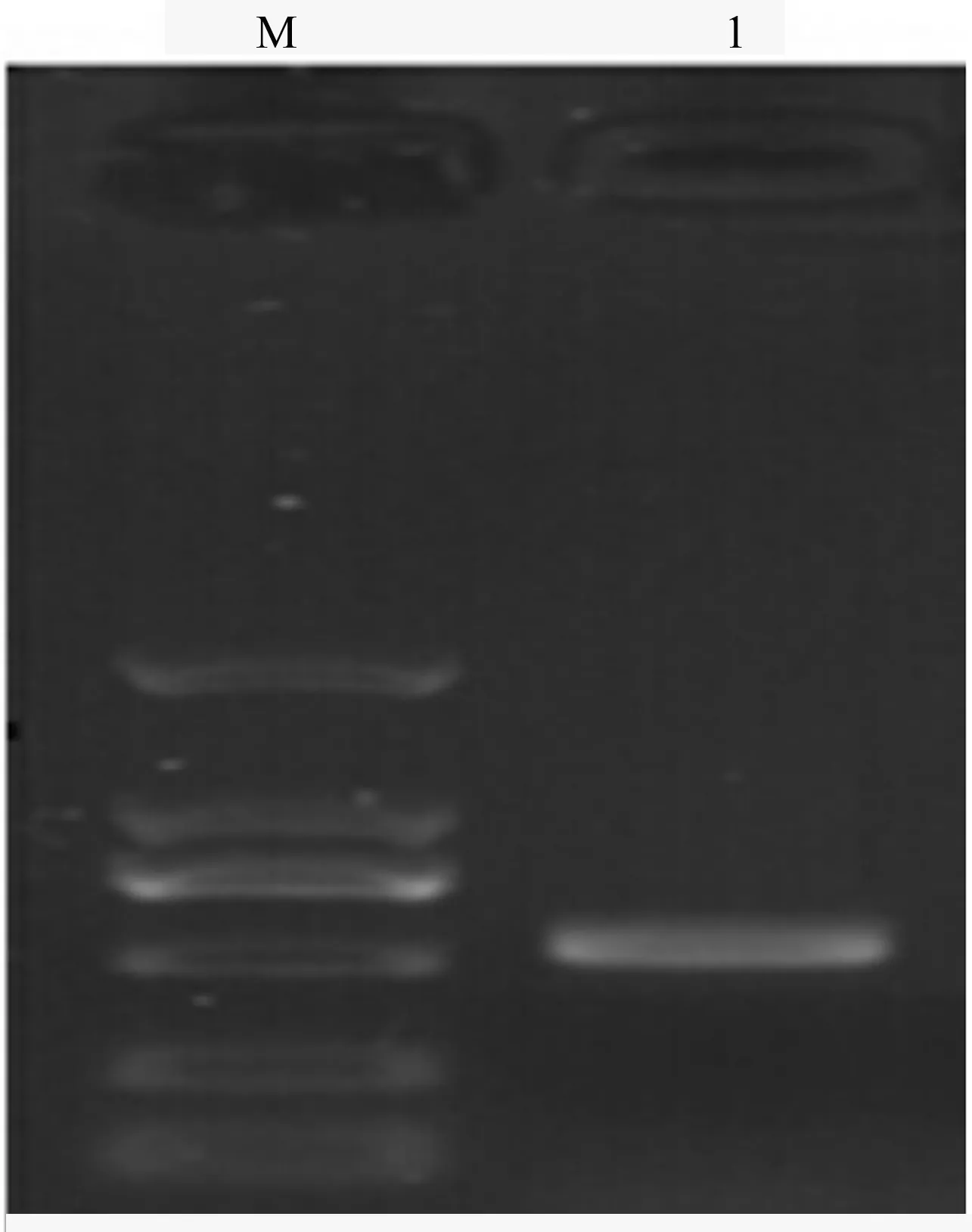
M.DL2000 DNA Marker;1.PCR产物。
2.2 病原菌的生物学特性
2.2.1 培养基
由表1可知,病原菌在不同培养基上均能生长。在查式培养基、燕麦片琼脂培养基、马铃薯葡萄糖琼脂培养基、玉米粉琼脂培养基、地锦煎汁琼脂培养基和20%地锦煎汁PDA培养基上菌丝生长速度差异不显著,但是病原菌在20%地锦煎汁PDA培养基和马铃薯葡萄糖琼脂培养基上的菌落形态生长最好,其次为地锦煎汁琼脂培养基和牛肉膏蛋白胨培养基。病原菌在燕麦片琼脂培养基和玉米粉琼脂培养基上生长速度很快,但是菌丝纤细,结构稀疏。麦芽糖琼脂培养基上菌落生长速度最慢并且菌丝极细而稀疏(图3)。

表1 培养基对马卡假尾孢菌丝生长的影响
注:菌落直径指培养4 d后净生长直径,数值为“平均值±标准差”。同列数字后字母不同表示在0.05水平上差异显著。
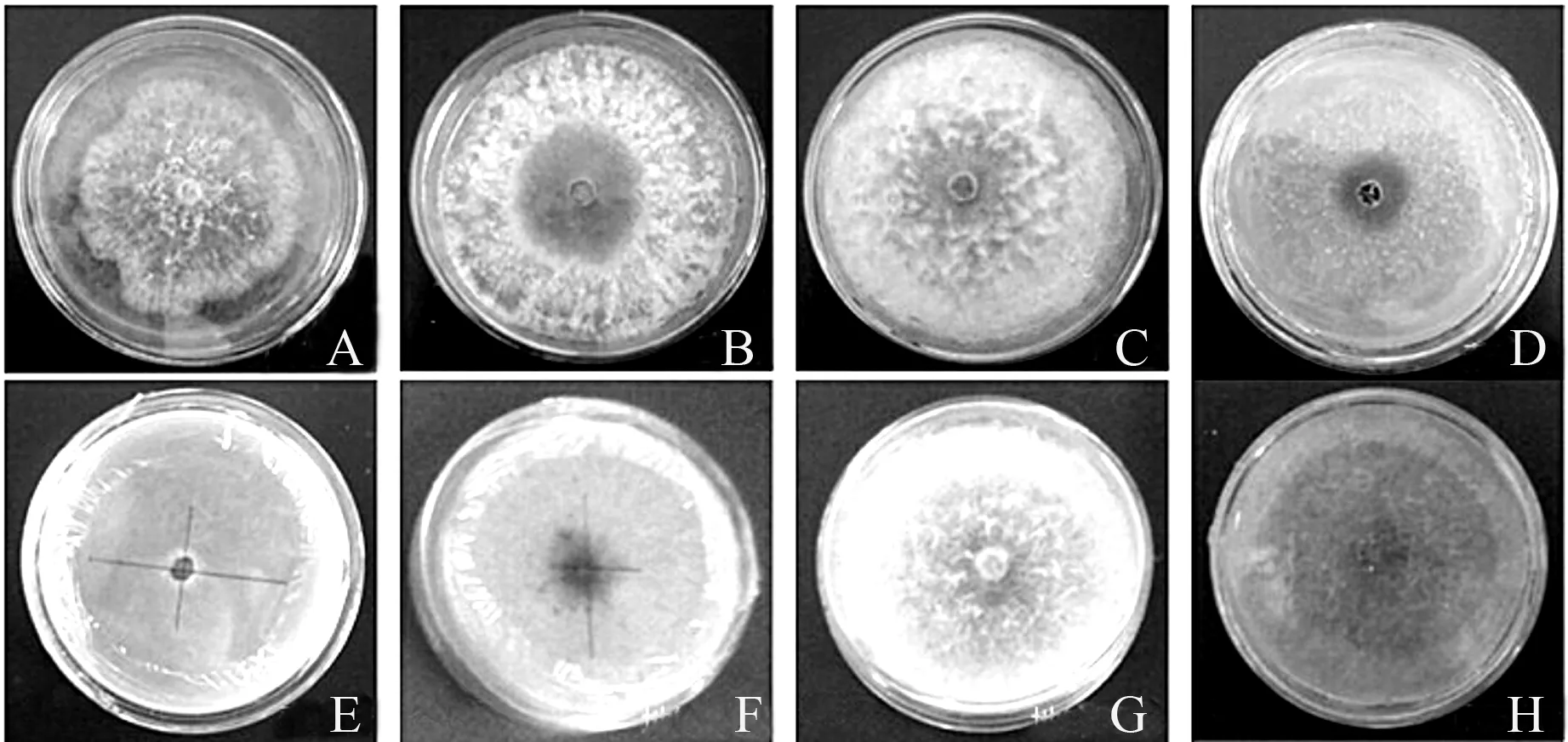
A.牛肉膏;B.查式;C.PDA;D.燕麦片;E.麦芽糖;F.地锦琼脂;G.地锦PDA;H.玉米粉。
图3 马卡假尾孢在不同培养基上的生长情况
2.2.2 pH值
病原菌在pH=3.0~11.0范围内均能生长(表2、图4)。在pH=4.0~8.0范围内均能快速生长,但pH=6.0~7.0时菌落生长最好,为最适生长范围。pH>7.0时,菌落生长速度呈减慢趋势。病原菌在pH=3.0培养条件下的菌落直径显著大于pH=11.0的,可见,病原菌喜偏酸环境。
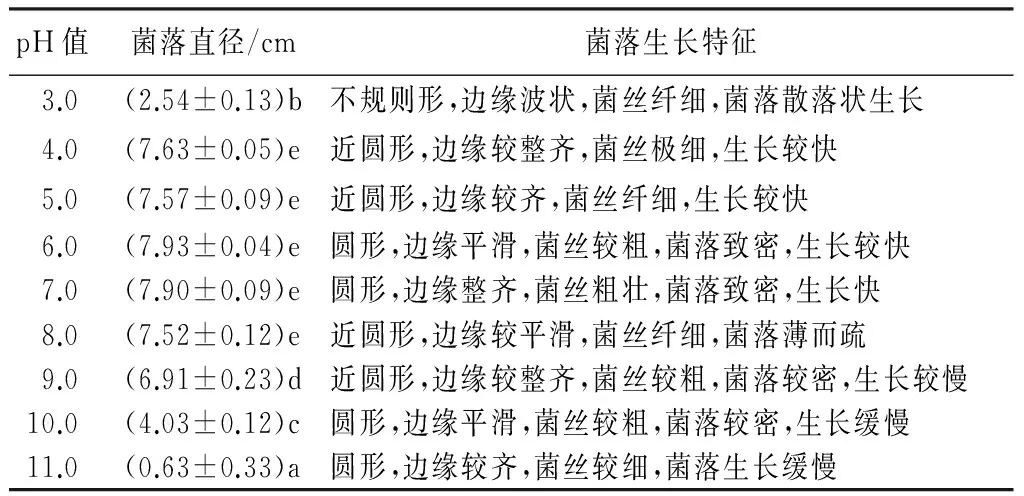
表2 pH值对马卡假尾孢菌丝生长的影响
注:菌落直径指培养4 d后净生长直径,数值为平均值±标准差。同列数据后字母不同表示在0.05水平上差异显著。
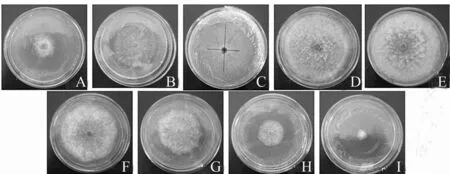
A.pH=3;B.pH=4;C.pH=5;D.pH=6;E.pH=7;F.pH=8;G.pH=9;H.pH=10;I.pH=11。
图4 不同pH培养条件下马卡假尾孢的生长情况
2.2.3 温度
病原菌在10~35 ℃范围内均能生长(表3、图5)。在25~30 ℃生长较好且速度较快,为最适生长温度范围;在温度低于20 ℃和高于30 ℃,菌落生长缓慢;病原菌在5 ℃低温条件下的培养天数内未见生长,在35 ℃高温条件下菌落日渐干瘪,生长停滞。
2.2.4 光照
病原菌在3种不同光照条件下均能快速生长,但不同光照条件下菌落形态特征不同(表4、图6)。在全黑暗条件下生长速度最快且菌丝最为粗壮致密,全光照条件下菌丝纤细而稀疏,12 h光暗交替介于二者之间。

表3 温度对马卡假尾孢菌丝生长的影响
注:菌落直径指培养4 d后净生长直径,其数值为平均值±标准差。同列数据后字母不同表示在0.05水平上差异显著。
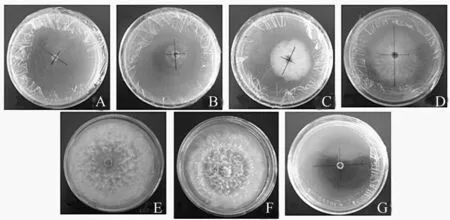
A.5℃;B.10℃;C.15℃;D.20℃;E.25℃;F.30℃;G.35℃。

表4 光照条件对马卡假尾孢菌丝生长的影响
注:菌落直径指培养4 d后净生长直径,数值为平均值±标准差。同列数据后字母不同表示在0.05水平上差异显著。
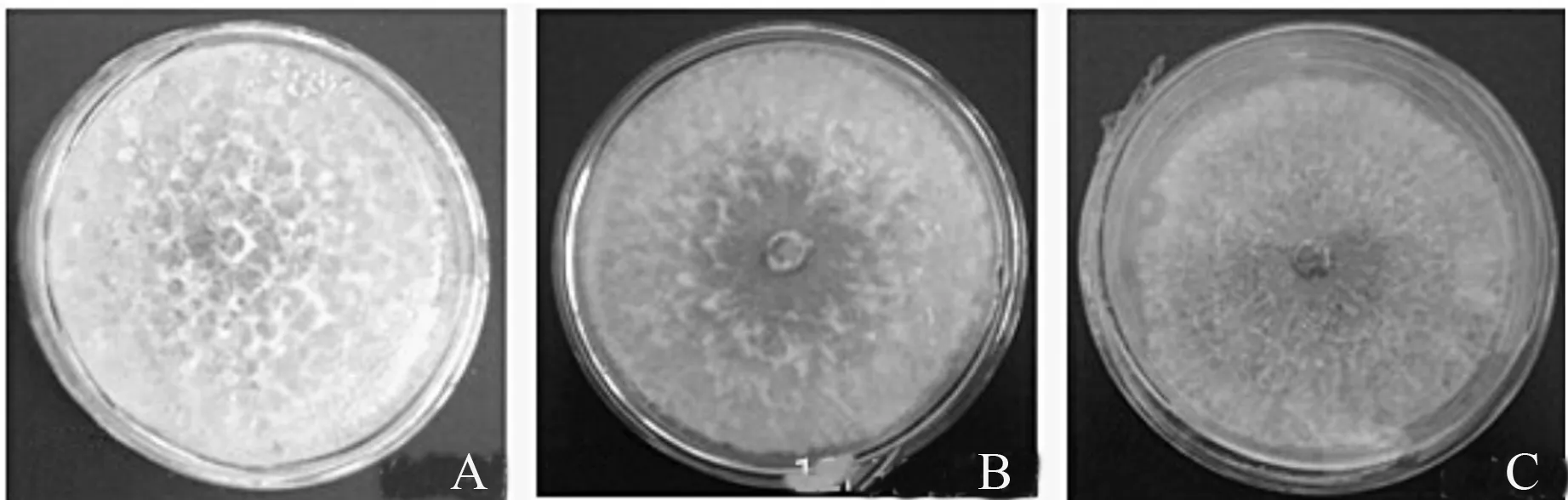
A.全黑暗;B.12 h光暗交替;C.全光照。
2.2.5 碳源
病原菌在7种不同碳源和无碳CK培养基上均能生长,但菌丝生长速度差异显著(表5、图7)。病原菌对蔗糖、葡萄糖、果糖、麦芽糖和乳糖利用较好,生长速度较快,其中以对蔗糖的利用最好,生长速度较快且菌落形态较好,所以蔗糖为最适碳源;在淀粉、木糖和无碳条件下生长不佳,对木糖的利用最差。
2.2.6 氮源
病原菌在8种不同氮源和无氮条件下均能生长(表6、图8)。在L-谷氨酸、酵母粉和蛋白胨培养基上生长较好,其中L-谷氨酸生长速度最快,但菌落形态没有酵母粉粗壮致密,所以酵母粉为最适氮源;在草酸铵、氯化铵和硝酸铵培养基上生长速度和菌落形态方面均差异不显著;在L-甲硫氨基酸和无氮CK培养基上生长速度很快,但是菌落极细并稀疏;对甘氨酸的利用效果最差。

表5 碳源对菌丝生长的影响
注:菌落直径指培养4 d后净生长直径,数值为平均值±标准差。同列数据后字母不同表示在0.05水平上差异显著。
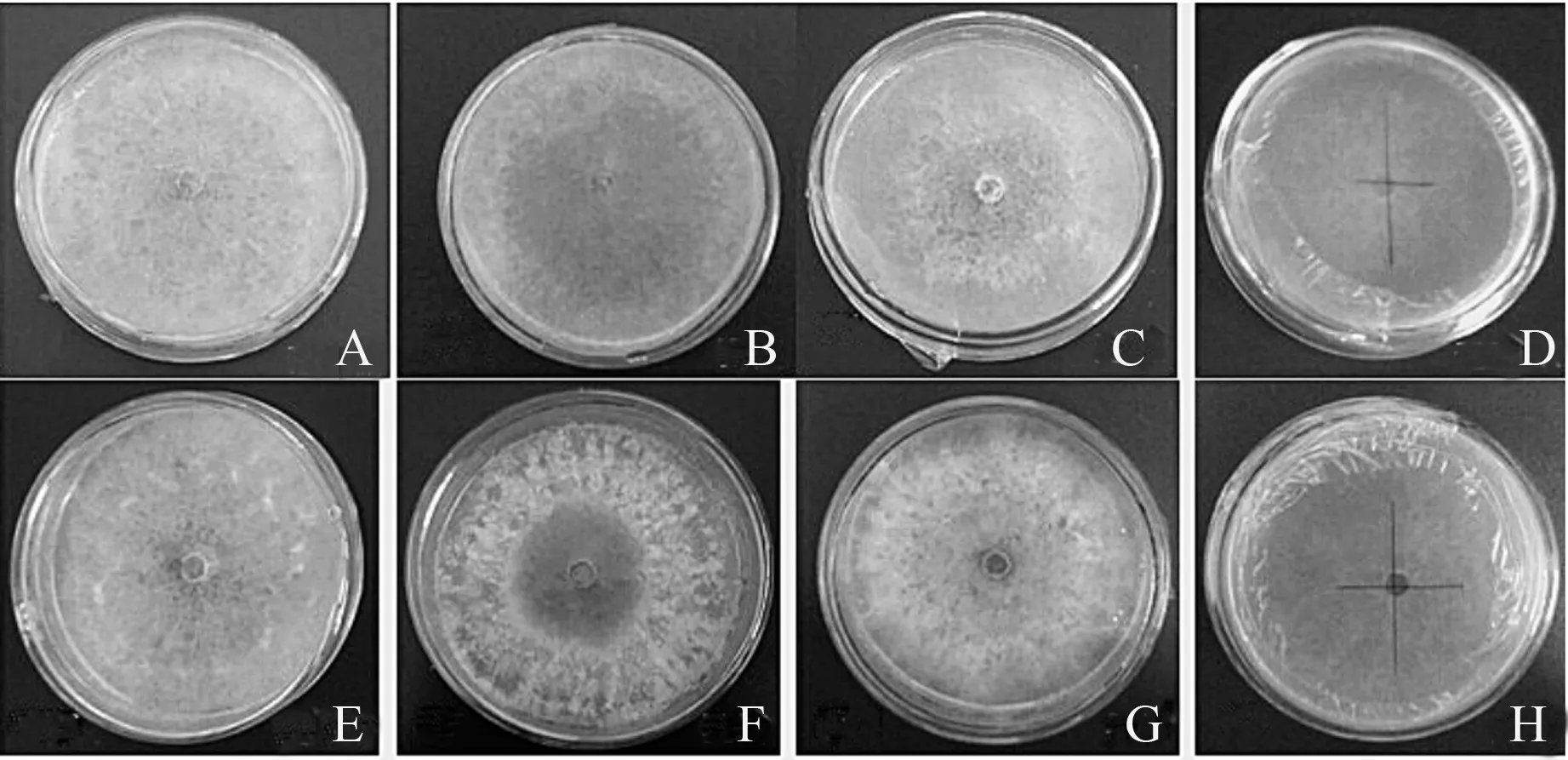
A.葡萄糖;B.乳糖;C.淀粉;D.无碳CK;E.麦芽糖;F.乳糖;G.果糖;H.木糖。
图7 不同碳源培养条件下马卡假尾孢的生长情况
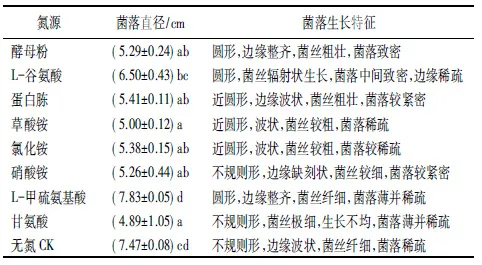
表6 氮源对菌丝生长的影响
注:菌落直径指培养4 d后净生长直径,数值为平均值±标准差。同列数据后字母不同表示在0.05水平上差异显著。
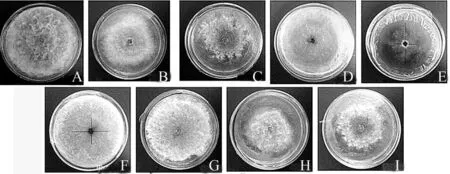
A.酵母粉;B.蛋白胨;C.硝酸铵;D.无氮CK;E.甘氯酸;F.甲硫氨基酸;G.谷氨酸;H.草氨酸;I.氯化铵。
图8 不同氮源培养条件下马卡假尾孢的生长情况
3 结论
地锦叶斑病病菌为马卡假尾孢,属于假尾孢属真菌,为中国植物病害真菌新记录种。该病原菌在10~35 ℃范围内均能生长,菌丝生长适宜温度为25~30 ℃,属中高温型菌种;较适培养基为PDA培养基和加入地锦植物煎汁的PDA培养基;病原菌对多种不同碳源和氮源均能利用,最适碳源为蔗糖,最适氮源为酵母粉,在无碳、无氮培养基上也能微弱生长;在pH=3.0~11.0范围内均能生长,适宜pH值为6.0~7.0,为喜偏酸环境真菌;病原菌在不同光照条件下均能良好生长,在全黑暗条件下生长最快并最好。
[1] 张毅功,陆诗雷,孙振元,等.爬山虎属植物利用研究[J].资源科学,2005,27(5):141-145.
[2] 冯大领,孟祥书,崔彬彬,等.爬山虎属植物的研究现状及展望[J].河北林果研究,2006,21(3):272-275.
[3] 张丽丽,张敬泽,胡东维,等.一串红叶斑病的病原菌鉴定[J].菌物学报,2008,27(5):634-640.
[4] 李长松,张眉,李林.山东省黄瓜棒孢叶斑病(褐斑病)病原菌鉴定和防治[J].中国蔬菜,2009(18):29-33.
[5] 方中达.植病研究方法[M].中国农业出版社,1998.
[6] 项存悌.林病研究法[M].哈尔滨:东北林业大学出版社,1991.
[7] 王婷,王龙,王生荣.万寿菊叶斑病病原鉴定及其生物学特性研究[J].甘肃农业大学学报,2010,45(3):66-68.
[8] 谢昌平,谭翰杰,张能,等.斐济金棕叶斑病菌鉴定及生物学特性[J].植物保护,2009,35(2):67-71.
[9] 吴发红,黄东益,黄小龙,等.几种真菌DNA提取方法的比较[J].中国农学通报,2009,25(8):62-64.
[10] 卢伟.桂花一种叶斑病病原菌鉴定及生物学特性研究[D].洛阳:河南科技大学,2013.
[11] Nilsson R H, Hyde K D, Pawlowska H J, et al. Improving ITS sequence data for identification of plant pathogenic fungi[J]. Fungal Diversity,2014,67(1):11-19.
[12] Li Yanyan, Shen Songdong, He Lihong, et al. Sequence analysis of the ITS region and 5.8S rDNA of Porphyra haitanensis[J]. Chinese Journal of Oceanology and Limnology,2009,27(3):493-501.
[13] 张伟,高国平,祁金玉,等.3种林木病原腐朽菌生长特性研究[J].西北林学院学报,2010,25(3):122-125.
[14] Rawla G S, Chahal S S, Singh T. Organic growth factor requirements ofPseudocercosporavitis(Lev.) Speg. and Cercospora mitteriana Syd.[J]. Indian Acad Sci,1976,83(6):232-236.
[15] 纪瑛,肖崇刚.红花酢浆草叶斑病病原菌生物学特性研究[J].植物保护,2006,32(5):65-68.
[16] 刘锡琎,郭英兰.中国真菌志:第9卷:假尾孢属[M].北京:科学出版社,1998.
[17] 郭英兰,刘锡琎.中国假尾孢属的研究II[J].真菌学报,1992,11(2):125-133.
Pathogen Identification and Biological Characteristics of Creeper Leaf Spot
Gao Guoping, Deng Qiuyue, Wang Hong, Wang Yue, Xie Wanyu, Ma Tengfei(Shenyang Agricultural University, Shenyang 110161, P. R. China)/Journal of Northeast Forestry University,2015,43(3):112-116.
Parthenocissustricuspidata; Leaf spot;Pseudocercosporamacadamiae; Biological characteristics
1)辽宁省沈阳市科学计划资助项目(F11-107-3-00)。
高国平,男,1961年2月生,沈阳农业大学林学院,教授。E-mail:ggp8881@163.com。
2014年8月24日。
S763.15
责任编辑:程 红。
