树莓‘沙尼’组培技术1)
2015-03-10霍朗宁张东升贾忠奎
霍朗宁 张东升 贾忠奎
(省部共建森林培育与保护教育部重点实验室(北京林业大学),北京,100083) (国家林业局) (省部共建森林培育与保护教育部重点实验室(北京林业大学))
树莓‘沙尼’组培技术1)
霍朗宁 张东升 贾忠奎
(省部共建森林培育与保护教育部重点实验室(北京林业大学),北京,100083) (国家林业局) (省部共建森林培育与保护教育部重点实验室(北京林业大学))
应用树莓(RubusideausL.)的优良品种‘沙尼’(‘Shawnee’)进行组织培养技术的探索和研究,以期为树莓的大量繁育和推广提供技术支撑。结果表明:最佳外植体的选择为带芽茎段,最佳的取材时间为5月份,萌发率可达100%。最佳灭菌体系的流程为75%酒精浸泡30 s后无菌水冲洗3~4次,然后再以2% NaClO灭菌20 min后无菌水冲洗3次,污染率达到0%。‘沙尼’的最佳初代培养基为MS+6-BA 1.0 mg·L-1+IAA 0.5 mg·L-1;最佳继代培养基为MS+6-BA 0.5 mg·L-1+NAA 0.05 mg·L-1,增殖系数为3.49;最佳生根培养基为1/2MS+IBA 1.0 mg·L-1,生根率为100%,植株可平均生出2 cm的健壮根系10条。
树莓;‘沙尼’;组织培养
In order to breed and popularize the raspberry efficiently, we focused on the Shawnee, a fine-cultivar of raspberry (RubusideausL.), and studied the technology system of tissue culture. The stem section with a bud is an optimum explant while spring in May is an optimum time with the germination rate of 100%. After soaking with 75% alcohol for 30 s and flushing with sterile water for 3-4 times, 2% NaClO to sterilize 20 min before flushing by sterile water for 3 times is an optimum program of sterilization without the contamination. MS+6-BA 1.0 mg·L-1+IAA 0.5 mg·L-1is an optimum early generation culture medium, MS+6-BA 0.5 mg·L-1+NAA 0.05 mg·L-1is an optimum subculture generation culture medium (4.55 proliferation ratio), and 1/2MS+IBA 1.0 mg·L-1is an optimum strike root culture medium (100% root productive ratio, two individual of strong roots and mean length of 10 cm).
树莓果实有很高的营养价值,既是很好的鲜果食品,也可加工成果汁、果酒、果干蜜饯等食品。随着人们对树莓认识的不断提高,树莓将成为我国新兴果业的先锋树种,发展前景十分广阔[1]。采用常规的营养繁殖方法无法在短时间内获得大量苗木,而组培快繁的方法具有更好的优势[15]。通过树莓组织培养技术推动快速繁殖优良苗是一个重要的趋势,亟需建立一套完整的组织培养技术体系。
在组织培养技术中,基本培养基的种类、碳源的种类和浓度是为试管苗提供营养的关键因子,也是试管苗生长的重要物质基础。外界环境条件是组织培养中重要因素之一,特定物种植株对光照、温度、湿度、培养基酸碱度、气体成分等方面有特定要求。树莓正常生长的环境条件大致为培养温度(25±2)℃,光照强度1 500~2 500 lx,光照时间10~15 h·d-1,相对湿度40%~80%,培养基pH值5.4~5.8[13]。
树莓外植体的选择主要集中于茎段、茎尖、叶片、腋芽4种。其中前三种类型的外植体诱导率由大到小的排序为茎段(79.3%)、茎尖(45.4%)、叶片(较低);出芽率由大到小的排序为茎段(50.6%)、茎尖(40.8%)、叶片(较低)[3]。在初代培养中,茎段的诱导率相对较高,带芽茎段是树莓组织培养较佳的外植体材料[2]。而相比茎段、茎尖、叶片外植体,腋芽的诱导效果较好,消毒效果更好,并且对于组织伤害作用小,在初代培养中具有较好的发芽率,因此,腋芽也是较佳的外植体[4-5,16],但由于腋芽的体积都很小,单独取下进行培养增大了试验操作难度,对芽体损伤较大,存活率低,容易造成操作损伤。在外植体的采集时机上,春季采集的污染率显著低于其他季节的,即春季是最好的取材时间[2,6]。
在植物愈伤组织培养中,生长调节剂起着传递遗传物质的脱分化、再分化等发育信号的作用,它是诱导愈伤组织产生和分化的极为重要的因素,激素的成分、配比和质量浓度会对试验结果产生重大的影响[12,17],对于初代培养效果来说,萌发率、外植体是否伸长生长是最重要的评价指标,在继代培养中,萌发率、增殖系数、外植体是否伸长生长是最重要的评价指标[3,5,7]。在初代培养基础上,获得的芽和组培苗的数量有限,不能充分发挥组织培养快速繁殖的优势,可通过继代繁殖获取大量增殖材料。调节培养基的pH值、生长调节物的质量浓度以及某些元素的浓度等显得非常重要,在树莓的继代增殖过程中常用的生长素类激素有NAA、IBA,细胞分裂素类激素有6-BA、KT、ZT、赤霉素(GA3)等[8]。
然而,针对已有的树莓组织培养体系相关研究结果发现,不同品种的树莓最适培养基激素质量浓度、配比等多方面结果不尽相同,甚至还出现针对相同品种,在不同的研究中,其结论存在矛盾的现象。因此,本试验整合已有研究中的结果为最适的激素质量浓度、配比等信息进行试验设计,以期对比对于‘沙泥’这个品种来说,哪种条件下的培养为最佳培养,从而建立健全‘沙尼’组织培养快速繁育体系,为其大量生产繁殖提供技术支撑。
1 材料与方法
试验材料为引种于美国的优良树莓品种‘沙尼’(‘Shawnee’),植株多刺、长势强壮、产量较高。生长正常的植株于2013年4月份从北京市房山区树莓生产基地移植至花盆内进行根蘖基质栽培;分别以带腋芽茎段、茎尖为外植体材料,从枝条上取2~5个带芽茎段(自茎尖下部开始,一般为单芽茎段),茎尖分别取自枝条顶端。取下的外植体置于水中,移至试验室进行外植体接种试验。
培养条件:组培室的培养条件为室温(25±2)℃,空气相对湿度60%左右,采用每日光照培养16 h(06:00—22:00)和暗培养8 h的光周期。每个培养架的光照由2根40 W的直管型荧光灯管提供,强度为2 000~3 000 lx。试验初代培养、继代培养都采用MS培养基,生根培养采用1/2MS培养基,并加入30 g蔗糖作为碳源[15]。
最佳外植体的选择:将单芽茎段、茎尖(外植体)置于流动水中冲洗0.5 h,初步完成灭菌工作后置于超净工作台再次消毒(75%酒精30 s,3% NaClO-15 min)和剪切处理,将外植体接种于MS培养基上,30 d后观察外植体生长势,通过外植体萌发率的比较,选出适合树莓组织培养的最佳外植体类型,其中萌发率=(萌发外植体数/接种总数)×100%。将选出的外植体分别于5、6、8月份取材和接种(继代培养),通过观察继代培养外植体的污染率和继代增殖系数,确定沙尼组织培养的最佳取材时间,其中,污染率=(接种污染数/接种总数)×100%,增殖系数=每次继代切割所得带芽茎段数/原接种带芽茎段数。
最佳灭菌体系的建立:取健壮的带芽茎段、茎尖置于流动水中冲洗0.5 h,再用75%酒精进行30 s的初步灭菌(超净工作台),根据不同质量分数灭菌剂NaClO、不同灭菌时间进行消毒试验。经过2% NaClO-15 min、3% NaClO-15 min、2% NaClO-20 min三种预处理后,将外植体接种于MS培养基中,于1周后观察外植体污染情况并统计污染率、死亡率、成活率等,建立带芽茎段的最佳灭菌体系。每种处理接种20个外植体。
初代培养体系的建立:在外植体处理和灭菌后,将带芽茎段接种到加有植物生长调节剂(6-BA,NAA、IAA)的MS培养基上(表1),30 d后观察统计外植体的萌发率和生长势,并结合增殖情况筛选出最佳的初代培养体系。每种处理组合接种20个外植体。
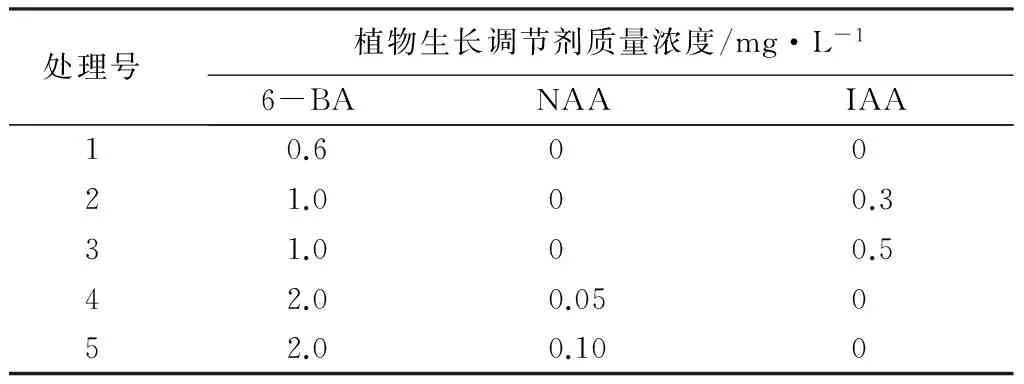
表1 初代培养激素处理设计
继代培养体系的建立:将初代培养的试管苗剪成单芽茎段,接种时添加不同质量浓度的6-BA和NAA、IAA、GA的MS培养基(表2),每种处理重复20次,接种30 d后调查增殖系数。
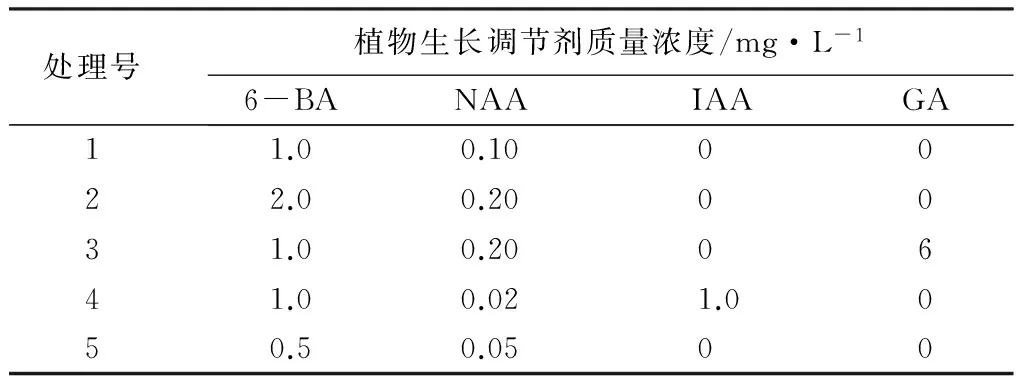
表2 继代培养激素处理设计
生根培养体系的建立:将带芽茎段在初代培养(器官发生途径)下生成的试管苗接种到生根培养基上(共6个处理,表3),30~40 d观察生根情况。每种处理接种20个组培植株。
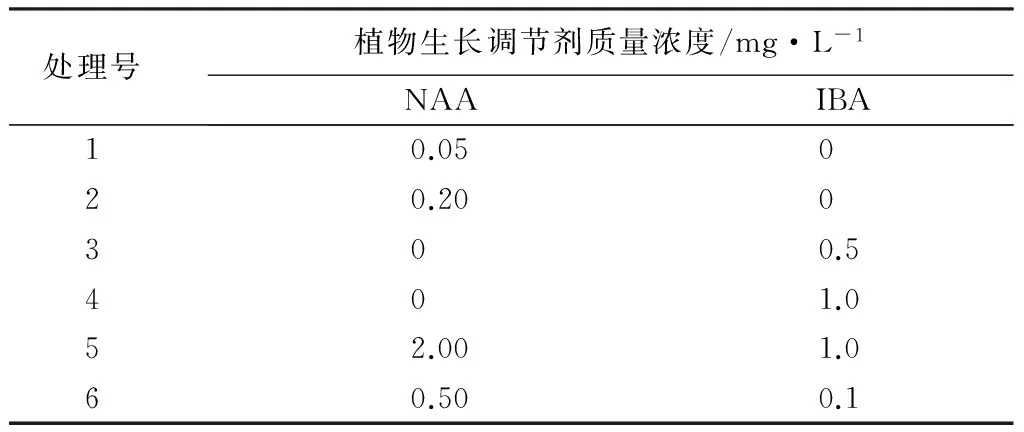
表3 生根培养激素处理设计
2 结果与分析
2.1 最佳外植体的选择
外植体类型的选择:将灭菌的树莓‘沙尼’带芽茎段、茎尖外植体分别接种于MS基本培养基上培养,带芽茎段的萌发率为88.6%,茎尖萌发率为20.0%,表明‘沙尼’在组织培养中带芽茎段应选为最佳外植体。
最佳采集时间的确定:随着植物生长速度加快,原先的嫩枝条内不断木质化,在相同条件下的消毒效果都有明显差异,污染率显著增加,‘沙尼’的增殖系数呈明显下降趋势;外植体最佳取材时间为5月份,此时污染率低,并且能维持较高的增殖系数,为之后的继代培养提供基础。
2.2 最佳消毒灭菌体系
对树莓消毒的NaClO质量分数为2%~3%,消毒时间在15~20 min[15],本研究经过2% NaClO-15 min、3% NaClO-15 min、2% NaClO-20 min三种预处理后,发现2% NaClO-15 min的处理污染率极高(淘汰),而3% NaClO-15 min、2% NaClO-20 min对芽体有一定的伤害作用,表现为个别腋芽生长势较差,因此,不再设置更高质量分数或更长时间的NaClO消毒,重点研究3% NaClO-15 min、2% NaClO-20 min的消毒灭菌作用。对于‘沙尼’品种,两种消毒处理的污染率分别为4.5%和0,消毒效果都较好,但2% NaClO-20 min相对较好,‘沙尼’茎上有较长、软硬不同的枝刺,以及饱满的枝条,在一定程度上影响了消毒效果。
2.3 初代培养体系的建立
带芽茎段接种于分别加有6-BA、NAA、IAA和GA的5种初代培养基上培养,10 d左右,叶芽迅速膨大萌发新叶,大部分外植体可以完成启动生长。在初代培养过程中,萌发率和植株生长势是最为重要的指标;其次为是否具有伸长生长,便于继代培养的操作;再次为增殖系数大小,增殖系数大的外植体通过继代培养,可达到更好的增殖效果。综合可知,‘沙尼’品种初代培养基MS+6-BA 1.0 mg·L-1+IAA 0.5 mg·L-1(处理3)的增殖系数虽然不高(9.86),但其萌发率100%且具有最好的生长势,所以,最佳的初代培养基质应选处理3。IAA0.3 mg·L-1时,植株呈明显的团状生长,增殖系数较高,但茎不伸长;将生长素质量浓度增至IAA0.5 mg·L-1以及NAA0.10 mg·L-1时则茎伸长、增殖系数有所降低(表4),因此,可在此范围内调整生长素质量浓度,可以得到较快伸长生长、增殖率高的愈伤组织。
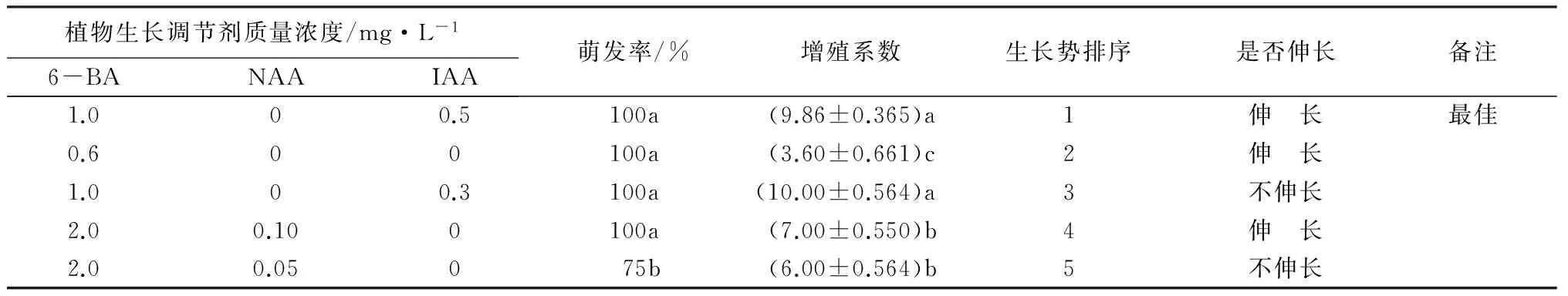
表4 初代培养不同激素处理效果比较
注:表中增殖系数为平均值±标准差;同列不同小写字母表示差异显著(P<0.05)。
2.4 继代培养体系的建立
初代培养的健壮植株在无菌条件下剪成单芽茎段,将带芽茎段接种于分别加有6-BA、NAA、IAA和GA的5种继代培养基上培养,10d左右观察,继代单芽茎段产生一定的愈伤组织,继代培养的增殖系数为1.12~3.49(表5)。综合考虑植株的增殖系数、生长势发现,‘沙尼’的最佳继代培养基为MS+6-BA 0.5 mg·L-1+NAA 0.05 mg·L-1。
2.5 生根培养体系的建立
将经过初代和继代培养的壮苗接种(无菌条件)到分别加有NAA、IBA的1/2MS培养基中,经过40 d左右,大多数植株产生愈伤组织,并开始生根,60 d左右部分植株产生了主根和须根(健全的根系,表6)。健壮完整的根系是植株在苗圃炼苗时成活的重要基础;调查生根率、根数量、长度、粗细等根系的指标,不同种类激素对植株生根的影响不同,‘沙尼’表现最佳的为4号处理(生根率100%,最高,根数量和根长都较好),所以,最佳生根培养基为MS+IBA 1.0 mg·L-1。

表5 继代培养不同激素处理效果比较
注:表中增殖系数为平均值±标准差;同列不同小写字母表示差异显著(P<0.05)。

表6 生根培养不同激素处理效果比较
注:同列不同小写字母表示差异显著(P<0.05)。
3 结论与讨论
选择树莓优良品种‘沙尼’作为试验材料,初步对树莓的组织培养技术进行了研究,以期能为树莓的扩繁体系提供一定的技术支撑。
最佳外植体的选择:以带芽茎段、茎尖两种外植体类型进行初代培养,结果表明,树莓进行组织培养的最佳外植体类型为带芽茎段,该结论与其他类似的研究基本一致[2-3]。本试验没有研究‘沙尼’品种单个腋芽的组织培养是否高于带芽茎段,树莓腋芽的组织培养需要做进一步的研究[16]。最佳外植体的最佳取材时间为5月份,该结论与其他类似的研究中4—5月份为最佳取材时间基本一致[2,6],还需要进一步对组织分化程度和物候差异等因素进行研究。
最佳灭菌体系的建立:以带芽茎段为外植体的初代培养,最佳的灭菌条件为2% NaClO-20 min,低于3% NaClO-15 min的4.5%的污染率。仅采用‘沙尼’为材料,试验结果的代表性还不够,与同类试验的灭菌体系0.5% NaClO-20 min不同[3,11],这可能是品种、所取材料的发育程度等造成的,还需要做进一步的研究。
初代培养体系的建立:试验设计未采用正交试验设计[14],而是通过总结已有研究中的结论,对比出最优的不同激素组合及质量浓度[15]。随着生长素类激素质量浓度的增加,对接种的植株的伸长促进作用明显,但是同时会降低植株的增殖情况,接种试验说明,生长素类激素的使用对外植体愈伤组织的发育影响较大,一般使用范围为IAA0.3~0.5 mg·L-1,NAA0.05~0.10 mg·L-1。
继代培养体系的建立:与初代培养一样,继代培养的试验设计也注重不同种类激素组合的不同效果比较,试验处理是已有研究中证实为最优的激素质量浓度[15],试验结果与相关研究有一定差异[6,8-9],可能是由于试验品种不同造成的差异。通过试验可知,6-BA、NAA的组合往往比加其他激素(如GA、IAA)的效果好,无论是生长素IAA还是赤霉素GA促进植株伸长生长的作用都不明显,反而在一定程度上降低了增殖效果。‘沙尼’在细胞分裂素和生长素水平都最低时具有最高的增殖效果和最佳的生长状况,说明‘沙尼’这一品种可以较快适应低水平质量浓度激素;在试验的过程中还发现,‘沙尼’在初代培养、继代培养中可自行进行生根,说明该品种植株体内激素的自我调节能力很强。
生根培养体系的建立:生根培养在试验设计时也总结了已有的研究成果,‘沙尼’的生根培养的最优处理与和加卫等[5]的结果一致,但与部分研究中指出的最佳处理1、3、5号(表3)的不一致[6-8,10],这可能与品种、外植体材料的发育程度不同有关。‘沙尼’使用IBA进行生根培养的效果优于NAA,而仅用NAA与使用NAA+IBA组合的生根作用大体相似,因此,仅使用IBA进行生根不仅节约时间成本,更提高了生根率,促进形成完整健壮的根系。
[1] 张清华,董凤祥.树莓发展现状与前景(上)[J].林业实用技术,2007(11):9-11.
[2] 王岳英.树莓组织培养最佳外植体材料试验[J].山西林业科技,2009,38(2):12-13,30.
[3] 任爱.树莓组织培养技术体系研究[J].山西林业科技,2008,13(1):12-13.
[4] 毕海林,徐中志,和加卫,等.野生树莓组织培养技术研究[J].中国野生植物资源,2007,26(2):68-69.
[5] 和加卫,徐中志,唐开学,等.树莓组织培养与快速繁殖技术研究[J].西南农业学报,2006,19(4):754-756.
[6] 曹慧,薛佳桢,孙京波.树莓组织培养技术的研究[J].北方园艺,2010(22):125-127.
[7] 潘菊,杨双.双季树莓的组织培养及快速繁殖[J].北方园艺,2012(21):105-106.
[8] 袁艺,李纯,张扬,等.树莓组织培养及植株再生[J].激光生物学报,2007,16(3):334-337.
[9] 朴日子,曹后男,陈艳秋,等.无刺红树莓组织培养快速繁殖技术研究[J].吉林农业大学学报,2006,28(4):411-414.
[10] 郭修武,娄汉平.树莓组织培养研究[J].中国果树,2008(6):21-23.
[11] 王禹.树莓初代培养研究[J].黑龙江农业科学,2012(5):85-87.
[12] 巩振辉,申书兴.植物组织培养[M].北京:化学工业出版社,2007:65-68.
[13] 安伟.树莓叶片离体再生及植酸酶基因转化的研究[D].长春:吉林大学,2002:1-30.
[14] 张雅文,肖蓉萍,任建军,等.树莓生根培养的正交试验设计分析[J].河南科学,2004,22(1):70-72.
[15] 霍朗宁,张东升,贾忠奎.树苺组织培养繁育体系研究[J].林产工业,2013,40(1):55-58.
[16] 董丽芬, 张晓英, 张宗勤,等.树莓的组织培养技术[J].西北林学院学报,2003,18(2):42-43.
[17] 包振华,郭军战,周玮,等.枸杞组织培养再生体系优化[J].西北林学院学报,2010,25(5):73-76.
Tissue Culture for Orus of Raspberry (RubusideausL.) Cultivar
Huo Langning(Key Laboratory for Silviculture and Conservation of Ministry of Education, Beijing Forestry University, Beijing 100083, P. R. China); Zhang Dongsheng(State Forestry Administration); Jia Zhongkui(Key Laboratory for Silviculture and Conservation of Ministry of Education, Beijing Forestry University)/Journal of Northeast Forestry University,2015,43(3):6-9.
Raspberry; Shawnee; Tissue culture
霍朗宁,女,1991年12月生,省部共建森林培育与保护教育部重点实验室(北京林业大学),硕士研究生。E-mail:254516267@qq.com。
贾忠奎,省部共建森林培育与保护教育部重点实验室(北京林业大学),副教授。E-mail:jiazk@bjfu.edu.cn。
2014年10月28日。
S663.2; Q943.1
1)新疆维吾尔自治区科技计划项目(201231108)、北京林业大学大学生创新创业训练项目(120104)。
责任编辑:任 俐。
