γH2AX 与男性不育患者精子DNA损伤的关系及意义*
2015-03-05钟慧芝吕福通谢丹尼林发全
钟慧芝,吕福通,谢丹尼,莫 毅,林发全△
(1.广西医科大学第一附属医院检验科,南宁530021;2.广西壮族自治区人口和计划生育研究中心,南宁530021)
男性精子遗传物质的完整性对于自然受孕及其胚胎的正常发育起着重要作用。精子DNA 损伤过高与不明原因的反复流产有关,而且还会增加子代患不育症的风险[1]。男性不育患者精子DNA 损伤程度比健康男性的更为显著[2]。为此,人类精子DNA 损伤机制及其不良影响成为生殖医学领域关注的热点问题之一;并且在辅助生殖治疗过程中,男性不育患者精子DNA 损伤程度已被作为一项重要参考指标纳入治疗前精子质量评价及对患者生育能力进行预测[3]。目前,国内外的临床研究主要应用以下几种方法检测精子DNA 损伤,如单向凝胶电泳(single cell gel electropherosis,SCGE)实验、末端标记检测(TUNEL assay)、精子染色质结构分析(SCSA)和染色质扩散试验(SCD)等。然而,在临床和科研过程中,对此尚缺乏规范和统一的检测方法和标准,并且相关研究结论亦存在分歧。因此,有必要寻找一种新的标志物对精子DNA 损伤进行检测,建立一套准确评价精子DNA 损伤程度的标准。
γH2AX 是由组蛋白H2A 家族中H2AX 磷酸化所形成。有研究发现,当细胞的DNA 受到损伤时,尤其是DNA 双链断裂(DSBs)损伤后,在DSBs位点会出现γH2AX 形成的“焦点”结构,执行DNA 损伤的感受或修复功能。另外,人们发现γH2AX 焦点的形成没有细胞特异性,无论何种因素诱导产生的DSBs都会伴随有H2AX 的磷酸化,并且γH2AX 形成焦点的数量及损伤引起的DSBs数量基本上是1∶1的关系。这表明γH2AX 可作为DNA 损伤的标志,是目前检测体细胞DNA损伤,特别是DSBs的一个新的特异性指标[4-5]。然而,γH2AX在男性不育患者精子的检测及与DSBs的相关研究较少。因此,本研究运用SCGE、流式细胞术等方法对健康男性、男性不育患者的精子DSBs损伤程度和γH2AX 含量进行测定和比较,并通过PureSperm 密度梯度离心法(DGC)对精子进行优选,再次检测2个指标的前后变化,旨在探讨γH2AX 用于评价男性不育患者精子DNA DSBs损伤程度的可行性,为辅助生殖技术进一步获得良好结局提供理论依据。
1 资料与方法
1.1 一般资料 本研究选取2012年11月至2013年1月就诊于广西医科大学第一附属医院生殖医学研究中心、男性科门诊确诊为男性不育患者27例精液样本作为病例组研究对象设为男性不育组,另外选取23例确认有生育能力的健康志愿者的精液样本作为对照组。本研究的男性不育的纳入标准:(1)男性不育患者均在未避孕、排除女方原因的条件下婚后2年未怀孕;(2)患者性激素检测正常;(3)患者在过去的3个月内未进行药物或手术治疗;(4)精液量大于2mL,精子密度大于20×106,精子活率大于20%,且抗精子抗体检查阴性。所有研究对象在采集精液标本之前均禁欲3~7d;以手淫法收集精液并用洁净无菌试管收集,立即放入37 ℃水浴箱内使其自然液化。
1.2 主要试剂(盒)与仪器 40%puresperm 液、80%puresperm 液、Puresperm wash 液(Nidacon Internal AB 公 司),鼠抗人FITC anti-H2AX-Phosphorylated(Ser139)、兔抗鼠FITC anti-H2AX-Phosphorylated同型对照(美国BioLegend公司),蛋白酶K、多聚甲醛(美国Sigma-Aldrich公司),正常熔点琼脂糖、低熔点琼脂糖(西班牙Biosharp公司),盐酸(廉江市爱廉化工试剂有限公司)、二甲基亚砜(DMSO)、氯化钠、硼酸、NaOH(天津市博迪化工有限公司),二(羟甲基)氨基甲烷(Tris-Base)、Triton-X 100(广州威佳科技有限公司),精液分析仪,AX70Olympus荧光显微镜,BD 流式细胞仪器(美国BD FACSC cantoTM Ⅱ),水平电泳槽。
1.3 精子γH2AX 的检测 先将已经液化的精液混匀,以PBS缓冲液将精子浓度调整至(5×106~1×107)/mL 后,用4%的多聚甲醛固定15min。再用PBS缓冲液,300×g离心精子5min,去除上清液留下底部沉淀物。随后加入0.5%的Triton-X 100,吹散并混匀沉淀物,破膜15min。再次加入适量的PBS缓冲液,以300×g的离心力离心破膜后的精子5min,去除上清液留下底部沉淀物。再加入PBS缓冲液,300×g离心精子5 min,去除上清液。再向标本中加入20μL 鼠抗人γH2AX 单克隆抗体,用加样枪轻轻吹打混匀,室温避光孵育30min。用PBS缓冲液洗涤2次并且要在避光条件下处理,最后上流式细胞仪进行检测。同型对照的处理除所加抗体不同(加入的抗体为兔抗鼠γH2AX 单克隆抗体)外,其余处理步骤同上。
1.4 SCGE实验
1.4.1 制做凝胶玻片 先将代用样本混匀,将精子浓度调整至1×107/mL。吸取100μL 0.65%正常熔点琼脂糖平铺于预先处理好的载玻片上,并快速地盖上盖玻片,置于4 ℃环境中10min,使琼脂糖充分凝固。再将预先配好的0.65%低熔点琼脂糖进行熔解,待其完全熔解后,放在室温下使其温度稍稍下降后吸取75μL 琼脂糖液与15μL 预先调配好浓度的精子混匀。在第1层琼脂糖凝胶均匀地铺上调配好的精子琼脂糖混合液,置于4 ℃环境中10min,使琼脂糖充分凝固。最后待第2层琼脂糖凝胶完全凝固后,再铺上75μL 0.65%低熔点琼脂糖,置于4 ℃环境中10min,使琼脂糖充分凝固。
1.4.2 凝胶玻片的裂解与电泳 将制好的琼脂糖凝胶玻片放入预先配好的中性裂解液中,在4℃环境中裂解2h,将琼脂糖凝胶玻片从中性裂解液中取出,先浸泡在PBS液30s,此步骤重复3次,再将琼脂糖凝胶玻片放入裂解液2中,将其放入37℃水浴箱内继续裂解15h,将裂解好的琼脂糖凝胶玻片再用PBS液浸泡30s,再放入盛有TBE 电泳液的电泳槽中平衡20 min,然后在15V、100mA 的电场下电泳60min,并在4 ℃和避光环境中进行。将电泳好的琼脂糖凝胶玻片放入中和液中进行中和。将中和好的琼脂糖凝胶玻片进行溴化乙锭(EB)染色,EB稀释比例为1∶2 000,吸取调配好的EB液20μL,均匀地铺在琼脂糖凝胶玻片上等待20s,吸去多余的EB,将染好EB的琼脂糖凝胶玻片置于荧光显微镜下观察。
1.5 puresperm 密度梯度离心优选精子 吸取80% puresperm 液1.5 mL 移至无菌锥形离心管底部,再吸取40%puresperm 液1.5mL,轻轻加至80%puresperm 液上,使2种不同浓度的puresperm 液出现清晰的分界面。再将1.0mL精液标本轻轻加至40% puresperm 液上,使精液与40% puresperm 液也出现清晰的分界面。用350×g离心20 min,保留沉淀物及4~6mm 高的80%puresperm 液。再用puresperm wash液对标本进行洗涤,以350×g离心10 min。吸去上清液,留取沉淀,再向沉淀物中加入少许puresperm wash液,混匀放置37 ℃水浴箱保温。
1.6 统计学处理 采用SPSS 17.0软件对数据进行分析处理。计量资料以±s表示,两组比较,符合方差齐时用t检验分析,不符合时用秩和检验,计数资料比较用χ2检验,等级资料用秩和检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 优选前两组精液常规参数的比较 本实验运用CASA对两组精液进行精液常规分析,结果见表1。两组精液在年龄、精液液化时间、精液量等方面比较差异均无统计学意义(P>0.05),但在精子浓度、精子活率、前向运动精子百分率以及正常形态百分率上,对照组均高于男性不育组,差异有统计学意义(P<0.01)。
表1 优选前两组精液常规参数的比较(±s)

表1 优选前两组精液常规参数的比较(±s)
变量 对照组(n=23)男性不育组(n=27)P年龄(岁)30.83±4.02 32.74±4.39 0.094精液量(mL) 3.93±0.98 4.16±1.07 0.644浓度(×106/mL) 77.49±16.73 56.73±35.82 0.012精子活率(%) 56.73±9.71 45.30±11.89 0.002前向运动精子(%) 49.99±8.96 35.59±11.01 0.000精子正常形态率(%)27.82±2.97 15.26±1.87 0.000
2.2 两组精液γH2AX 百分含量的测定结果比较 通过流式细胞仪对两组优选前精液进行γH2AX 含量的测定,结果显示男性不育组精子中表达的γH2AX 为(23.87±4.34)%,明显高于对照组的(13.8±2.88)%,差异有统计学意义(P<0.01)。如图1所示,“门”左侧为阴性表达精子γH2AX,“门”右侧为阳性表达精子γH2AX。
2.3 两组精液单向凝胶电泳实验的结果比较 SCGE 也称彗星实验,临床上常用碱性彗星实验检测DSBs。彗星实验指标有多种,其中尾部DNA 百分含量是公认的能够反映DNA 损伤程度的可靠指标,通过Casp软件可直接计算出彗尾中DNA百分含量。根据彗星尾部DNA 百分含量可将精子细胞核DNA 损伤程度分为5个等级,见图2(本研究无4级精子损伤,故无4级精子损伤图片)。0级:<5%,为无损伤精子,精子核完整;1级:5%~20%,为轻度损伤精子,可见彗尾,精子核缩小;2级:21%~40%,中度损伤精子,可见明显慧尾,精子核缩小;3级:41%~95%,重度损伤精子,彗尾荧光信号强而密,并见明显缩小的精子核;4级:>95%,完全损伤的精子,仅见强而密的荧光彗尾,精子核基本消失。通过Casp软件对两组优选前精液精子彗星图像进行观察和分析,结果显示,对照组中无DNA 损伤的精子为1 835个,轻度损伤的精子为390个,中度损伤为75个,未发现DNA 重度损伤及完全损伤精子;男性不育组无DNA 损伤的精子为1 825个,轻度损伤的精子为719个,中度损伤为132个,重度损伤为24个,未发现DNA 完全损伤精子。两组精子DNA 双链损伤程度进行统计分析,结果显示对照组精子DNA 双链损伤程度显著低于男性不育组,差异有统计学意义(P<0.01),见表2。

图1 γH2AX 的流式细胞示意图
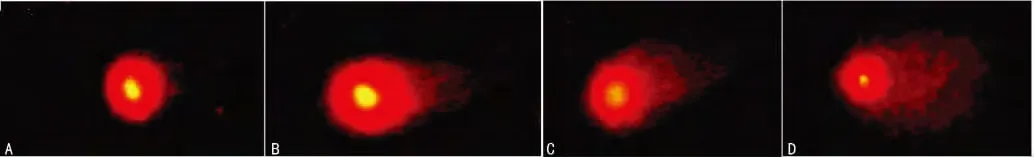
图2 精子细胞核DNA 损伤程度等级图(×400)
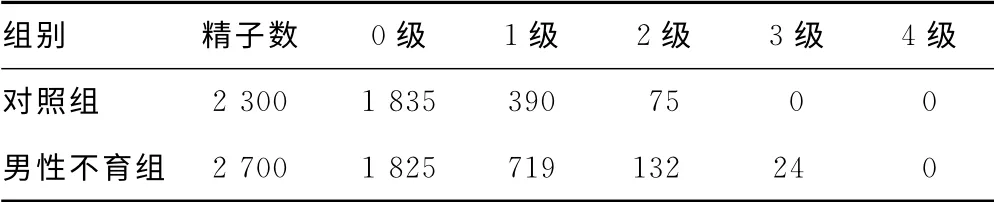
表2 两组精子DNA 双链损伤程度比较(个)
2.4 经密度梯度离心法优选后两组精液γH2AX 百分含量和单向凝胶电泳结果比较 对两组优选后的精液进行精子γH2AX 含量的测定,并与优选前各组精液的精子γH2AX 含量进行比较。结果显示,优选后两组精子的γH2AX 含量与优选前各组精液的精子γH2AX 含量比较均显著降低,差异有统计学意义(P<0.01),见表3、图3。通过观察单向凝胶电泳结果,经过puresperm DGC 优选后的两组精液,其彗尾中DNA的百分含量与优选前各组精液比较均显著减少,见图3;优选后的两组精液的精子DNA 双链损伤百分率均减少,与各组优选前的单向凝胶电泳结果比较,差异有统计学意义(P<0.01),见表4、图4。

图3 精液优选前、后γH2AX 百分含量的比较
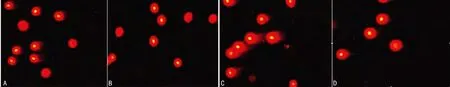
图4 精液优选前、后精子细胞核DNA 损伤程度比较图(×400)
表3 两组精液优选前、后精子γH2AX 百分 含量的比较(±s,%)

表3 两组精液优选前、后精子γH2AX 百分 含量的比较(±s,%)
组别 n 优选前 优选后P 23 13.80±2.88 8.77±2.28 0.000男性不育组对照组27 23.87±4.34 14.98±2.02 0.000

表4 两组精液优选前、后DNA 损伤百分率比较(个)
3 讨 论
众所周知,高质量的精子与卵子是受孕成功的重要因素。但在通常情况下,男性不育患者的精子质量比健康男性的精子质量低下,使得夫妇双方不能通过正常的性行为使女方自然怀孕。国内外大量的临床试验研究证实,男性不育患者的精子密度、精子活率、前向运动精子百分率、精子正常形态百分率以及线粒体膜电位(mitochondrial membrane potential,MMP)都显著低于健康男性[6]。本研究也得出类似结果。
造成男性不育的因素很多,而精子DNA 损伤是其中一个重要因素。已有大量研究表明精子DNA 损伤程度与受孕率及其胚胎质量呈负相关[7-11]。此外,有研究表明使用有DNA损伤精子进行辅助生殖技术将会增加子代患不育症的可能性以及某些遗传方面的疾病,并且男性不育患者精液中精子DNA 损伤比例显著高于健康男性[12-13]。因此,本实验选择男性不育患者精子进行DSBs的检测。γH2AX 焦点检测方法已开始用于检测各种化学、物理等因素所诱导的体细胞DSBs[14]。研究发现在人类精子细胞DNA 损伤过程中同样伴随γH2AX 的出现,并且γH2AX 水平与生殖毒性物质H2O2或者阿霉素之间呈现明显的剂量-时间效应,认为γH2AX 焦点可以作为生殖毒性物质引发精子DNA 损伤的特异、敏感指标。本研究运用流式细胞仪对健康男性和男性不育患者的精子进行γH2AX 含量测定,观察两组的γH2AX 含量是否有差异,同时运用密度梯度离心法和单向凝胶电泳对两组精液的精子进行优选和DNA 双链损伤程度的检测,用于验证γH2AX的出现与精子DNA 双链损伤有关。研究结果显示,健康男性中精子γH2AX 的表达含量显著低于男性不育患者,差异有统计学意义(P<0.01)。运用碱性SCGE检测精子DNA 双链损伤程度,结果也显示健康男性精液中DNA 损伤精子程度显著低于男性不育患者。通过密度梯度离心法对两组精子进行优选,两组精子的DNA 双链损伤的精子显著减低,与优选前比较差异有统计学意义。这一结果与国内外有关精子优选研究结果相似。国内外研究显示,经过密度梯度离心法优选后的精子能有效去除DNA 损伤的精子[15]。与单向凝胶电泳实验相类似,两组精子在经过密度梯度离心法优选后,γH2AX 表达的精子也显著减低,且与优选前比较差异有统计学意义。这一结果说明密度梯度离心法能有效去除γH2AX 表达的精子。
密度梯度离心法优选精子的原理是利用在离心时,活力好的精子能更好地沿沉淀梯度的方向运动,迅速穿越不同密度的液体界面,从而自行与死精子、凝集精子、白细胞以及杂质分离,达到优选精子的目的。有研究表明精子DNA 损伤程度与精子前向运动呈负相关。当有DNA 双链损伤时,DNA 断裂处便会有γH2AX 焦点的表达。因此,运用密度梯度心离法可以有效地去除DNA 损伤的精子以及γH2AX 表达的精子;但是,该优选方法仍然存在不足之处,它未能有效地去除早期γH2AX 表达的精子,因为当精子出现早期DNA 损伤时,精子的活力及前向性运动很可能在正常范围,这样就有可能不能有效地去除早期γH2AX 表达的精子。因此,寻找出一种新的优选方法筛选出早期DNA 损伤的精子,仍是生殖医学领域关注的热点问题之一。
在临床上,SCGE已经广泛用于检测各种细胞的DNA 损伤,但是,存在耗时较长、操作繁琐、温度控制较为严格等缺点,在操作过程中还很容易造成DNA 的再次损伤,因此,操作要格外小心。相比于运用流式细胞仪测定γH2AX 用于检测DNA 损伤,其耗时短、操作简便、结果客观、易于观察,同时运用抗原抗体结合原理,增加了检测DNA 损伤的灵敏度和准确度,并且在细胞双链DNA 断裂早期即可出现γH2AX,使得有双链DNA 断裂的细胞能在早期被检测出来。
[1] Zini A,Sigman M.Are tests of sperm DNA damage clinically useful Pros and cons[J].J Androl,2009,30(3):219-229.
[2] Varghese AC,Bragais FM,Mukhopadhyay D,et al.Human sperm DNA integrity in normal and abnormal semen samples and its correlation with sperm characteristics[J].Andrologia,2009,41(4):207-215.
[3] Shamsi MB,Kumar R,Dada R.Evaluation of nuclear DNA damage in human spermatozoa in men opting for assisted reproduction[J].Indian J Med Res,2008,127(2):115-123.
[4] Sharma A,Singh K,Almasan A.Histone H2AX phosphorylation:a marker for DNA damage[J].Methods Mol Biol,2012,920:613-626.
[5] Tanaka T,Halicka D,Traganos F,et al.Cytometric analysis of DNA damage:phosphorylation of histone H2AX as a marker of DNA double-strand breaks(DSBs)[J].Methods Mol Biol,2009,523:161-168.
[6] Barroso G,Taylor S,Morshedi M,et al.Mitochondrial membrane potential integrity and plasma membrane translocation of phosphatidylserine as early apoptotic markers:a comparison of two different sperm subpopulations[J].Fertil Steril,2006,85(1):149-154.
[7] Nunez-Calonge R,Caballero P,López-Fernández C,et al.An improved experimental model for understanding the impact of sperm DNA fragmentation on human pregnancy following ICSI[J].Reprod Sci,2012,19(11):1163-1168.
[8] Lewis SE,Simon L.Clinical implications of sperm DNA damage[J].Hum Fertil(Camb),2010,13(4):201-207.
[9] Simon L,Brunborg G,Stevenson M,et al.Clinical significance of sperm DNA damage in assisted reproduction outcome[J].Hum Reprod,2010,25(7):1594-1608.
[10] Avendano C,Franchi A,Duran H,et al. DNA fragmentation of normal spermatozoa negatively impacts embryo quality and intracytoplasmic sperm injection outcome[J].Fertil Steril,2010,94(2):549-557.
[11] Rawe VY,Boudri HU,Alvarez Sedo C,et al.Healthy baby born after reduction of sperm DNA fragmentation using cell sorting before ICSI[J].Reprod Biomed Online,2010,20(3):320-323.
[12] Nili HA,Mozdarani H,Aleyasin A.Correlation of sperm DNA damage with protamine deficiency in Iranian subfertile men[J].Reprod Biomed Online,2009,18(4):479-485.
[13] Erenpreiss J,Elzanaty S,Giwercman A.Sperm DNA damage in men from infertile couples[J].Asian J Androl,2008,10(5):786-790.
[14] Smart DJ,Ahmedi KP,Harvey JS,et al.Genotoxicity screening via the gammaH2AX by flow assay[J].Mutat Res,2011,715(1-2):25-31.
[15] Tavalaee M,Deemeh MR,Arbabian M,et al.Density gradient centrifugation before or after magnetic-activated cell sorting:which technique is more useful for clinical sperm selection[J].J Assist Reprod Genet,2012,29(1):31-38.
