响应面优化襄荷总黄酮提取及抗氧化研究
2015-02-21魏和平王天华
许 远,魏和平,吴 彦,王天华
(安庆师范学院生命科学学院,安徽安庆246011)
襄荷(Zingiber strioatum),又名阳荷、洋姜、莲花姜、洋胡姜等,属于姜科姜属多年生草本植物,我国长江流域各省均有野生资源分布,在很多地区,民间也有种植和食用襄荷的习惯。据《中药大辞典》和《全国蔬菜全科》记载,襄荷具有很高的食用价值和药用成分,其富含蛋白质、氨基酸、维生素、糖类、有机酸及矿物元素等,具有活血调经、镇咳祛痰、消肿解毒等功效[1]。另外,襄荷具有特殊芳香气味,驱虫效果明显,病虫害很少,极少使用农药,是理想的绿色食品。因此,襄荷已成为一种新型保健蔬菜,亟待开发。
目前我国对襄荷的研究多集中在栽培[2]、组织培养[3]、快速繁殖[4]和食用资源[1]等方面,对其生物活性方面的研究甚少。黄酮类化合物是广泛存在于植物中的次生代谢产物[5],具有抗自由基和抗氧化作用,还有抗癌、抗肿瘤、降血脂、治疗心脑血管疾病、镇痛等药用保健功能[6],因此,总黄酮含量已成为保健蔬菜的衡量参数之一。本文通过超声波辅助乙醇提取法对襄荷可食用的花苞部分进行了总黄酮测定,并采取响应面分析方法对其提取工艺进行优化,同时对其提取物的抗氧化性进行研究,旨在为提高襄荷利用价值和进一步开发这种天然保健蔬菜提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜襄荷花苞,于2013年9月采自安徽省岳西县山区,储存于冰箱(0~4℃)备用。
芦丁标准品(>98%),合肥博美生物科技有限责任公司;DPPH(1,1-二苯基-2-三硝基苯肼)Sigma公司;无水乙醇、盐酸、亚硝酸钠、氢氧化钠、硝酸铝、抗坏血酸、Tris、邻苯三酚、三氯乙酸、水杨酸、硫酸亚铁、铁氰化钾、三氯化铁、磷酸氢二钠、磷酸二氢钠等均为分析纯。
FA2004B电子天平 上海越平科学仪器有限公司;DZ-2BCⅡ真空干燥箱 天津市泰斯特仪器有限公司;RE-2000旋转蒸发器 上海洪旋实验仪器有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;SY-360型台式数控超声波提取机 昆山市超声仪器有限公司;UV759紫外可见分光光度计 上海佑科仪器仪表有限公司;手提式多功能粉碎机 上海广沙工贸有限公司;HHS型电热恒温水浴锅 上海博迅实业有限公司医疗设备厂; SC-3612低速离心机 安徽中科中佳科学仪器有限公司。
1.2 实验方法
1.2.1 标准曲线绘制 采用亚硝酸钠-硝酸铝-氢氧化钠显色法[7],精密称取105℃真空干燥至恒重的芦丁标准品6mg,用70%乙醇溶解并定容至10m L,摇匀,得0.6mg/m L的芦丁标准液。准确吸取0.0、1.0、2.0、3.0、4.0、5.0m L上述标准液分别置于10m L的容量瓶中,加2~4m L蒸馏水,加0.4m L 5%亚硝酸钠,摇匀,放置6m in,加入0.4m L 10%硝酸铝,摇匀,放置6m in,加入4.0m L 4%氢氧化钠,再加蒸馏水至刻度、摇匀,放置15min,以空白试剂作对比参照,在510nm处测定吸光度,得标准曲线回归方程:A=3.8367C+0.3438(A为吸光度,C为芦丁浓度),R2=0.9978,表明了芦丁在浓度0~0.3mg/m L之内线性关系良好。
1.2.2 襄荷总黄酮得率测定 将新鲜襄荷花苞洗净、切碎、烘干,以粉碎机粉碎,过60目筛,制成襄荷粉。准确称取10.0g襄荷粉,加入一定量乙醇溶液,选择一定超声条件处理后,置70℃水浴中回流提取2h(预实验显示提取温度达到70℃和提取时间超过2h后,得率变化不大,故此二因素固定),取出,减压抽滤浓缩,测定滤液体积。取2m L上述滤液于10m L容量瓶中,以制备标准曲线的方法,在510nm处测定其吸光度,并利用标曲获得的回归方程计算襄荷总黄酮得率,重复三次,取平均值,计算公式如下:

式中:C为提取液中总黄酮浓度(mg/m L);V1为显色时定容体积(m L);V2为显色时取样体积(m L); V为提取液总体积(m);m为原料质量(g)。
1.2.3 单因素实验 以乙醇浓度、液料比、超声温度、超声时间四个因素为研究对象,以襄荷总黄酮得率为指标,进行单因素实验。
1.2.3.1 乙醇浓度对得率的影响 准确称取10.0g的襄荷粉5份,分别加入体积分数为50%、60%、70%、 80%、90%的乙醇溶液,以15∶1(m L∶g)的液料比(为溶剂体积(m L):物料质量(g),下同),在温度50℃条件下,超声处理15m in,之后在70℃水浴中回流提取2h。
1.2.3.2 液料比对得率的影响 准确称取10.0g的襄荷粉5份,分别以液料比10∶1、15∶1、20∶1、25∶1、30∶1(m L∶g)加入60%乙醇溶液,在温度50℃条件下,超声处理15m in后置70℃水浴中回流提取2h。
1.2.3.3 超声时间对得率的影响 准确称取10.0g的襄荷粉5份,以15∶1(m L∶g)的液料比加入体积分数为60%的乙醇溶液,在温度50℃条件下,分别超声处理10、15、20、25、30m in后置 70℃水浴中回流提取2h。
1.2.3.4 超声温度对得率的影响 准确称取10.0g的襄荷粉5份,以15∶1(m L∶g)的液料比加入体积分数为60%的乙醇溶液,分别在温度40、45、50、55、60℃条件下,超声处理15m in后置70℃水浴中回流提取2h。
1.2.4 响应面法对提取工艺参数的优化与验证 为分析各影响因素间的交互作用对襄荷总黄酮得率的影响,在单因素实验结果的基础之上,根据 Box-Benhnken中心组合实验设计原理,运用 Design Expert 8.0软件设计响应面实验,分别选择乙醇浓度(A)、液料比(B)、超声时间(C)、超声温度(D)作为自变量,以襄荷总黄酮的得率(R1)作为响应值设计响应面实验,因素水平取值见表1。

表1 响应面设计因素和水平Table1 Levels and factors of response surface analysis
1.2.5 襄荷总黄酮抗氧化性实验 在响应面实验结果得出的最佳提取条件下获得襄荷总黄酮提取液,进行总还原能力和对DPPH·、超氧阴离子(O2-·)、羟基自由基(·OH)三者的清除能力测定,分别将提取浓缩液配制成不同浓度梯度的待测溶液,均以抗坏血酸(VC)为对照,比较结果确定其抗氧化能力。
1.2.5.1 总还原能力的测定 测定方法参照文献[8],取2.5m L不同浓度待测液,加入2.5m L 0.2mol/L、pH6.6磷酸缓冲溶液及2.5m L 1%铁氰化钾,50℃水浴20m in后急速冷却,加入2.5m L 10%三氯乙酸溶液,于3000 r/min离心10m in,取上清液5m L,加4m L蒸馏水,及1m L 0.1%FeCl3,混匀后10m in于700nm处测定吸光值表示样品还原能力,以蒸馏水为空白。
1.2.5.2 DPPH·清除率的测定 测定方法参照文献[9-10],取4m L不同浓度待测液,加入4m L浓度为2 ×10-4mol/L的DPPH溶液,摇匀,室温下避光反应30m in,以无水乙醇作对照,于517nm波长处测定吸光度A。对照组以无水乙醇代替DPPH溶液,与待测液混匀,于517nm波长处测定吸光度A1,空白组以上述DPPH溶液与无水乙醇混合后于517nm波长处的吸光度A0。按下式计算其清除率:

式中:A为样品组吸光度值;A1为对照组吸光度值;A0为空白照组吸光度值。
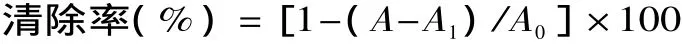
式中:A为样品组吸光度值;A1为对照组吸光度值;A0为空白照组吸光度值。
1.2.5.4 羟基自由基(·OH)清除率的测定 测定方法参照文献[12-13],取2m L不同浓度的待测液,置于10m L离心管中,分别加入1m L 9mmol/L的FeSO4溶液,2m L 9mmol/L的水杨酸-乙醇溶液,混匀,加入1m L 0.01%的H2O2溶液启动反应,于室温下反应1h,以蒸馏水调零,于510nm处测定吸光度A。对照组以蒸馏水代替H2O2溶液,于510nm处测定吸光度A1,空白组以蒸馏水代替待测液,于510nm处测定吸光度A0。按下式计算其清除率:

式中:A为样品组吸光度值;A1为对照组吸光度值;A0为空白照组吸光度值。
1.3 数据处理
采用Microsoft Excel(Office 2003)软件整理数据,Design Expert 8.0软件进行数据分析。
2 结果与分析
2.1 单因素实验结果
2.1.1 乙醇浓度的选择 由图1可以看出:随着乙醇浓度的升高总黄酮得率上升,达到70%后呈略下降趋势。根据相似相溶原理[14],溶剂与提取物极性达到相似时,提取物较易从植物细胞中溢出,黄酮类物质是弱极性化合物,易溶于弱极性溶剂,70%的乙醇溶液极性可能与襄荷黄酮的极性最为相似,故在此浓度下提取率最高。当乙醇浓度大于70%时,提取含量略呈下降,可能是随着乙醇浓度升高,其极性与提取物的极性相差逐渐增大,从而导致溶液对黄酮类化合物溶解度降低,同时一些醇溶性杂质、色素、亲脂性强的成分等溶出增多,也不利于黄酮类化合物提取,进而影响得率[15]。因此乙醇浓度选用70%为适宜。
2.1.2 液料比的选择 由图2可以看出:随着液料比的增加,襄荷中总黄酮得率不断增大,原因是随液料比的增大,浓度差提高,有利于传质,提取越来越充分,但当液料比大于20∶1时曲线略有下降并逐渐平稳,原因可能是当提取溶剂量太大时,黄酮的溶出已基本达到平衡,再增加溶剂量,提取效果并不能明显提高,同时由于溶剂体积的增大,使得一些非黄酮类的化合物溶解度增大,与黄酮类化合物形成了一定的竞争关系,从而导致提取含量减少。因此液料比选用20∶1为适宜。

图1 乙醇浓度对总黄酮得率的影响Fig.1 Effect of ethanol concentration on extraction rate of total flavonoids

图2 液料比对总黄酮得率的影响Fig.2 Effect of liquid-solid ratio on extraction rate of total flavonoids
2.1.3 超声时间的选择 由图3可以看出:随着超声波作用时间的增加,襄荷总黄酮的得率升高;但当时间大于20m in后总黄酮得率趋于平稳且略有下降。可能是超声时间太长,会破坏黄酮类化合物的有效结构,使其降解,所以得率反而下降。所以超声时间选用20min为宜。

图3 超声时间对总黄酮得率的影响Fig.3 Effect of ultrasonic time on extraction rate of total flavonoids
2.1.4 超声温度的选择 由图4可以看出:随着超声温度的升高总黄酮得率呈上升趋势,达到50℃后呈下降趋势。温度升高到一定程度可能会破坏样品中黄酮类物质的结构造成样品中黄酮类物质的损失,并且会导致提取液的大量挥发。因而超声温度选用50℃为宜。

图4 超声温度对总黄酮得率的影响Fig.4 Effect of ultrasonic temperature on extraction rate of total flavonoids
2.2 响应面法确定襄荷总黄酮的最佳提取条件
2.2.1 响应面法实验设计及结果 选择乙醇浓度(A)、液料比(B)、超声时间(C)及超声温度(D)作为自变量,以襄荷总黄酮的得率(R1)作为响应值设计响应面实验,结果见表2。

表2 响应面实验结果Table2 Result of response surface design
利用Design Expert8.0软件对表2的数据进行多元回归分析,拟合后得到A、B、C、D的二次多项回归模型为:(公式)

对上述方程进行方差分析,结果如表3所示。
结果显示,模型显著性检验p值<0.0001,为极显著,失拟项p值为0.3181>0.05,不显著,无失拟因素存在。该回归方程相关系数R2=0.9990,校正决定系数R=0.9979,说明该模型能够解释99.90%的变化,因变量与所选自变量之间线性关系显著。以上证明该模型与实验拟合度良好,可用该回归方程代替真实实验对实验结果进行预测和分析。
模型的一次项A、B、C、D为极显著;二次项A2、B2、C2、D2为极显著;交互项AB、AC、BD为极显著,AD、CD为显著,BC不显著,由此可知,自变量与响应值之间不是简单的线性关系。通过F值可知,各单因素对襄荷总黄酮得率的影响程度依次为:液料比>超声温度>乙醇浓度>超声时间;各两因素交互作用对襄荷总黄酮得率的影响程度依次为:液料比和乙醇浓度>乙醇浓度和超声时间=液料比和超声温度>乙醇浓度和超声温度>超声时间和超声温度>液料比和超声时间。
2.2.2 响应面分析 图5是按所得数学模型绘制的响应曲面图,各因素的交互作用效应可以从响应曲面的坡度变化及其等高线得到反映。响应面曲面的坡度直接反映了在处理条件下发生变化时襄荷总黄酮得率的响应灵敏程度,如坡度相对平缓,响应值不敏感;反之,如坡度相对陡峭,响应值敏感。响应值随哪种因素的变化率更大,说明此因素在二者交互作用中对襄荷总黄酮得率的影响更大。等高线为椭圆形,说明两因素交互作用显著,若偏圆形,说明不太显著。
例如,从图5a可知,其等高线为椭圆形,说明乙醇浓度和液料比交互作用显著;响应面坡度较为陡峭,响应值随液料比的变化率大于乙醇浓度的变化率,说明在二者交互作用中液料比对总黄酮得率影响大于超声时间。而从图5d可知,其等高线偏圆形,说明液料比和超声时间交互作用不太显著;响应面坡度相对平缓,响应值随液料比的变化率大于超声时间的变化率,说明在二者交互作用中液料比对总黄酮得率影响大于超声时间。综合所有响应面图分析,液料比和乙醇浓度的交互作用最显著,乙醇浓度和超声时间、液料比和超声温度次之,乙醇浓度和超声温度、超声时间和超声温度再次,液料比和超声时间最不显著,其中液料比和超声温度较之乙醇浓度和超声时间对响应值的影响更大,此结果与模型中F值分析结果一致。
2.2.3 条件优化 根据响应面分析表明:最佳提取工艺理论值是乙醇浓度70.53%,液料比20.98∶1
(m L∶g),超声时间20.61m in,超声温度50.56℃。考虑到实际操作的便利,将襄荷中总黄酮提取的最佳工艺条件修正为:乙醇浓度 71%,液料比 21∶1 (m L:g),超声时间21m in,超声温度51℃。按照修正后的条件下进行3次验证实验,结果如表4所示,襄荷总黄酮得率实验值为4.50%,与预测值4.51%接近,表明实验结果理想,实验模型选择合理。

表3 回归模型方差分析Table3 Variance analysis of regression model

图5 各因素对总黄酮得率影响的响应面分析Fig.5 Responsive surface plot for the effect of factors

表4 实验验证响应面优化条件Table4 Conformation results of the optimized extraction conditions
2.3 抗氧化实验的结果分析
2.3.1 总还原能力实验结果 如图6所示,襄荷总黄酮样品的还原能力随浓度的增大不断增强,且增幅逐渐增大,不断接近VC还原能力,可见其具有非常强的还原力。

图6 样品与VC还原能力比较Fig.6 Comparison of reducing power on sample with Vitamin C
2.3.2 清除 DPPH·实验结果 如图7所示,VC清除DPPH·能力随浓度上升而增大,当浓度为15μg/m L时,清除率已达到94.63%,继续增大浓度后清除率无显著变化,襄荷总黄酮样品对DPPH·的清除能力随浓度的增大呈明显增长趋势,可见其对DPPH·有较强的清除能力。

图7 样品与VC清除DPPH·能力比较Fig.7 Comparison of DPPH·radical scavenging activity on sample with Vitamin C

图8 样品与VC清除超氧阴离子(O·)能力比较Fig.8 Comparison of superoxide radical scavenging activity on sample with Vitamin C
2.3.4 清除羟基自由基(·OH)实验结果 如图9所示,VC在0.3mg/m L到0.7mg/m L的浓度范围内,对羟基自由基(·OH)始终保持很高的清除能力,清除率几乎达到100%,襄荷黄酮样品在低浓度时对羟基自由基(·OH)的清除能力与VC相差较多,但随着浓度的上升,其清除能力显著增强,在浓度为0.7mg/m L时清除率达到92.1%,表明其对羟基自由基(·OH)有较强的清除能力。

图9 样品与VC清除羟基自由基(·OH)能力比较Fig.9 Comparison of hydroxyl radical scavenging activity on sample with Vitamin C
3 结论与讨论
乙醇是提取黄酮的优良有机溶剂之一[16],超声波的空化作用可充分破坏植物细胞,加速胞内物质释放溶解,增大提取效率[17-18]。如许效群等在提取苦荞米糠总黄酮研究中发现,超声波辅助提取率较之水浴法提取率大大提高[16],蒋少华等在洋葱皮中类黄酮不同提取工艺的比较研究结果显示,超声波法较之回流法可加速和提高黄酮提取率,较之微波提取法对设备的要求更为简单[19]。此外,利用响应面分析方法进行最佳工艺条件优化,可克服传统正交实验只能给出最佳因素水平组合而无法找出整个区域上因素的最佳组合和最优值的缺陷[20],许多学者均使用响应面法优化植物有效成分的提取工艺得到了较为准确的工艺参数[21-23],如常丽新等利用响应面法优化了玉米芯黄酮的提取工艺[22]。故本文采用超声波辅助乙醇提取法提取襄荷总黄酮,根据中心组合设计原理,采用4因素3水平的响应面分析,得出了襄荷总黄酮的最佳提取工艺条件:乙醇浓度为71%,液料比为21∶1(m L∶g),超声时间为21min,超声温度为51℃。在最佳提取工艺条件下测得襄荷花苞总黄酮含量为4.50%。大量研究发现,黄酮含量高的蔬菜,具有预防心脑血管疾病、抗衰老、抗氧化、增强细胞免疫力和预防肿瘤等功效[24],本研究抗氧化实验也证明,襄荷总黄酮具有很好的还原能力,对DPPH·和羟基自由基(·OH)具有较强的清除能力,对于超氧阴离子(O·)也具有一定的清除能力,抗氧化效果总体表现良好。因此,襄荷可作为新型保健蔬菜进行深度开发。
[1]高学玲.襄荷的营养成分分析和综合开发利用研究[J].食品科学,2001,22(3):58-60.
[2]薛小红,金银京,方溥强.襄荷的栽培技术[J].中国中药杂志,1992,17(9):529.
[3]石拥军,李进,顾绘,等.襄荷脱毒组培苗培养技术[J].江苏农业科学,2006(5):131-132.
[4]朱勤,杨徐琴,杨六萍,等.襄荷生物学特性和大棚种植技术[J].现代农业科技,2006(9):58-59.
[5]吴秋敏,苏平,刘芸.黄酮的抗氧化性和促氧化性[J].食品工业科技,2014,35(24):379-383.
[6]曹纬国,刘志勤,邵云,等.黄酮类化合物药理作用的研究进展[J].西北植物学报,2003,23(12):2241-2247.
[7]田建平,李娟玲,胡远艳.冬青属苦丁茶叶总黄酮含量测定与资源评价[J].食品科技,2014,39(1):278-281.
[8]莫开菊,柳圣,程超.生姜黄酮的抗氧化活性研究[J].食品科学,2006,27(9):110-115.
[9]Miller NJ,Rice-Evans C,Davies MJ,etal.A novelmethod for measuring antioxidant capacity and its application to monitoringthe antioxidant status in premature neonates[J].ClinSci,1993,84 (4):407-412.
[10]胡迎芬,胡博路,孟洁,等.月季花抗氧化作用的研究[J].食品工业科技,2000,21(4):25-27.
[11]贺文英,赵智宏,丁鹤,等.超声波提取苦豆籽粕中总黄酮及抗氧化性研究[J].食品工业,2014,35(7):130-133.
[12]程超,李伟.平菇水溶性多糖结构表征与体外抗氧化作用[J].食品科学,2005,26(8):55-57.
[13]丁利君,周圳辉,林燕如.芒萁中黄酮物质的提取及其抗氧化研究[J].食品科学,2005(8):77-81.
[14]Zhang Y,Li S F,Wu X W.Pressurized Liquid extraction of flavonoids from Houttuynia cordata thumb[J].Separation and Purification Technology,2008,58(3):305-310.
[15]汤须崇,叶静,徐伟,等.猫须草总黄酮的超声提取工艺[J].食品与发酵工业,2011,37(11):229-231.
[16]许效群,刘志芳,田夏,等.超声波辅助提取苦荞米糠总黄酮[J].中国食品学报,2014,14(6):104-109.
[17]刘春花,高金锋,王鹏科.超声波法提取苦荞黄酮的工艺研究[J].西北农业学报,2009,18(1):281-284.
[18]宫风秋,张莉,李志西,等.加工方式对传统荞麦制品芦丁含量及特性的影响[J].西北农林科技大学学报:自然科学版,2009(9):179-183.
[19]蒋少华,王文亮,弓志青,等.洋葱皮中类黄酮不同提取工艺的比较[J].食品科技,2014,39(8):191-195.
[20]王振忠,武文浩.野菊花总黄酮提取工艺的响应面设计优化[J].时珍国医国药,2007,18(3):648-650.
[21]周芳,赵鑫,宫婕,等.响应面法优化超声辅助提取红皮云杉多酚工艺[J].食品工业科技,2014,35(1):210-213,218.
[22]常丽新,贾长虹,郁春乐.响应面优化玉米芯黄酮的提取工艺研究[J].食品工业科技,2014,35(2):259-263,290.
[23]王宁娜,石珂心,赵武奇,等.响应面法优化超声波辅助提取樱桃籽油的工艺研究[J].食品工业科技,2014,35(2): 230-234.
[24]刘淑萍,邸丁.不同种类蔬菜中黄酮类成分的含量分布[J].河北联合大学学报,2012,34(3):112-114.
