低频超声场促进细丽毛壳菌发酵生产α-葡聚糖酶的研究
2015-02-21张泽栋刘继栋陆海勤杭方学史昌蓉
张泽栋,刘继栋,陆海勤,杭方学,2,李 红,史昌蓉,李 凯,2,3,*
(1.广西大学轻工与食品工程学院,广西南宁530004; 2.糖业及综合利用教育部工程研究中心,广西南宁530004; 3.广西大学糖业工程技术研究中心,广西南宁530004)
α-葡聚糖酶又称右旋糖酐酶,是一种专一性裂解葡萄糖分子中α-1,6糖苷键的水解酶,广泛应用于食品、医学、化工等领域[1-2]。自然界中能生产α-葡聚糖酶的微生物为细菌及真菌,如NovoNordisk从青霉属等微生物中分离得到α-葡聚糖酶[3]。然而,野生菌或野生植物来源的α-葡聚糖酶产量普遍较低,仅有约31.0U/m L[4]。尽管有研究人员采用物理或化学诱变方式来获取高产α-葡聚糖酶生产菌[5],但并未见到较为成功的报道。随着合成生物学的发展,α-葡聚糖酶已经实现了在工程菌如毕赤酵母(Pichia pastoris)高效表达[6]。然而,由于工程菌来源的α-葡聚糖酶的安全性存在较大争议,使得其在食品领域的应用受到限制[6]。因此,开发一种高效、安全、廉价的葡聚糖酶成为食品、药品工业面临的关键问题之一。
细丽毛壳菌为一种丝状真菌,是美国及欧盟认可的一种食品安全性菌株[7]。在发酵过程中,细丽毛壳菌向发酵液中分泌葡聚糖酶[8]。然而,由于细丽毛壳菌有较强的自絮凝性,会使得菌体以絮凝团形态悬浮于发酵液中,限制了菌体与培养基、空气的接触比表面积,导致葡聚糖酶酶活性较低,较难达到工业化应用水平[9]。研究人员尝试了添加玻璃珠或机械搅拌等方法以降低菌体絮凝现象,然而这些方法都未能较好的解决菌体絮凝问题[10]。
以往的研究发现低频超声场诱发的超声空化作用[11]对部分微生物的菌体生长或发酵产率具有促进作用[12],促进了声学技术在发酵工程领域的应用。Matsuura等用43kHz的低频超声场处理酿酒酵母发酵液后证实,低频超声场能促进酵母繁殖,缩短发酵时间50%~60%[13]。Avhad DN等发现低频超声场可使得以球形芽孢杆菌为来源的纤维蛋白溶解酶活性提升1倍[14]。Toba将超声波用于乳制品发酵过程,发现超声处理可以将乳酸杆菌的活力提高50%[15]。本研究考察了低频超声场对细丽毛壳菌发酵生产α-葡聚糖酶的影响。研究证实,在细丽毛壳菌发酵生产葡聚糖酶过程中使用低频超声场,酶活提高87.9%,菌体生物量提高25.0%。
1 材料与方法
1.1 材料与仪器
细丽 毛 壳 菌 (Chaetomium Gracile,菌 号CGMCC3.3783) 购自中国微生物菌种资源库(CGMCC);葡聚糖T2000、右旋糖酐粗酐、葡萄糖、酵母浸膏 均为山东金洋药业生物有限公司提供;丙三醇、3,5-二硝基水杨酸 天津化学试剂有限公司;磷酸氢二钾、柠檬酸、氢氧化钠、磷酸氢二钠、硫酸镁 均为南宁蓝天实验设备有限公司提供;所有试剂均为分析纯。
ZHJH1115型超净工作台 上海智城分析仪器制造有限公司;DELTA-320型pH计 梅特勒-托利多仪器(上海)有限公司;UV-2501PC紫外分光光度计日本岛津公司;JM-B2003电子天平 南京东迈科技仪器有限公司;LSQ-LS-100A立式压力蒸汽灭菌锅 上海博迅实业有限公司;HHS型恒温水浴锅 上海雷韵实验仪器有限公司;ZHWY-211C型恒温培养摇床器 上海智城分析仪器制造有限公司; SB-400DTY型超声波扫频清洗机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 培养基的制备、发酵条件以及酶活的测定 取马铃薯浸取液1.0L、葡萄糖20.0g制成种子液体培养基,用接种环在无菌条件下至少挑取2环细丽毛壳菌并接种到种子液体培养基中,用250m L的三角瓶装液,装液量为25m L,在转速为200 r/min的28℃恒温培养摇床器中培养32h[8]。
将1.0%葡聚糖,0.5%酵母浸膏,0.1%磷酸氢二钾,0.02%硫酸镁制成发酵培养基并用0.1mol/L的柠檬酸-0.2mol/L的磷酸氢二钠缓冲液调节pH至6.0。用250m L的三角瓶装液,装液量为25m L,在无菌条件下用移液枪从种子液体培养基中吸取0.5m L即2%的培养液接种到发酵培养基中,在200r/min转速条件下的28℃恒温培养摇床器中培养72h[8]。
细丽毛壳菌发酵液在4700 r/m in、4℃条件下离心15min,得到的上清液即为α-葡聚糖酶粗酶液[8]。取900μL质量分数为2.0%的葡聚糖溶液,置于50℃恒温水浴中保温5m in,随即加入100μL酶液,准确反应10min,立即加入2m L的DNS以终止反应,于沸水浴5min,迅速将其冷却,用蒸馏水定容至25m L,于波长540nm处测定吸光值。从葡萄糖标准曲线的回归方程求得相对应的葡萄糖的量,并折算出酶活。酶活定义为:在上述条件下,每分钟从葡聚糖底物中释放出1μmoL还原糖所需的酶量为1个酶活单位,以U/m L表示[16]。
1.2.2 超声处理摇床组与普通摇床组培养条件 最初超声处理条件为超声频率24kHz、超声时间1min/ 20m in、超声功率50W,每次超声处理后将三角瓶放入摇床中继续培养,发酵周期72h,温度28℃。普通摇床培养组在温度28℃,转速200 r/m in条件下恒温培养72h,与超声处理组形成对照。
1.2.3 最适超声条件的确定 采用单因素实验方法,在超声时间1m in/20m in,超声频率24kHz的条件下,分别选择超声功率为0、50、300和500W进行培养,发酵72h后测发酵液酶活,确定最适超声功率。
在已确定的超声功率以及超声频率24kHz的条件下,分别选择0、10s/20min、20s/20min、30s/20min、40s/20min、50s/20m in以及1m in/20m in为超声作用时间,发酵72h后测发酵液酶活,确定最适超声时间。
在已确定的超声功率、时间的条件下分别选择0、20、25、33、53及80kHz为超声频率,发酵72h后测发酵液酶活,从而确定最适超声条件。
1.2.4 恒重法测量菌体干重以及菌体曲线的绘制
从发酵开始每隔8h在无菌操作台将发酵液完全倒入50m L离心管中,在4700 r/m in条件下离心15m in,将菌体分离出来,然后将菌体移入已称量过重量的坩埚中,置于100~105℃的鼓风干燥箱干燥6~8h,烘干至恒重[17]。将干燥的样品用分析天平进行称重,记录菌体的干重。然后以发酵时间为横坐标,测得的菌体干重为纵坐标,绘制菌体曲线。
1.3 数据统计分析
数据以均数表示,用Origin8.0进行数据处理并作图,对部分数据用SPSS统计软件进行t检验,p<0.05表示差异有显著性。
2 结果与分析
2.1 超声场对α-葡聚糖酶活性的影响的初步探索
以往的研究证实,增加机械搅拌强度并未能有效提高自絮凝丝状菌的发酵产酶效率[18],这可能与机械搅拌形成的剪切力对菌体造成损伤有关。因此,传统的机械搅拌促进传质方式并不适合于自絮凝性较强的丝状真菌的发酵过程。
在现代发酵过程中引入声学技术正逐步得到学者的认可[18],研究表明适宜的低频超声场不仅能够起到促进菌体分散,而且能够产生胞内微流,改变菌体细胞膜的渗透性,加强物质的运输,进而增强微生物菌体的代谢活性[19]。
为研究超声场对α-葡聚糖酶活性的影响,以超声技术处理后的摇床培养和普通摇床培养进行对照。研究表明,在初始超声条件下,超声处理后发酵液酶活为116.9U/m L,比普通的摇床培养提高了14.8%,可有效地促进细丽毛壳菌发酵生产α-葡聚糖酶,提高菌体分泌酶量(图1A)。用恒重法对2种不同处理条件下的发酵液菌体量进行测定。结果表明,当发酵48h时两种发酵液菌体干重均达到最大值,超声处理后的发酵液菌体干重为6.405g而空白组仅为6.008g,利用超声技术处理发酵液比起摇床组可以将菌体量提高9.4%(图1B)。说明超声技术可显著提高细丽毛壳菌发酵液酶活以及菌体生物量。
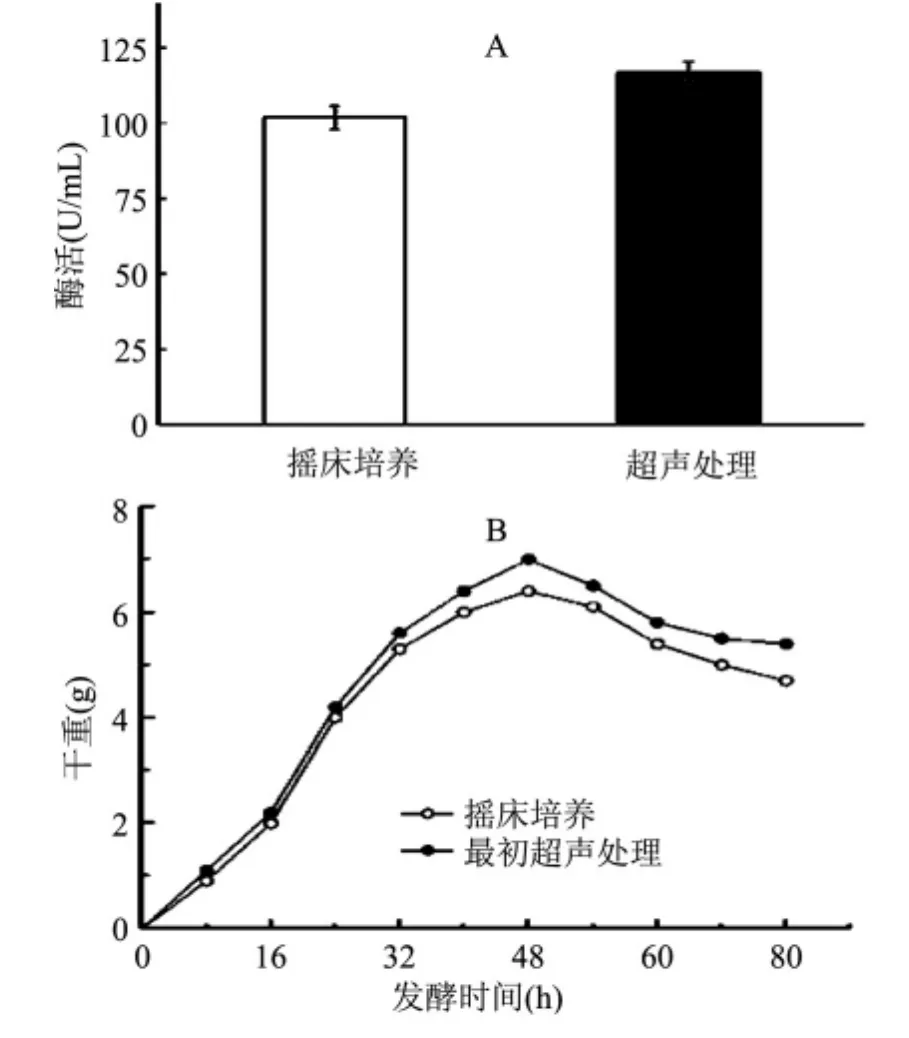
图1 超声处理与摇床培养对发酵液酶活(A)及菌体量(B)的影响Fig.1 Influence of ultrasonic treatment and shaking table on fermentation liquid enzyme activity(A) and cell dry weight(B)
2.2 最适超声功率的确定
本研究通过设置不同的功率参数来考察超声功率对细丽毛壳菌发酵过程的影响。研究发现,当超声功率为50W与300W时发酵液酶活均高于空白组,酶活与超声功率呈正相关关系,尤其当超声功率为300W时酶活为127.4U/m L比空白组酶活提高15.6%。而当超声功率为 500W 时,酶活仅为91.0U/m L,反而对酶产量起抑制作用(图2A)。同时用300W超声功率与空白组进行对照,用恒重法对2种不同功率条件下的发酵液菌体量进行测定。研究表明,当超声功率为300W时可以有效地提高菌体生物量,在48h时菌体干重达到最大值7.050g,在40h时菌体干重为6.910g比起空白组提高了17.0%(图2B)。由于微生物种类不同,其最适超声强度的需求也不尽相同[20]。在前期的实验过程中,我们证实了低频超声对细丽毛壳菌发酵生产α-葡聚糖酶具有促进作用,而较高频率下的超声场的空化作用容易抑制细丽毛壳菌的发酵进程[20]。在后续的实验中,选择超声功率为300W。
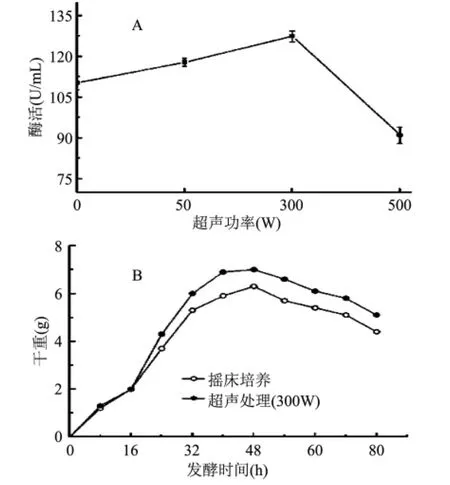
图2 超声功率对酶活(A)以及菌体量(B)的影响Fig.2 Influence of ultrasonic power on enzyme activity(A)and cell dry weight(B)
2.3 最适超声场作用时间的确定
通过设置不同的时间参数来考察了超声作用时间对细丽毛壳菌发酵过程的影响。研究表明,随着超声作用时间的增加,发酵液酶活呈现出先增长后下降的趋势。空白组酶活为 100.9U/m L,在 20s/ 20m in时酶活最高达到175.8U/m L,提高了74.2%,随后酶活逐渐下降,而当超声时间为1m in/20m in时酶活仅为127.8U/m L(图3A)。同时用20s/20m in的超声时间与空白组进行对照,用恒重法在不同时间段内对2种不同超声时间条件下的菌体量进行测定,研究表明,当超声时间为20s/20min时菌体干重在56h时为6.800g比起空白组可显著提高菌体量,提高了19.3%(图3B),而过长的超声作用时间容易对菌体造成较大的伤害。故选择20s/20m in为最适超声场作用时间。
2.4 最适超声频率的确定
虽然上述结果证实超声场有利于发酵生产,然而并非所有频率的超声对菌体生长都起着促进作用,其促进效果也不尽相同。比如,高频超声场的稳态空化作用较强,空化作用产生的微射流都能造成细胞的损伤甚至死亡,对菌体细胞造成的损伤较大[19]。因此,学者在一般选择使用较低频率的超声场,如Schläfer等发现低频超声场可以明显改善生物活性,提高生物量2.3倍[21]。
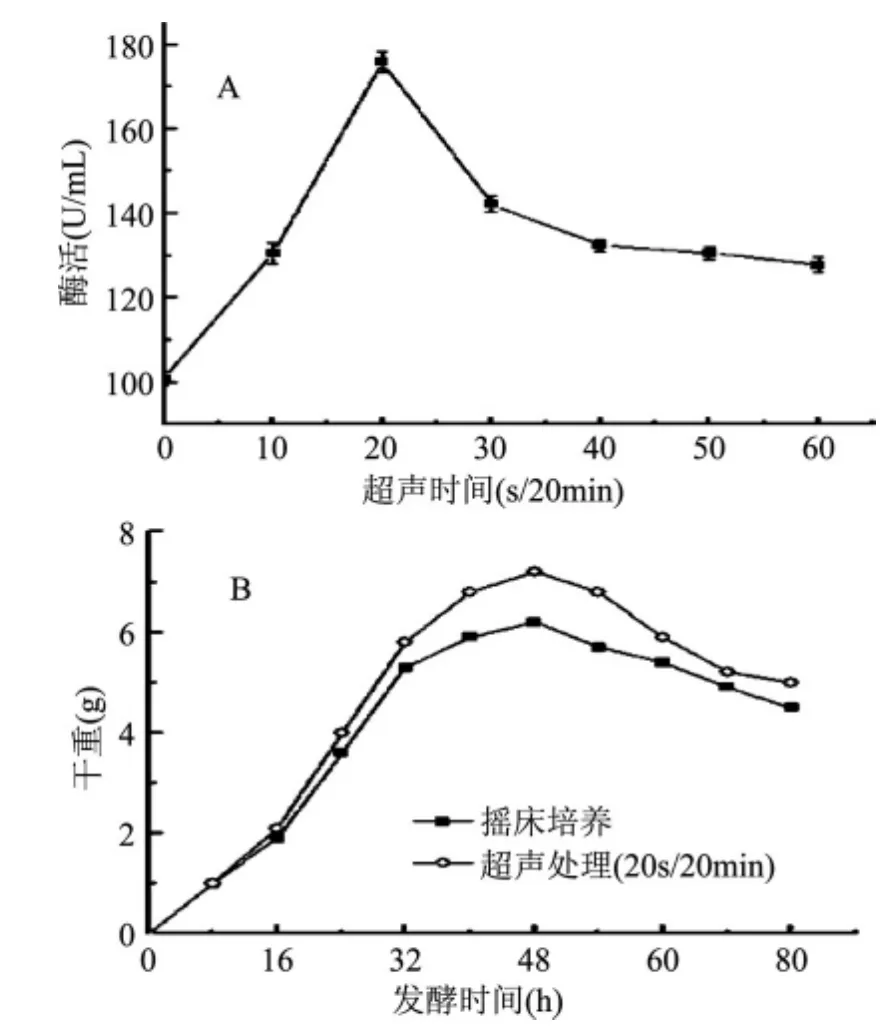
图3 超声时间对酶活(A)以及菌体量(B)的影响Fig.3 Influence of ultrasonic time on enzyme activity(A)and cell dry weight(B)
本研究通过设置不同的频率参数来考察超声频率对细丽毛壳菌发酵过程的影响,并考察最适超声处理条件。数据表明,空白组酶活为102.9U/m L,当超声频率为 20kHz时发酵液酶活最高达到193.4U/m L,提高了87.9%,提升效果较为明显。之后发酵液酶活与超声频率呈反比例关系,在80kHz时酶活仅为93.5U/m L。由此可见,20kHz为最适超声频率,随着频率的继续增强,超声对细丽毛壳菌发酵过程并未起到更大的促进作用,而过高的超声频率对细丽毛壳菌分泌α-葡聚糖酶起到抑制的作用(图4)。
通过单因素实验,确定超声功率300W,超声时间20s/20m in,超声频率 20kHz为最适超声处理条件。
2.5 最适低频超声场对菌体自絮凝现象以及菌体生物量的影响
菌体形态是影响丝状真菌生长代谢的重要因素,发酵液中较好的菌丝体形态可以为菌体生长、繁殖及代谢提供良好的基础[22]。在自絮凝菌株内,由于菌体在发酵过程中聚集成球团导致菌体不能呈现最适菌体形态,从而影响了其与培养基的传质过程,造成菌体生长代谢缓慢[23]。因此,对于存在自絮凝性状的菌株的发酵培养过程,应该考虑的关键问题之一就是在不损伤菌体的情况下提高菌体的分散性,从而使菌体在发酵液中呈现较好的菌体形态,增加与培养基接触的比表面积,从而提高菌体酶的分泌量与菌体生物量[24]。
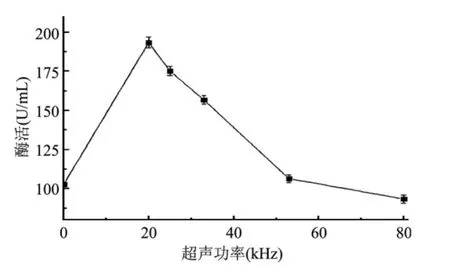
图4 超声频率对酶活的影响Fig.4 Influence of ultrasonic frequency on enzyme activity
为考察最适超声处理条件对菌体自絮凝现象的影响,本研究利用最适超声处理条件超声技术处理发酵液,与摇床培养条件下的发酵液进行对比。相比与单纯摇床培养,低频超声辅助摇床培养呈现出更好的菌体分散性(图5)。
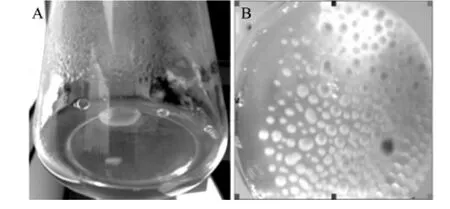
图5 摇床处理(A)与超声处理(B)对菌体自絮凝现象的影响Fig.5 Influence of shaking table(A)and ultrasonic treatment(B)on phenomenon of cell flocculation
按照恒重法测量菌体干重并绘制菌体生长曲线,在发酵0~16h内,菌体较少,超声处理后发酵液菌体与摇床培养菌体干重无明显区别,在发酵32h后,超声处理后的细丽毛壳菌菌体干重明显大于超声培养条件下的菌体干重,在40h时超声处理后发酵液干重为7.622g,而空白组为6.370g在发酵48h时菌体干重达到最大值7.871g,比起空白组6.299g提高了25%。之后菌体的生长情况逐渐减缓,但在发酵后期超声处理后菌体量的减少的速度小于摇床培养。事实证明,低频超声处理可以有效提高发酵液的酶活,这是由于低频超声场可以有效地解决菌体絮凝问题,使得菌体从球团状分散开来,增加菌体酶的分泌量,提高细丽毛壳菌生物量(图6)以及产酶效率(图4)。其中,在发酵前期,菌体数量较少,并未出现絮凝现象,超声处理组与摇床组菌体量无显著差异。随着菌体的增多,菌体絮凝现象的加剧,低频超声处理的发酵液中呈现了较高的菌体分散性、生物量及酶活性,恰好也证明了低频超声场对降低细丽毛壳菌絮凝现象及提高酶产量所起的促进作用。
通过菌体生长曲线可以看出当菌体干重达最大值7.871g时,超声处理组比起摇床组干重增加25.0%,证明低频超声场有利于提高菌体生物量(图6)。
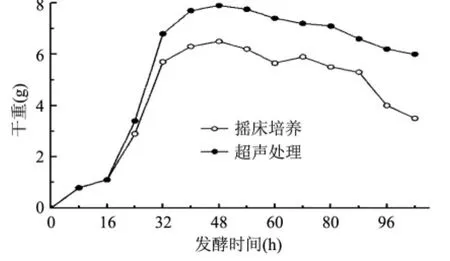
图6 最适超声条件对菌体量的影响Fig.6 Influence of optimum ultrasonic treatment on cell dry weight
3 结论
本研究通过超声时间、超声频率、超声功率这些因素考察了超声场对细丽毛壳菌发酵过程的影响。研究发现,利用低频超声技术处理细丽毛壳菌发酵液可以提高发酵液中α-葡聚糖酶产量以及酶活。最佳超声场条件为超声时间20s/20min,超声频率20kHz,超声功率300W,此时酶活最高为193.4U/m L,同比空白对照组提高87.9%。实验结果对于超声技术应用于毛壳菌发酵过程有一定的意义,同时可为类似的絮凝性真菌的发酵过程提供借鉴。
[1]Zohra RR,Aman A,Ansari A,et al.Dextranase:Hyper production of dextran degradinenzyme fromnewly isolated strain of Bacillus licheniformis[J].Carbohydrate polymers,2013,92(2): 2149-2153.
[2]蒋丹,仇元新,胡涛,等.口腔链球菌右旋糖酐酶分子结构和功能的研究进展[J].国际口腔医学杂志,2008,35(3): 249-251.
[3]Novo Nordisk A/S.A dextran decomposing enzyme for the sugar industry[P].Denmark:product data information 112-GB.1977:3-5.
[4]Sarkar D,Day DF.Dextran analysis::Amodifiedmethod[J].JASSCT,1986(6):102-107.
[5]杨月芬.产β-葡聚糖酶菌株的诱变育种、发酵产酶及其性质研究[D].无锡:江南大学,2008.
[6]梁达奉.α-葡聚糖酶的基因工程菌构建、发酵及其应用研究[D].广州:广东工业大学,2011.
[7]孙彩霞,董国堃,章强华.欧盟、美国、日本食品中豁免物质的比较研究[S].农业质量标准,2009,1:49-51.
[8]麻少莹,陆海勤,杭方学,等.α-葡聚糖酶发酵工艺与酶活影响因素研究[J].食品科学,201,34(7):171-174.
[9]Akira I,Kazoo N,Seizi I,et al.A bacteriolytic enzyme fromchaetomium globosum,a marine isolate[J].Archivfur Mikrobiologie,1973,91(1):41-54.
[10]Kelly S,Grimm LH,Bendig C,et al.Effects of fluid dynamic induced shear stress on fungal growth andmorphology[J].Process Biochemistry,2006,41(10):2113-2117.
[11]Belova V,Gorin DA,Shchukin DG.Selective ultrasonic cavitation on patterned hydrophobic surfaces[J].Angew Chem Int Ed Engl,2010,49(39):7129-7133.
[12]Feng Wu.The effect of ultrasonic treatment on biological hydrogen production from anaerobic fermentation of sludge[J].Journal of Biotechnology,2008,136:646.
[13]Matsuura K,Hirotsune M,Nunokawa Y,et al.Acceleration of cell growth and ester formation by ultrasonic wave irradiation[J].Journal of Fermentation and Bioengineering,1994,77(1): 36-40.
[14]Avhad DN,Rathod VK.Ultrasound stimulated production ofa fibrinolytic enzyme[J].Ultrasonics Sonochemistry,1994,21 (1):182-188.
[15]Barati A,Mokhtari-DizajiM.Ultrasound dose fractionation in sonodynamic therapy[J].Ultrasound Med Biol,2010,36(6): 880-887.
[16]王俊丽,聂国兴,曹香林,等.不同DNS试剂测定木糖含量的研究[J].食品研究与开发,2010,31(7):1-4.
[17]李瑞洲,郑元生.镀银纤维抗菌性实验研究[J].棉纺织技术,2009,37(5):31-33.
[18]Sinisterra JV.Applicalication of ultrasound to biotechnology: an overview[J].Ultrasonics.1992,30(3):180-185.
[19]Wu H,Hulbert G,Mount J.Effects of ultrasound on milk homogenization and fermentation with yogurt starter[J].Innovative Food Science&Emerging Technologies,2000,1(3):211-218.
[20]Chuanyun D,Bochu W,Chuanren D,et al.Low ultrasonic stimulates fermentation of riboflavin producing strain Ecemothecium ashbyii[J].Colloids and Surfaces B:Biointerfaces,2003,30(1-2):37-41.
[21]Schläfer O,Sievera M,Klotzbucher H,et al.Improvement of biological activity by low energy ultrasound assisted bioreactors[J].Ultrasonics,2000,38(1-8):711-716.
[22]Papagianni M.Fungalmorphology and metabolite production in submerged mycelial processes[J].Biotechnology Advances,2004,22(3):189-259.
[23]Papagianni M,Joshi N,Moo-Young M.Comparative studies on extracellular protease secretion and glucoamylase production by free and immobilized Aspergillus niger cultures[J].Journal of Industrial Microbiology and Biotechnology,2002,29(5): 259-263.
[24]Cui YQVR,Luyben KCAM.Effect of agitation intensities on fungal morphology of submerged fermentation[J].Biotechnology and Bioengineering,1997,55(2):715-725.
