Cellic CTec2水解常压甘油自催化预处理麦草的特性探讨
2015-02-21戴一凡周邦炜林巧文郑志永张震宇孙付保
谭 玲,王 亮,燕 红,戴一凡,周邦炜,林巧文,郑志永,张震宇,孙付保,*
(1.江南大学生物工程学院,糖化学与生物技术教育部重点实验室,江苏无锡214122; 2.山东大学微生物技术国家重点实验室,山东济南250100; 3.哈尔滨理工大学化学与环境工程学院,黑龙江哈尔滨150040)
纤维素酶的应用非常广泛,可用于辅助处理淀粉质原料来生产饲料、酒精、果蔬汁和啤酒等。在果蔬汁的提取纯化方面,纤维素酶能够破坏植物细胞壁,增加果汁的产率,缩短生产时间,并且压榨之后能使果浆部分或是完全液化。在啤酒酿造方面,能增加过滤速度,减少截留时间,降低粘度,达到节约能源的效果[1-2]。
另一方面,纤维素酶水解木质纤维素生产生物燃料或者其它产物一直是生物领域研究的热点。木质纤维素的利用主要包括预处理和酶解两个步骤,其中预处理方法包括:稀硫酸、稀碱、热水、汽爆、液氨、生石灰、有机溶剂和离子液等[3-4]。在前期工作中,本实验室建立了一种高沸点有机溶剂预处理—常温甘油自催化预处理,该方法能通过解离纤维质复杂的组成结构而提高酶解效率[5]。在酶解方面,纤维素酶是影响该过程成本的关键因素之一[6-7],于是国内外许多研究者开展纤维素酶制剂应用酶解的工作。江新德等[8]和刘俊[9]分别探讨了Celluclast 1.5L水解园艺废弃物和旧纸板纸浆的特性。赵鹏飞等发现CTec2能够高效酶解乳酸预浸渍和蒸汽爆破预处理的小麦秸秆,以及磷酸预浸蒸汽爆破玉米秸秆[10-11],并提高基质同步糖化发酵的产量[12-13],该研究显示CTec2能够水解不同来源的木质纤维素,具有较好的基质适应性。然而,这些研究都属于CTec2的直接利用,有待开展该酶以及与其它纤维素酶相比较的系统研究。因此,本文以常压甘油自催化预处理麦草作为基质,通过与其它三种商业纤维素酶相比较,考察CTec2水解效果、酶活特征和高浓水解以及添加剂对CTec2高浓度基质酶解的影响,详细研究CTec2对天然木质纤维素基质的水解特性。
1 材料与方法
1.1 材料与仪器
风干小麦秸秆 来自河南南阳,剪成2cm左右的小段,60℃烘干到恒重,储存于实验塑料袋中备用;工业甘油 购自河北省衡水京华化工有限公司,浓度为95%,用于预处理时稀释到70%;纤维素酶Cellic CTec2、Celluclast 1.5 L由诺维信(中国)投资有限公司馈赠,纤维素酶GC220和Spezyme-CP 购自无锡杰能科生物工程有限公司。
加热套 上海勒顿实业ZNHW(500m L)加热套;酶标仪 美国,美谷分子SpectraMax Plus384。
1.2 实验方法
1.2.1 常压甘油自催化预处理 取10g烘干的麦草于圆底烧瓶中,加入200g浓度为70%的甘油水溶液,用加热套加热到220℃后保持3h。自然冷却到120~130℃,缓缓加入150m L去离子水并不断搅拌。1号砂芯漏斗趁热过滤,用40%的热甘油水溶液洗两次后再用去离子水洗两次。处理后的麦草分为两部分,一部分60℃烘干到恒重用来测量含水量,另一部分冷冻保藏用于后续酶解[14]。
1.2.2 预处理麦草的酶解 基质浓度为2%时,称取相当于0.3g干重的常压甘油自催化预处理麦草湿基于150mL三角瓶中,分别按每克纤维多糖添加15mg酶蛋白(12.5FPU)加入纤维素酶 CTec2、Celluclast 1.5L、GC220和Spezyme-CP,然后补加缓冲溶液到15g,放置温度50℃和转速120r/min水浴摇床上进行酶解。在24、48和72h时分别取样,测量酶解率。当基质浓度为15%时,称取相当于2.25g干重的基质和相应酶载量的CTec2,其余操作同上。本实验均为2个重复。
1.2.3 纤维素酶之间的协同作用 四种纤维素酶CTec2、GC220、Celluclast 1.5L和Spezyme-CP按酶蛋白用量1∶1两两复合,按总酶载量为15mg/g纤维多糖以2%常压甘油自催化预处理麦草进行酶解,考察四种纤维素酶之间的协同作用。
1.2.4 添加剂对酶解的影响 添加剂种类的选择:配成底物浓度为15%,酶载量为8mg/g的酶解体系,然后按0.05g/g基质分别加入PEG系列(PEG1000,PEG2000,PEG4000,PEG6000,PEG10000)、吐温系列(吐温20、吐温40、吐温60、吐温80)和BSA。在选择添加剂浓度时,在上述酶解体系中分别加入不同浓度(0.001,0.025,0.05,0.1g/g)PEG10000、吐温20和BSA进行酶解以选择适宜的添加剂浓度。
1.3 测定方法
1.3.1 麦草组分测定方法 麦草的纤维素、半纤维素以及木质素的含量参照国际能源部实验室[15-16]和华南理工大学[17-18]的方法进行测定。

表1 常压甘油自催化预处理前后麦草的主要组成变化Table1 Main composition ofwheat straw before and after atmospheric glycerol pretreatment
1.3.2 纤维素酶蛋白含量 根据李红武[20]和蔡红[21]所用的茚三酮比色法测定酶蛋白质含量。
1.3.3 还原糖测定方法 还原糖测定用DNS法[22],根据姚明静的方法[23]加以改进。具体为:吸光值的测定改用酶标仪,保持同批次测量结果一致性的同时大大节省了工作量。
1.3.4 酶活测定方法 滤纸酶活(FPA)根据国际理论应用化学协会推荐的国际标准方法进行测定[23]。β-葡萄糖苷酶酶活(BG)和CMC酶活的测定根据Nieves方法进行测定[24]。酶活定义:酶于 50℃和pH4.8条件下,每分钟水解0.5000g标准基质生成1μmol葡萄糖所需的酶量定义为一个酶活单位[25]。
1.3.5 数据分析方法 酶解率=[(15 W酶解后)/ρ上清]C测/[C总2.25 ×1.111]
式中:W酶解后:酶解液中的基质干重,ρ上清:酶解液上清的密度,C测:酶解液中还原糖浓度,C总:预处理麦草中的纤维多糖浓度(0.8014g纤维多糖/g基质)。
实验数据均用Excel软件处理。
2 结果与分析
2.1 几种代表性商业纤维素酶制剂的比较
为了比较 CTec2和其它三种商业纤维素酶(Celluclast 1.5L、GC220和Spezyme-CP)水解常温甘油自催化预处理麦草的酶解率,本实验在相同滤纸酶活(12.5U/g纤维多糖)和相同蛋白载量(15mg/g纤维多糖)情况下,用四种商业纤维素酶分别酶解了2%预处理麦草。如图1所示,四种商业纤维素酶水解预处理麦草产糖量在48h之前随着时间的延长而增长,48h之后水解率没有明显变化。由图1a可知相同滤纸酶活条件下,CTec2的水解率明显高于其它三种纤维素酶,在48h达到78.4%,为最高水解率,继续往后水解,基质水解率没有提高。CP的水解效果次之,1.5L和GC220的水解率较差,水解48h在54%左右。图1b显示,在相同酶蛋白载量情况下,CTec2在48h时酶解效果明显好于其它三种纤维素酶,高达71.5%,但其它三种纤维素酶比较低,在48h时不到40%。这些数据表明,纤维素酶制剂Ctec2更适用于常压甘油自催化预处理麦草的酶解,在相同滤纸酶活时该酶水解常压甘油自催化预处理麦草的酶解率高,可能是该酶制剂中存在一些非纤维素酶蛋白,它们在该酶水解时起着积极作用,也可能是该酶的纤维素酶蛋白之间存在较好的协同作用。
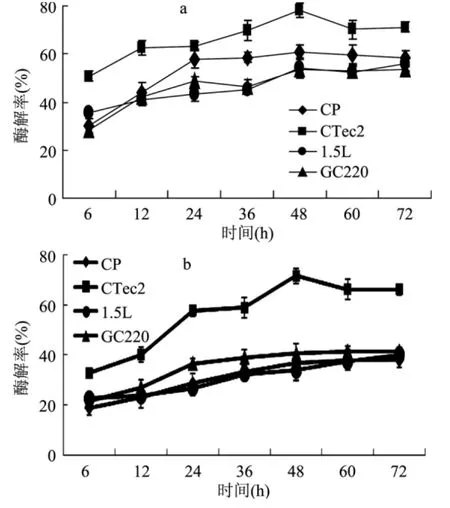
图1 四种商业纤维素酶水解常压甘油自催化预处理麦草的比较Fig.1 Comparison of four cellluase preparations acting on atmospheric glycerol pretreated wheat straw at an equal loading
2.2 商业纤维素酶制剂的酶活分析
上面实验数据显示,在相同滤纸酶活或蛋白含量条件下CTec2酶解效果远高于其它三种商业纤维素酶。为了探究其原因,我们对这四种商业纤维素酶一些酶活进行了测定。表2为四种商业纤维素酶CTec2、GC220、Celluclast 1.5 L和 Spezyme-CP的CMC酶活、β-葡萄糖苷酶活力、滤纸酶活、蛋白含量以及比活力。由表2可知,四种商业纤维素酶中,单位体积的CTec2蛋白含量最高,达到197.08 mg/m L。单位CTec2蛋白的滤纸酶活和β-葡萄糖苷酶酶活和CMC酶活分别为0.62、0.73、11.02U/mg,其中滤纸比酶活和BG比酶活是四种商业纤维素酶中最高的。值得关注的是Ctec2的CMC比酶活力不高,结合前面这些酶对天然木质纤维素基质水解来看,合理纤维素酶蛋白种类和比例才可能是木质纤维素基质高效水解的关键,这些酶蛋白之间通过协同作用实现了整个纤维素酶制剂对纤维基质的高效水解,这可能是上面Ctec2在甘油预处理纤维基质上表现出优于其它三种酶制剂水解性能的重要原因。
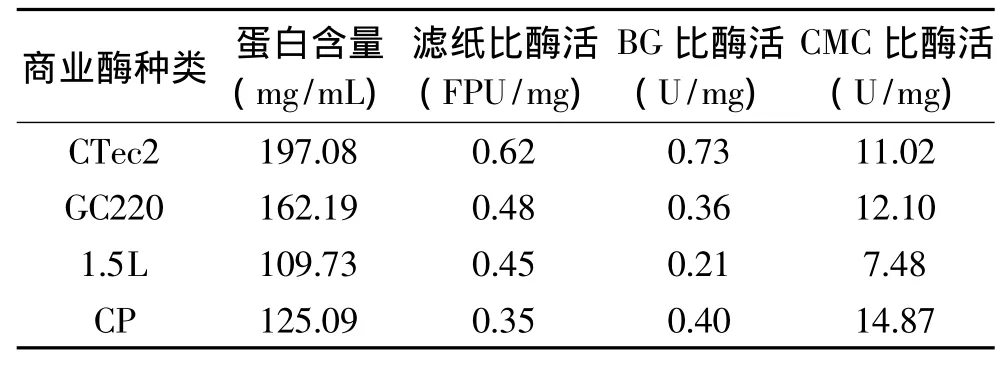
表2 各种商业纤维素酶的酶活分析Table2 Specific activity and protein loading of four commercial celluclases
2.3 商业纤维素酶之间的协同性

图2 四种商业纤维素酶两两之间的协同作用Fig.2 Synergy of four different commercial cellulases
据报道,不同商业纤维素酶按照1∶1比例复合后能够提高酶水解基质的效率[26],为此本实验把这四种商业纤维素酶两两复合,考察复合酶水解甘油预处理基质的酶解率。图2为CTec2、GC220、Celluclast 1.5LSpezyme-CP在总酶载量为15mg/g葡聚糖的条件下按酶蛋白量1∶1两两复合酶解2%基质浓度的酶解。三组含有CTec2的纤维素酶组合,其水解率明显高于其它三组,但是都低于相同蛋白含量的CTec2酶解率。说明CTec2酶解率比另外三个纤维素酶好,而且与其它三种纤维素酶制剂没有协同性,这可能是因为CTec2中各种单酶的比例已经是四种商业纤维素酶中最佳的,再与其它纤维素酶混合打乱了其中各种单酶的比例,从而不能更好的协同酶解木质纤维素。另外,实验结果还显示在相同酶载量时,GC220、CP和1.5L两两之间复合水解的酶解率也低于它们单一的酶解率,这表明商业纤维素酶在制备时可能已考虑到了关键纤维素酶蛋白组分间的协同性,早期商业纤维素酶制剂的酶解能力不如Ctec2,这些酶制剂组分的合理配比可能不是重要因素,主要可能是由于这些酶制剂中与木质纤维素水解密切相关的关键酶蛋白含量(EG、CBH和BG;EX和BX)不够,提高这些关键性酶蛋白组分在整个纤维素酶制剂中比例可能是提高酶制剂水解潜能的关键途径[27]。
2.4 CTec2酶解高浓基质的特性

图3 酶载量对高浓基质水解的影响Fig.3 Effect of enzyme loading on high consistency hydrolysis of lignocellulose
纤维素酶在髙基质浓度条件下的酶解(高浓酶解)具有以下优点:获得更高的糖浓度从而增加产物含量;减少工业生产中能量和水的消耗;降低后续水解液中产品浓缩和提纯的运行成本[28]。前面实验结果显示,CTec2在低基质浓度(2%)的条件下能高效水解常压甘油自催化预处理麦草,48h酶解率达到71.5%。为此,本实验探究了CTec2对10%、15%和20%高基质浓度常压甘油预处理麦草酶解特性。从图3可以看出:相同的酶载量时,基质液化时间随着浓度增加而延长,酶解率随着基质浓度的增加而减少;相同基质浓度时,酶解率随着酶载量的增加而增加。图3a显示,在10%浓度基质上酶载量为10、15、20mg/g纤维多糖时对应的72h酶解率分别达到58.9%、61.7%和62.9%,相对应地,其它三种酶表现为未液化或仅部分液化(数据未显示)。当基质浓度为20%时预处理麦草水解率明显降低,酶载量20mg/g纤维多糖时的72h酶解率仅为44.80%,比10%时低18.11%。这可能是因为在过高的基质浓度导致基质粘度增加,产生流体力学问题,导致酶和底物的接触(吸附解吸)变得困难,从而影响了纤维素酶的水解效率[29]。由于在基质浓度为10%时,基质很容易液化(24h内液化),而基质浓度为20%时,基质很难液化(48h都不液化),故本实验在15%基质浓度下增加了几个酶载量的探索。实验表明,在15%基质浓度水平,随着酶载量从5mg/g纤维多糖增加到20mg/g纤维多糖,72h预处理麦草的酶解率从34.8%增加到了64.5%。酶载量为8mg/g纤维多糖时,72h酶解率达到39.06%,且36h时基质已经完全液化,有利于后续时间中CTec2和纤维素的接触。考虑高基质浓度和低酶载量的问题,我们选取基质浓度15%、酶载量8mg/g作为后面了解CTec2水解高浓基质特性的条件。
2.5 添加剂对CTec2酶解的影响
已有文献报道,高分子聚合物、表面活性剂和非催化作用的蛋白质等能够极大提高木质纤维素基质酶解的水解率,降低纤维素酶的载量[30-31]。其中吐温系列和聚乙二醇系列是实验室最常用的非离子型表面活性剂。因此,本实验探究了吐温系列、PEG系列和BSA对CTec2酶解高浓基质的影响。
2.5.1 添加剂种类的影响 图4为不同种类的添加剂对CTec2在酶载量8mg/g葡聚糖时水解15%基质浓度常压甘油自催化麦草的影响。从图中可以看出,PEG的添加影响最大,比不添加任何添加剂时提高了50%以上,但PEG的不同分子量对酶解影响没有明显差异。Kristensen用不同分子量PEG作添加剂,发现随着分子量的增加,纤维素转化率稍有提高[32-33],也和本实验结果是一致的。PEG的作用机制主要是依靠疏水作用结合在木质纤维素中木质素上,减少木质素对纤维素酶的无效吸附,从而提高了纤维素酶的有效吸附,最终提高了酶解率[34]。

图4 各种添加剂对酶解的影响Fig.4 Effect of various additives on enzymatic hydrolysis ofwheat straw
同时,通过添加吐温系列于水解体系中发现,Tween20在添加量0.05g/g基质时基质的72h酶解率提高到55.6%,比不添加时提高了42.5%。W illiam也指出,吐温在高基质浓度(玉米秸秆)下更能提高基质的酶解率,其机制是吐温可以防止酶的热失活、破坏木质纤维素的结构[35]。Eriksson研究认为Tween20能够降低酶在木质纤维表面的吸附,大约从90%降低为80%,而且其还能够提高纤维素酶的稳定性[36]。
按0.05g/g基质添加BSA使得基质72h水解率达到54.0%,比未添加的提高了38.3%,相似的结果也被其他研究者报道。王新明在用纤维素酶(40U/g秸秆)水解稀硫酸和氢氧化钠处理的麦秸时,发现添加牛血清蛋白0.04g反应48h时,还原糖得率分别提高30%和22%[37]。Brethauer发现添加BSA使稀酸预处理玉米秸秆72h水解率增加了26%,认为BSA有助于纤维素酶水解的机制是减少纤维素酶失活、降低纤维素结晶度和基质颗粒大小[38]。还有些研究者也认为,BSA通过吸附在木质素上阻止了木质素在这些位点上对纤维素酶的无效吸附[39],BSA也能激活和协调纤维素酶复合酶系,加速酶在基质上的吸附和解吸[37]。

图5 添加剂浓度(g/g基质)对CTec2酶解的影响Fig.5 Effect of additive concentration(g/g substrate) on hydrolysis of glycerol pretreated wheat straw with Ctec2
2.5.2 添加剂浓度的影响 既然PEG10000、吐温20和BSA均能提高纤维素酶酶解,本实验就对这些添加剂使用浓度进行了初步选择。由图5所示,三种添加剂浓度低于0.05g/g基质时,酶解率随着添加剂浓度的增加而升高,超过0.05g/g基质之后,酶解率变化不明显,所以本实验中选取0.05g/g基质为三种添加剂的适宜添加量,72h的酶解率分别提高了55.3%(PEG10000)、42.5%(吐温 20)和 38.3% (BSA)。初步分析认为三种添加剂通过吸附到木质素表面防止了酶与木质素结合引起失活,提高了纤维素酶有效利用率;但是当添加剂浓度进一步增大时木质素表面的结合位点基本被饱和,故进一步增加添加剂也不会提高酶解的糖化率[40]。
3 结论
3.1 与早期的商业纤维素酶制剂GC220、CP和1.5L相比,Ctec2更适用于常压甘油自催化预处理木质纤维素基质水解。像其它三种酶制剂一样,该酶制剂组成及其比例是相对合适的,不但它的蛋白含量高,而且酶蛋白比活力很高,这可能是它优于其它三种酶的根本原因。
3.2 与其它三种商业酶制剂相比,Ctec2的显著优势是酶载量低于10mg/g(纤维多糖)时48h内能使10%~15%浓度基质液化,15%基质浓度(酶载量8mg/g纤维多糖)时72h酶解率将近40%,而相同条件下的其它三种酶几乎不能使基质液化。Ctec2适用于木质纤维素基质的高浓水解,是一款可以应用于纤维素乙醇工业的新型酶制剂。
3.3 Ctec2像其它纤维素酶制剂一样,添加一些辅助因子,如吐温、PEG和BSA,能显著提高其木质纤维素基质水解率。这些添加剂价格相对便宜,建议在CTec2的工业应用中适当添加相应的添加剂。
[1]祖彩霞.里氏木霉Trichoderma reesei生产纤维素酶的研究[D].上海:华东理工大学,2010.
[2]Galante Y M,De Conti A,Monteverdi R.APPlieation of Triehoderma enzymes in food and feed industries[J].Biological Control and Commercial Applications,1998,2:327-342.
[3]Eggeman T,Elander R.Process and economic analysis of pretreatment technologies[J].Bioresource Technology,2005,96 (18):2019-2025.
[4]雪金勇,马晓建,李肖斌,等.利用纤维素作物生产乙醇预处理技术[J].食品工业科技,2008,8:310-312.
[5]Sun F B,Chen H Z.Enhanced enzymatic hydrolysis of wheat straw by aqueous glycerol pretreatment[J].Bioresource Technology,2008,99:6156-6161.
[6]冯月,蒋建新,朱莉伟,等.表面活性剂Tween 80及皂荚皂素对纤维素酶活力促进作用的研究[J].林产化学与工业,2009,29:154-158.
[7]王晓辉,王文雅,袁齐朋,等.H2O2催化预处理对玉米芯酶解的影响[J].食品工业科技,2011,10:268-272.
[8]江新德,信丰学,叶俊余,等.绿色木霉EU2-77纤维素酶对园艺废弃物的酶解特性分析[J].厦门大学学报,2011,50 (5):890-895.
[9]刘俊.生物酶处理提高旧箱纸板纸浆及其成纸性能[J].造纸化学品,2011,30(3):29-34.
[10]赵鹏翔,吴毅,赵正凯.乳酸预浸渍对小麦秸秆蒸汽爆破预处理效果的影[J].可再生能源,2013,31(12):93-96.
[11]赵鹏翔,赵正凯.磷酸预浸蒸汽爆破玉米秸秆生产纤维素乙醇[J].酿酒科技,2013,10:34-37.
[12]赵鹏翔,吴毅,赵正凯.稀硫酸预浸渍对玉米秸秆蒸汽爆破预处理的影响[J].化学与生物工程,2013,30(5):67-71.
[13]赵鹏翔,吴毅,赵承宇,等.乙酸预浸渍用于小麦秸秆蒸汽预处理生产纤维素乙醇[J].中国酿造,2013,32(3):70-75.
[14]Sun FB,Chen HZ.Enhanced enzymatic hydrolysis of wheat straw by aqueous glycerol pretreatment[J].Bioresource technology,2008,99(14):6156-6161.
[15]Sluiter A,Hames B,Ruiz R,etal.Determination of structural carbohydrates and lignin in biomass[J].LAP-002 NREL Analytical Procedure,National Renewable Energy Laboratory Golden.2008.
[16]贾飞,恤海艳,关转飞,等.无机金属盐和过氧化物对酸处理玉米秸秆纤维素和半纤维素降解的影响[J].食品工业科技,2011,32(10):349-357.
[17]姚明静.非离子表面活性剂对纤维素酶促糖化的影响[D].广东:华南理工大学,2012.
[18]刘沙沙,李静梅,吴颖,等.酶法降解小麦秸秆碱预处理浓度的选择及酶解产物的检测[J].食品工业科技,2013,4: 180-183.
[19]Sun FB,Chen HZ.Comparison of atmospheric aqueous glycerol and steam explosion pretreatments of wheat straw for enhanced enzymatic hydrolysis[J].Journal of Chemical Technology&Biotechnology,2008,83(5):707-714.
[20]李红武,王璐,周桂园,等.用茚三酮显色反应测定烟草中氨基酸含量[J].安徽农业科学,2010,38(27):14926-14928.
[21]蔡红,沈仁芳.改良茚三酮比色法测定土壤蛋白酶活性的研究[J].土壤学报,2005,2:306-313.
[22]徐忠,杨汪姜.大豆秸秆纤维素酶水解条件的研究[J].食品工业科技,2004,3:58-59.
[23]Ghose T K.Measurement of cellulase activities[J],Pure and Applied Chemistry,1987,59:257-268.
[24]Nieves RA,Ehrman CI,AdneyWS,etal.Survey and analysis of commercial cellulase preparations suitable for biomass conversion to ethanol[J].World Journal of Microbiology and Biotechnology,1997,14(2):301-304.
[25]程旺开,阚清华.高温预处理稻草秸秆条件的优化[J].食品工业科技,2013,14:212-215.
[26]冯月,蒋建新,朱莉伟,等.纤维素酶活力及混合纤维素酶协同作用的研[J].北京林业大学学报,2009,31:169-173.
[27]冯月.木霉菌株产酶培养及其待定底物酶解过程研究[D].北京:北京林业大学,2012.
[28]Modenbach AA,Nokes SE.Enzymatic hydrolysis of biomassat high-solids loadings-A review[J].Biomass and Bioenergy,2013,56:526-544.
[29]Jørgensen H,Vibe-Pedersen J,Larsen J,et al.Liquefaction of lignocellulose at high-Solids concentrations[J].Biotechnology and bioengineering,2007,96(5):862-870.
[30]Kumar R,Wyman CE.Effect of additives on the digestibility of corn stover solids following pretreatmentby leading technologies[J].Biotechnology and bioengineering,2009,102(6):1544-1547.
[31]孙付保,娄秀平,洪嘉鹏,等.非离子表面活性剂对木质纤维素酶解的促进作用[J].化工进展,2011,30(12):2719-2723.
[32]Kristensen JB,Börjesson J,Bruun MH,et al.Use of surface active additives in enzymatic hydrolysis of wheat straw lignocellulose[J].Enzyme and Microbial Technology,2007,40 (4):888-895.
[33]Börjesson J,Peterson R,Tjerneld F.Enhanced enzymatic conversion of softwood lignocellulose by poly(ethylene glycol) addition[J].Enzyme and Microbial Technology,2007,40(4): 754-762.
[34]Börjesson J,Engqvist M,Sipos B,et al.Effect of poly (ethylene glycol)on enzymatic hydrolysis and adsorption of cellulase enzymes to pretreated lignocellulose[J].Enzyme and Microbial Technology,2007,41(1-2):186-195.
[35]Kaar WE,Holtzapple MT.Benefits from Tween during enzymic hydrolysis of corn stover[J].Biotechnology and bioengineering,2000,59(4):419-427.
[36]Eriksson T,Börjesson J,Tjerneld F.Mechanism of surfactant effect in enzymatic hydrolysis of lignocellulose[J].Enzyme and Microbial Technology,2002,31(3):353-364.
[37]王新明,王联结,于猛.牛血清蛋白对纤维素酶水解小麦秸秆的影响[J].食品工业科技,2012,19:194-200.
[38]Brethauer S,Studer MH,Yang B,et al.The effect of bovine serum albumin on batch and continuous enzymatic cellulose hydrolysis mixed by stirring or shaking[J].Bioresource technology,2011,102(10):6295-6298.
[39]Palonen H,Tjerneld F,Zacchi G,et al.Adsorption of Trichoderma reesei CBH I and EG II and their catalytic domains on steam pretreated softwood and isolated lignin[J].Journal of biotechnology,2004,107(1):65-72.
[40]付二红.表面活性剂对生物催化木质纤维素影响及机制的研究[D].天津:天津大学,2008.
