住院儿童单独使用万古霉素或联合哌拉西林/他唑巴坦治疗后的肾毒性比较
2015-01-08李智平
高 璇 李 静 李智平
(复旦大学附属儿科医院药剂科 上海 201102)
住院儿童单独使用万古霉素或联合哌拉西林/他唑巴坦治疗后的肾毒性比较
高 璇 李 静 李智平△
(复旦大学附属儿科医院药剂科 上海 201102)
目的 探讨哌拉西林/他唑巴坦(piperacillin-tazobactam,PLTZ)联合应用万古霉素(vancomycin,VAN)在儿童中是否会导致肾毒性的发生率增加,及其他可能增加肾毒性的混杂危险因素。方法 收集2004年1月1日至2014年12月31日之间在复旦大学附属儿科医院住院治疗的250例患儿,采用单中心、回顾性队列研究。治疗前肾功能正常并接受至少48 h的VAN治疗的患儿被纳入分析。其中125例患儿接受至少48 h的PLTZ联合VAN静脉滴注(联合组),余125例接受VAN治疗(VAN组)。对肌酐和尿素氮等检验数据和主要结果进行单因素分析,评估联合用药的风险因素对治疗后7天内肾毒性发病率的影响。其中,肾毒性的主要终点定义为血清肌酐浓度至少增长1.5倍。结果共有250例患儿纳入研究,其中有125例同时接受至少48 h静脉滴注PLTZ与VAN(联合用药组)治疗,另外共有125例接受VAN和头孢吡肟而不接受PLTZ治疗(单纯VAN组)。联合用药组肾毒性发生率为48.8%(61/125),单纯VAN组为12.0%(15/125)。与单纯VAN治疗相比,PLTZ 与VAN联合治疗显示肾毒性的发生率增加6.99倍(OR=6.99,95%CI=3.67~13.30,P=0.001)。结论VAN联合PLTZ治疗可以显著增加患儿的肾毒性发生率。与成人的研究结果相比,儿童中联用VAN与PLTZ可能存在更高的风险。
哌拉西林/他唑巴坦; 万古霉素; 肾毒性; 急性肾损伤; 儿童
【Abstraet】 Objcetivc To determine whether the addition of piperacillin-tazobactam lead to an increased incidence of nephrotoxicity in children receiving vancomycin and to explore potential confounding factors that may increase the risk of vancomycin-induced nephrotoxicity. Mcthods A single-center,retrospective cohort study was carried out in Children's Hospital of Fudan University. Two hundred and fifty children hospitalized with normal baseline renal function between Jan.1,2004 and Dec.31,2014,who received a minimum of 48 hours of vancomycin for any indication were includedin the analysis.Of these patients,125 received aminimum of 48 hours of intravenous piperacillintazobactam concurrently with vancomycin(combination group);125 received vancomycin without piperacillin-tazobactam(vancomycin group).Single factor analysis was performed to assess the effect of the risk factors on the incidence of nephrotoxicity within the first 7 days of vancomycin treatment,based on creatinine and urea nitrogen level.The primary end point of nephrotoxicity was defined as a minimum 1.5 fold increase in serum creatinine concentration. Rcsults Nephrotoxicity developed in 15(12.0%)of 125 patients in the vancomycin group and in 61(48.8%)of 125 patients in the combination group(P=0.001).Patients with piperacillin-tazobactam added to vancomycin exhibited an increased incidence of nephrotoxicity,with an odds ratio of 6.99(OR=6.99,95%CI=3.67-13.30). Conelusions We observed an increased incidence of nephrotoxicity in vancomycin-treated patients who received concomitant piperacillin-tazobactam.Compared with adult,there may be a higher risk in children treated with vancomycin and piperacillin-tazobactam.
【Kcy words】 piperacillin-tazobactam; vancomycin; nephrotoxicity; acute kidney injury; child
儿童急性肾损伤(acute kidney injury,AKI)的住院患者如果病情继续发展,可能会进一步提高肾脏疾病发病率和致死率[1]。通常继发于药物引起的肾毒性在临床中较为常见,包括药物导致的肾血流灌注不足[如血管紧张素转换酶抑制剂,非类固醇抗炎药(non-steroidal antiinflammatory drugs,NSAIDs)等],肾小管坏死(如氨基糖苷抗生素等),或药物过敏后的肾脏炎性损伤(如NSAIDs,萘夫西林等)[2-3]。万古霉素(vancomycin,VAN)是一种广泛应用于静脉内对抗革兰阳性菌的抗生素,其适应证包括治疗(但不限于)耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,MRSA)感染[4]。随着VAN作为治疗MRSA的首选药物而广泛使用,对其不良反应的防治也越来越不容忽视[5],多数研究显示其主要的不良反应是肾毒性[6-7],早先已有多项研究报道显示VAN与肾毒性的发展相关联[8-9]。VAN诱导的肾毒性的发病率通常为5%~35%,主要取决于研究人群和其他混杂的危险因素等[10]。随着耐药菌的不断进展,VAN近年来经常与其他抗菌药物联合治疗,其中就包括哌拉西林/他唑巴坦(piperacillintazobactam,PLTZ),主要是对于病因不明的中度至重度感染的初始经验性治疗或混合感染[11-12]。与VAN的情况相反,少有报道PLTZ与肾毒性的发展相关联。根据我国批准的特治星(注射用哌拉西林钠他唑巴坦钠)的说明书,肾脏和泌尿系统异常中,血肌酐水平升高少见(1%~2%),间质性肾炎、肾功能衰竭为罕见(0.01%~0.1%),血尿素氮水平升高非常罕见(<0.01%)。
但是,最近国外研究发现在成年人中VAN和PLTZ联用后可能诱发较高的肾毒性。2014年Pharmacotherapy杂志连发3篇研究[13-15]提示了其风险:VAN和PLTZ合用可能增加急性肾损伤的发生率。以上研究结果均显示,静脉联合使用VAN和PLTZ,能导致患者发生急性肾损伤,两者联合应用后能显著增加肾损伤的风险。然而,在儿童中VAN和PLTZ联用的不良反应风险仍不清楚[16-18],其联合应用在儿童特殊人群中的风险问题亟待解决。因此,本次回顾性调查的目的是判断在加入PLTZ治疗后用于接受静脉VAN的患者是否会增加肾毒性的发生率,并与成人增加VAN相关的肾毒性的风险相比较。此研究目前在国内外尚属首次,且样本量大,研究结果将对临床有相当的指导意义,对用药指南的制定也将会有一定的帮助。
资料和方法
研究设计研究设计前复旦大学附属儿科医院伦理委员会对此单中心、回顾性队列研究进行了审查,审查结果其研究行为符合复旦大学附属儿科医院伦理委员会机构审查委员会的要求,其具体伦理编号为(复儿伦审,2015J76号)。并且,本次研究已在世界卫生组织(WHO)中国临床试验注册中心(www.chictr.org.cn)进行注册,注册号ChiCTR-OPC-15006125,项目名称为“儿童住院患者单独使用VAN与其联合PLTZ治疗后的肾毒性比较”。另外,研究的主要目的是比较正常基线内住院患儿中接受静脉VAN或VAN联合PLTZ治疗后肾功能的变化及肾毒性的发生率。
纳入排除标准与临床评价指标研究纳入条件包括于2004年1月1日至2014年12月30日之间在复旦大学附属儿科医院儿童重症监护室(PICU)住院,年龄范围在0~12岁,并接受最少48 h内静脉注射VAN的治疗患儿(男性或女性),数据记录查询通过电子记录HIS系统数据库结合病历室基础病历识别查询(图1)。要求入选的每例患儿均检出MRSA感染。细菌培养采用API系统进行细菌学鉴定,药敏试验采用K-B方法,药敏试纸及琼脂培养基均由中国药品生物制品鉴定所提供。MASR的判定参照2004年美国临床实验室标准化委员会(NCCLS)的执行标准进行。纳入患儿接受静脉内PLTZ治疗的同时接受VAN至少48 h(联合治疗组),或接受静脉内头孢吡肟治疗而非PLTZ同时接受VAN治疗至少48 h(单纯VAN组),其中要求PLTZ是在开始VAN治疗后48 h内启动的。头孢吡肟为第四代注射用头孢菌素,肾毒性相对较小,因本文主要研究目的是VAN联合PLTZ是否增加儿童肾毒性,故将VAN联合头孢吡肟定义为单纯VAN组。

图1 病例筛选流程图Fig 1 Sehcmatie of thc serccning proecss of thc paticnt
纳入研究的所有患儿治疗药物均使用标准剂量,其中VAN量为20 mg/kg,每12 h 1次;PLTZ剂量为哌拉西林100 mg/kg,他唑巴坦12.5 mg/kg,每8 h 1次;头孢吡肟剂量为40 mg/kg,每12 h 1次静脉滴注。研究还要求患儿在其住院期间有4个独立的血清肌酐浓度值记录,医疗记录不全的患儿被排除在外。有潜在的肾功能障碍或最近的急性肾损伤史(定义为从入院到VAN治疗开始之前,血清肌酐浓度至少增加1.5倍)也被排除在外。由于新生儿及早产儿生长发育条件尚不完全,情况特殊,故本研究排除新生儿和早产儿。另外,肾毒性的主要终点事件,参考相关文献[14]将其定义为血清肌酐浓度至少增长1.5倍,即第7天的血清肌酐与第1天和第3天的均值相比超出50%(增长超过1.5倍)。
样本量估算与统计学处理试验样本量估算流程:根据现有资料表明[13],在现有文献的VAN的对照组(n=112)肾毒性发生的概率是0.125 (12.5%vs.34.8%),OR值是3.7,相关系数设定为0.8,同时定义POWER为80%。因此,按统计学零假设相关的Ⅰ类错误概率设定为0.05来估算,每组至少需要118名实验对象。另外,还假设存在5%的变异率,因此我们最终拟定每个组需要约125例(共需要250例)。所有试验结果由药物的人群统计基线人口数据和临床特征,均计算平均标准偏差(SD)。为了评价PLTZ和肾毒性之间的关系,PLTZ与肾毒性的发生率的相关性、比较采用了χ2检验和Fisher精确检验分析。以上所有方法均采用SPSS19.0统计软件进行分析。正态分布的数据组问两样本均数比较用t检验,两样本率的比较用χ2检验。P<0.05为差异有统计学意义。
结 果
复旦大学附属儿科医院2004年1月1日至2014 年12月30日收治住院患儿,经筛选(图1)的0~12岁接受最少48 h内静脉注射VAN治疗的患儿250例,其中同时接受VAN和PLTZ治疗者125例。将患者按是否联合使用PLTZ情况的不同分为两组,单纯VAN用药组125例,联合用药组125例。两组间年龄、性别构成、体重、感染部位等情况差异均无统计学意义(P>0.05)。另外,两组患者基线肌酐值、尿素氮等差异无统计学意义(P>0.05),详见表1。
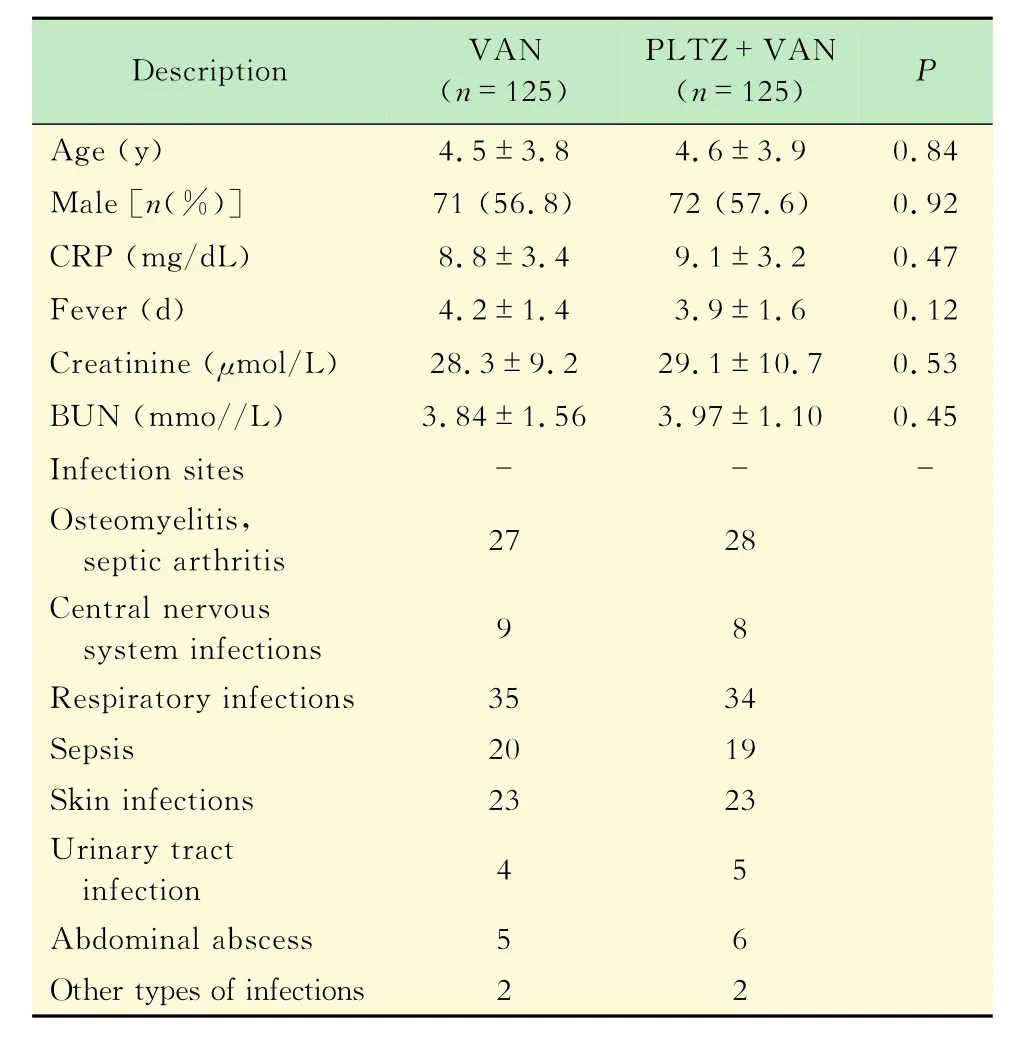
表1 治疗前各组的基线水平值Tab 1 Charaetcristies of thc paticnts bcforc thc trcatmcnt
两组患者入院治疗前均常规检测血清肌酐和尿素氮以作基线值,接受治疗后第1、3、7天再分别采集血标本进行检测。两组患者的尿素氮在第l天无明显差异(P>0.05),联合用药组与单纯VAN组分别为的(3.86±2.55)mmol/L和(3.92±3.46)mmol/L。而至治疗后第3天与第7天,联合用药组的检验结果分别为(4.47±3.62)mmol/L与(6.14 ±4.88)mmol/L,单纯VAN组为(3.65±2.30)mmol/L与(4.60±2.22)mmol/L,两组差异有显著统计学意义(P=0.001,图2B)。两组患者接受治疗后肌酐的升高情况有所差异,且于治疗后第3天开始有统计学意义(P=0.002),联合用药组明显大于单纯VAN组(90.94±136.25 vs.37.98±34. 60);而治疗后第7天这种差异更为显著(229.44± 279.44 vs.31.30±23.38,P=0.001,图2A)。

图2 单纯VAN与联用治疗后1~7天的肾功能比较Fig 2 Vaneomyein and adjunetivc thcrapy of 1-7 days aftcr thc rcnal funetion
另外,以肌酐值变化率观察分析肾毒性的发生率。本文中肾毒性发生的定义为第7天血清肌酐浓度比基线值(第1天和第3天的均值)升高超过50%。联合用药组发生各种不良反应的患者例数为61例,单纯VAN组为15例,两组差异有显著统计学意义(χ2=40.00,P=0.001),两组间风险比为6.99,95%CI=3.67~13.30,见表2。

表2 第1~7天肾毒性发生结果比较Tab 2 Prcvalcnec of aeutc kidncy injury during 1-7 days
另外,肌酐值升高是肾毒性发生的临床指标,达到升高1.5倍可能更能确定肾损伤。
讨 论
VAN是一种糖肽类的抗生素,主要抗革兰阳性细菌,包括MRSA等各类耐药菌。最初使用VAN治疗MRSA的剂量相对温和,低剂量使其不利影响降低。但是,在过去的几十年里,VAN的使用日剂量急剧增加。与20世纪80年代相比,1990年后VAN的剂量约增长了100倍,其主要原因是由于社区获得性 MRSA感染的发病率不断增加和肺炎链球菌的耐药性不断增强[19-21]。VAN主要是由肾小球滤过和某些活性管状消除分泌,其毒性发生机制尚未完全明确,目前推测其毒性发生机制之一是VAN导致的氧化应激,补体介导的炎症,并进一步导致肾小管累积性的坏死[22]。还有一些新研究发现VAN可能导致肾损的过敏反应,这与一种名为“肥大细胞”的免疫细胞有关[23]。此次研究显示肾毒性的总发病率为12.0%(单纯VAN组)与通常成人的VAN不良反应发生率(约0~17.0%)相似[24]。通常VAN的肾毒性随剂量上升而增加,其危险因素包括:增加了治疗的持续时间,总VAN的剂量超过4 g/d等[25-27]。但在本研究中,患儿的VAN用药日剂量均较低,未发现VAN每天用量超过4g的情况。对于此次研究显示的儿童群体(平均年龄4~5岁)肾毒性的发病率略高于成年人的原因,我们推测是低龄儿童肾脏系统尚未发育完全,较易受到外源性药物因素的干扰。
PLTZ是一种β-内酰胺酶抑制剂组合的广谱青霉素类抗生素[28-29]。近期越来越多的证据表明VAN和PLTZ联合用药可能进一步提升了VAN的肾毒性。Gomes等[13]通过回顾性配对队列研究比较了VAN联合PLTZ或头孢吡肟治疗过程中的AKI情况,该研究共评价了224例成年患者接受两种抗生素联合治疗患者中的AKI,PLTZ与VAN组中的AKI发生率(34.8%)显著高于头孢吡肟与VAN组(12.5%)(P<0.0001)。Burgess等[14]通过单中心、回顾性队列研究比较了联合与不联合使用PLTZ的住院患者中VAN诱发的肾毒性发生率,最终,VAN组99例患者中的8例(8.1%)和联合治疗组92例患者中的15例(16.3%)发生了肾毒性(P=0.041),OR值为2.48(P=0.032)。Meaney等[15]通过回顾性队列研究考察成人125例内科患者中与VAN相关的肾毒性,该研究表明合并给予PLTZ则发生率高出5.36倍。因此,成人中VAN和PLTZ联用可能增加AKI的发生风险。值得指出的是,儿童群体中的VAN和PLTZ联用在此前文献中均没有进行比较,缺乏相关数据描述,这可能与国外儿童用药群体较小,联合用药人数极少有关。在我国儿童住院患者的治疗中,VAN和PLTZ通常联合使用,以治疗一些中度到重度的感染患者。在本研究中,我们观察到VAN和PLTZ联用,肾毒性发生率提升了约7倍,高于前期成人的研究结果,这提示在儿童中联用VAN与PLTZ可能存在更高的风险。
因此,虽然VAN与PLTZ联合用药可以增强抗革兰氏阴性和厌氧菌属病原体的活性,但研究结果提示VAN与PLTZ联用后肾毒性显著增加,在临床中应当尽量避免使用。但是,本研究也有一定的局限性,如尚未考虑其他的伴随危险因素等,且由于本研究为单中心、回顾性研究,部分资料可能有疏漏,给结果的分析带来一定偏倚。由于AKI的发病率和死亡率相关联,我们在将来应该开展更大的前瞻性、随机对照试验证实,但开展此类风险性的临床试验同样面临儿科的伦理问题。业已证实VAN与PLTZ两药合用在成人中具有一定的肾毒性,从伦理角度来看,儿童的肾功能较成人更不完善,如仍然在儿童中开展相关的风险性测试,此类临床试验显然医学伦理上是不许可的。并且,儿童药物临床试验的病例招募相对于成人研究更为艰难,通常病例数也更少。综上所述,当前的研究表明VAN联合PLTZ治疗可以显著增加患儿的肾毒性发生率。与成人的研究结果相比,儿童联合用药的风险更大。如果需要更好地理解哌拉西林联用VAN引发AKI这一现象后的深层原因,可能需要更多和更深入的研究。
[1] Kangari G,Esteghamati M,Ghasemi K,et al.Predictive accuracy of urinary beta2-microglobulin for kidney injury in children with acute pyelonephritis[J].Iran J Kidney Dis,2015,9(1):19-24.
[2] Olowu WA.Acute kidney injury in children in Nigeria[J]. Clin Nephrol,2015,83(7 Suppl 1):70-74.
[3] Bucholz EM,Whitlock RP,Zappitelli M,et al.Cardiac biomarkers and acute kidney injury after cardiac surgery [J].Pediatrics,2015,135(4):e945-956.
[4] Ringenberg T,Robinson C,Meyers R,et al.Achievementof therapeutic vancomycin trough serum concentrations with empiric dosing in Neonatal Intensive Care Unit patients[J].Pediatr Infect Dis J,2015,34(7):742-747.
[5] 张海霞,彭翠英,杨智,等.新生儿213例万古霉素血药浓度与不良反应分析[J].中华实用儿科临床杂志,2014,29 (10):786-788.
[6] Ragab AR,Al-Mazroua MK,Al-Harony MA.Incidence and predisposing factors of vancomycin-induced nephrotoxicity in children[J].Infect Dis Ther,2013,2 (1):37-46.
[7] Gomez DS,Campos EV,de Azevedo RP,et al. Individualised vancomycin doses for paediatric burn patients to achieve PK/PD targets[J].Burns,2013,39 (3):445-450.
[8] Elyasi S,Khalili H,Dashti-Khavidaki S,et al. Vancomycin-induced nephrotoxicity:mechanism,incidence,risk factors and special populations.A literature review[J].Eur J Clin Pharmacol,2012,68(9):1243 -1255.
[9] Chen DW,Hsu YH,Liao JY,et al.Sustainable release of vancomycin,gentamicin and lidocaine from novel electrospun sandwich-structured PLGA/collagen nanofibrous membranes[J].Int J Pharm,2012,430(1-2):335-341.
[10] Stidham T,Reiter PD,Ford DM,et al.Successful utilization of high-flux hemodialysis for treatment of vancomycin toxicity in a child[J].Case Rep Pediatr,2011,2011:678724.
[11] Zheng H,Truong J,Carroll F,et al.Do formulation differences between the reference listed drug and generic Piperacillin-Tazobactam impact reconstitution?[J]. Antimicrob Agents Chemother,2015,59(3):1767-1769.
[12] Yang H,Zhang C,Zhou Q,et al.Clinical outcomes with alternative dosing strategies for piperacillin/tazobactam:a systematic review and meta-analysis[J].PLoS One,2015,10(1):e0116769.
[13] Gomes DM,Smotherman C,Birch A,et al.Comparison of acute kidney injury during treatment with vancomycin in combination with piperacillin-tazobactam or cefepime[J]. Pharmacotherapy,2014,34(7):662-669.
[14] Burgess LD,Drew RH.Comparison of the incidence of vancomycin-induced nephrotoxicity in hospitalized patients with and without concomitant piperacillin-tazobactam[J]. Pharmacotherapy,2014,34(7):670-676.
[15] Meaney CJ,Hynicka LM,Tsoukleris MG.Vancomycinassociated nephrotoxicity in adult medicine patients:incidence,outcomes,and risk factors[J].Pharmacotherapy,2014,34(7):653-661.
[16] Moenster RP,Linneman TW,Finnegan PM,et al.Acute renal failure associated with vancomycin and beta-lactams for the treatment of osteomyelitis in diabetics:piperacillintazobactam as compared with cefepime[J].Clin Microbiol Infect,2014,20(6):O384-389.
[17] Dilworth TJ,Sliwinski J,Ryan K,et al.Evaluation of vancomycin in combination with piperacillin-tazobactam or oxacillin against clinical methicillin-resistant Staphylococcus aureus Isolates and vancomycin-intermediate S. aureus isolates in vitro[J].Antimicrob Agents Chemother,2014,58(2):1028-1033.
[18] Dilworth TJ,Leonard SN,Vilay AM,et al.Vancomycin and piperacillin-tazobactam against methicillin-resistant Staphylococcus aureus and vancomycin-intermediate Staphylococcus aureus in an in vitro pharmacokinetic/ pharmacodynamic model[J].Clin Ther,2014,36(10):1334-1344.
[19] Shenoy ES,Paras ML,Noubary F,et al.Natural history of colonization with methicillin-resistant Staphylococcus aureus(MRSA)and vancomycin-resistant Enterococcus (VRE):a systematic review[J].BMC Infect Dis,2014,14:177.
[20] Fullmer A,McCue D,Feng C.Retrospective review of vancomycin-induced nephrotoxicity in patients with leukemia[J].J Oncol Pharm Pract,2014,20(6):403 -408.
[21] Ng K,Mabasa VH,Chow I,et al.Systematic review of efficacy,pharmacokinetics,and administration of intraventricular vancomycin in adults[J].Neurocrit Care,2014,20(1):158-171.
[22] Drouet M,Chai F,Barthelemy C,et al.Influence of vancomycin infusion methods on endothelial cell toxicity [J].Antimicrob Agents Chemother,2015,59(2):930 -934.
[23] Mc Neil BD,Pundir P,Meeker S,et al.Identification of a mast-cell-specific receptor crucial for pseudo-allergic drug reactions[J].Nature,2015,519(7542):237-241.
[24] Bailie GR,Neal D.Vancomycin ototoxicity and nephrotoxicity.A review[J].Med Toxicol Adverse Drug Exp,1988,3(5):376-386.
[25] Mergenhagen KA,Borton AR.Vancomycin nephrotoxicity:a review[J].J Pharm Pract,2014,27(6):545-553.
[26] Hal SJ,Paterson DL,Lodise TP.Systematic review and meta-analysis of vancomycin-induced nephrotoxicity associated with dosing schedules that maintain troughs between 15 and 20 milligrams per liter[J].Antimicrob Agents Chemother,2013,57(2):734-744.
[27] Elyasi S,Khalili H,Hatamkhani S,et al.Prevention of vancomycin induced nephrotoxicity:a review of preclinical data[J].Eur J Clin Pharmacol,2013,69(4):747-754.
[28] Cies JJ,Jain J,Kuti JL.Population pharmacokinetics of the piperacillin component of piperacillin/tazobactam in pediatric oncology patients with fever and neutropenia[J]. Pediatr Blood Cancer,2015,62(3):477-482.
[29] Lemieux P,Gregoire JP,Thibeault R,et al.Higher risk of neutropenia associated with piperacillin-tazobactam compared with ticarcillin-clavulanate in children[J].Clin Infect Dis,2015,60(2):203-207.
Comparison of thc ineidcnec of vaneomyein-induecd ncphrotoxieity in hospitalizcd ehildrcn with or without eoneomitant pipcraeillin-tazobaetam
GAO Xuan,LI Jing,LI Zhi-ping△
(Department of Pharmacy,Children's Hospital,Fudan University,Shanghai 201102,China)
R 956
A
10.3969/j.issn.1672-8467.2015.06.009
2015-03-28;编辑:王蔚)
国家自然科学基金面上项目(81370776)
△Corresponding author E-mail:zplifudan@yeah.net
*This work was supportcd by thc Gcncral Program of National Natural Seicnec Foundation of China(81370776).
