湖南省四家养猪场猪瘟抗体水平检测及免疫程序的调整
2015-01-04邱美珍杜丽飞周望平傅胜才
王 慧,邱美珍,杨 俊,杜丽飞,周望平,傅胜才
(湖南省畜牧兽医研究所,湖南 长沙 410131)
湖南省四家养猪场猪瘟抗体水平检测及免疫程序的调整
王 慧,邱美珍,杨 俊,杜丽飞,周望平,傅胜才
(湖南省畜牧兽医研究所,湖南 长沙 410131)
为了提高试验猪场免疫水平,降低猪瘟发病率,本试验通过ELISA检测技术对湖南省4家规模猪场进行猪瘟抗体水平跟踪监测,评估其免疫效果,结果发现4家猪场猪瘟抗体水平均不合格,A、B、C、D 4场经产母猪阳性率分别为70.2%、89.9%、75.4%和68.6%;哺乳仔猪阳性率分别为30.0%、70.0%、37.2%和30.3%;保育猪阳性率分别为47.4%、37.1%、58.0%和8.5%。然后进行补充免疫或将不合理的免疫程序进行调整。30 d后再次检测其抗体水平,结果显示4家猪场猪瘟抗体水平除B场哺乳仔猪外均明显升高,A、B、C、D 4场经产母猪阳性率分别为86.7%、95.9%、88.5%和100.0%,哺乳仔猪阳性率分别为38.4%、59.5%、73.1%和60.0%,保育猪阳性率分别为47.4%、60.8%、68.8%和56.2%。以此验证免疫程序调整措施基本合理。
猪瘟;免疫效果评估;免疫程序调整
猪瘟(Swine Fever;Hog Cholera,CSF)是由黄病毒科猪瘟病毒属的猪瘟病毒引起的一种急性、热性、败血性、接触性的传染病,也是导致“猪高热病综合症”的主要疾病之一。临床上分为典型猪瘟、非典型猪瘟和繁殖障碍型猪瘟。猪瘟自1883年于美国俄亥俄州大面积爆发以来,已有170多年的历史[1]。世界动物卫生组织(OIE)将其列为必须报告的疫病[2],也是我国的一类动物疫病。目前,我国防控猪瘟疫情的主要手段仍然以100%高密度强制免疫为主,但很多规模猪场免疫接种普遍存在一定的盲目性和被动性[3],常常导致免疫失败。因此,免疫后的抗体水平检测及分析成了猪瘟防控不可缺少的工作环节,根据抗体检测,免疫效果评估,制定更加合理有效的免疫程序。将实际生产中存在的“被动免疫”转为“主动免疫”和“适时免疫”。本试验通过对湖南省4家养猪场猪瘟抗体水平检测,分析其免疫程序合理之处及免疫失败原因,及时调整不合理的免疫程序,为养猪场制定符合本场实际情况的免疫方案提供了参考。
1 材料与方法
1.1 猪场情况 湖南省内4家母猪存栏数500头左右的规模猪场,编号为A场、B场、C场和D场。4家猪场环境条件都较差,生产状况不稳定,其中有2家猪场有高致病性蓝耳病的发生。
1.2 试验材料 待检样品血清、猪瘟兔化弱毒疫苗(ST传代细胞苗)、猪瘟(CSFV)抗体检测ELISA试剂盒(购自IDEXX公司)、蒸馏水、75%酒精、棉花、真空采血管、一次性采血针、采样箱、离心机、酶标仪、枪头、微量移液器、恒温箱、冰箱、1.5 mL EP管、量筒等。
1.3 试验方法
1.3.1 免疫程序的记录 包括免疫程序、免疫时间、所用疫苗的种类等有关生产和防疫的内容。
1.3.2 血清样品采集和处理 根据动物防疫样品采集技术规定(DB43/426-2009),从4家猪场共采集血液样品1 704份,于4℃下过夜,次日以4 000 r/min离心15 min,收集上清于 1.5 mL EP管中,-20℃保存备用。采血管经灭菌处理后丢掉。
1.3.3 检测方法和判断标准 运用阻断ELISA抗体检测技术检测猪瘟抗体,具体操作方法按试剂盒说明书进行。其具体步骤为:样品稀释(18~26℃孵育2 h)→洗涤→加酶标抗体(18~26℃孵育30 min)→洗涤→加底物(18~26℃孵育10 min)→加终止液,然后在450 nm处测定吸光度值。
阻断率计算公式:blocking%=(阴性对照平均OD值-样本OD值)/阴性对照平均OD值×100%。
猪瘟抗体水平判断标准:阳性值为阻断率>40%;可疑值为30%≤阻断率≤40%;阴性值为阻断率<30%。
本试验保护率为阻断率>60%(IDEXX标准为>50%)。
离散度即基于样本估算的标准偏差,反映数值相对于平均值的离散程度。计算方法为:总体标准偏差σ=Sqr t[(∑(xi-μ)^2)/N],公式中∑代表总和,μ代表总体x的均值,^2代表二次方,Sqr t代表平方根。
1.4 免疫程序的调整 根据第一次抗体检测结果综合分析4家规模猪场猪瘟免疫效果,并调整不合理的免疫程序及补充免疫。
1.5 再次采集试验猪场血清样品 免疫程序调整及补充免疫30 d左右再次采集试验猪场血清样品进行抗体检测,以验证免疫程序调整的合理性及加强免疫后的效果。

表1 4家猪场免疫程序Table1 Immunization program of four pig farms
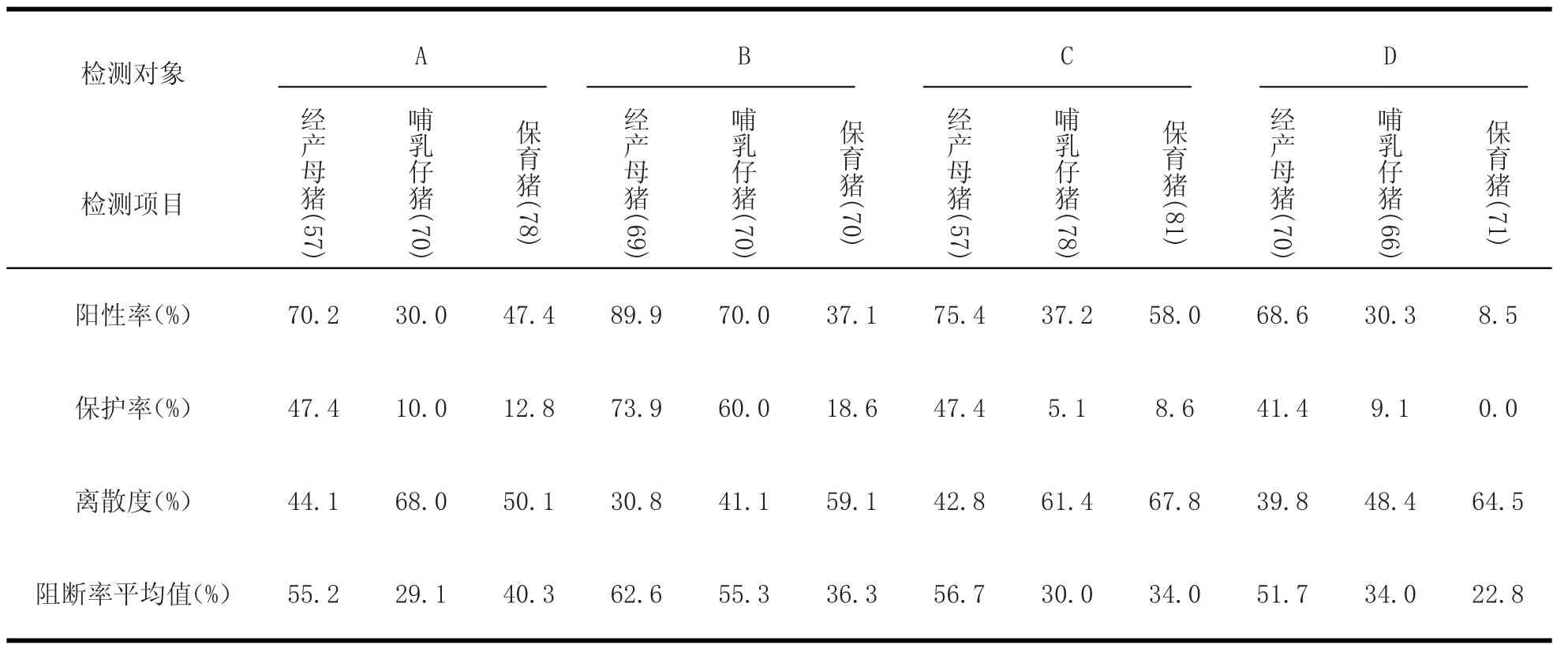
表2 4家猪场猪瘟抗体检测结果Tab le2 The CSFV antibody test resu lts o f four pig farm s
2 结果与分析
2.1 各猪场免疫程序 所选4家试验猪场免疫程序见表1。
2.2 4家猪场免疫效果评估及分析 对4家猪场进行分类普检猪瘟抗体水平并进行免疫效果综合评估,抗体检测结果见表2。
从表2可以看出,4家猪场猪瘟抗体水平均不合格,从高到低依次为B场、C场、A场、D场。主要表现在阳性率低,离散度大,阻断率平均值不达标。A场、C场和D场经产母猪没有达到理想效果,结合猪场生产状况来看,可能是其他疾病的存在,猪只生长状况欠佳,导致母猪群猪瘟免疫应答能力下降,同时蓝耳病的免疫抑制作用,也会抑制免疫抗体的产生[4]。C、D场可能是由于跟胎免疫工作不到位,漏免或者母猪空怀或流产时不列在免疫之内,从而导致抗体水平不一致。另外由于仔猪母源抗体水平与母猪抗体水平呈正相关[5],仔猪猪瘟母源抗体水平低,感染风险大。另外保育猪的抗体水平低是因为A场的生产状况原本不稳定,C、D场只有断奶时的一次免疫。B场猪瘟抗体水平较好,但仍未达到猪场内部所规定的标准。
2.3 免疫程序调整及分析 通过以上数据分析及结合生产实际情况,A、B场的商品猪免疫程序优化为超前免疫,28日龄第二次免疫,65日龄三次免疫。种猪群检测后普免猪瘟疫苗,20 d后再加强免疫;C、D场经产母猪猪瘟免疫方式调整为每年3、9月上旬普免。鉴于目前猪瘟抗体水平低下,为逐步过渡到普免免疫模式,立即将所有经产母猪普免一次猪瘟疫苗,2个月后再加强免疫一次。商品猪在65日龄增加1次猪瘟免疫。如果多次免疫抗体仍为阴性者,及时淘汰。同时做好生物安全工作,严禁并群等应激因素,适当进行药物保健。详细调整情况见表3。
2.4 免疫程序调整后的猪瘟抗体水平及分析 免疫程序调整后30 d左右,再次进行猪瘟抗体水平检测,检测结果见表4。
通过检测结果显示,4家猪场经过第一次抗体检测后的免疫程序优化及加强免疫等措施,猪场的猪瘟抗体水平除了B场哺乳仔猪以外,在上一次抗体检测的基础上都得到了有效改善(见表4),但猪瘟抗体水平仍不够理想,经产母猪抗体水平虽然达到了85%以上,且离散程度较低;但A场和C场离理想标准还有一段距离;A场哺乳仔猪和保育猪的阳性率依旧很低,B、C和D场的哺乳仔猪和保育猪抗体水平比较理想。
3 讨论

表3 免疫程序调整Table3 Imm unization schedule adjustment
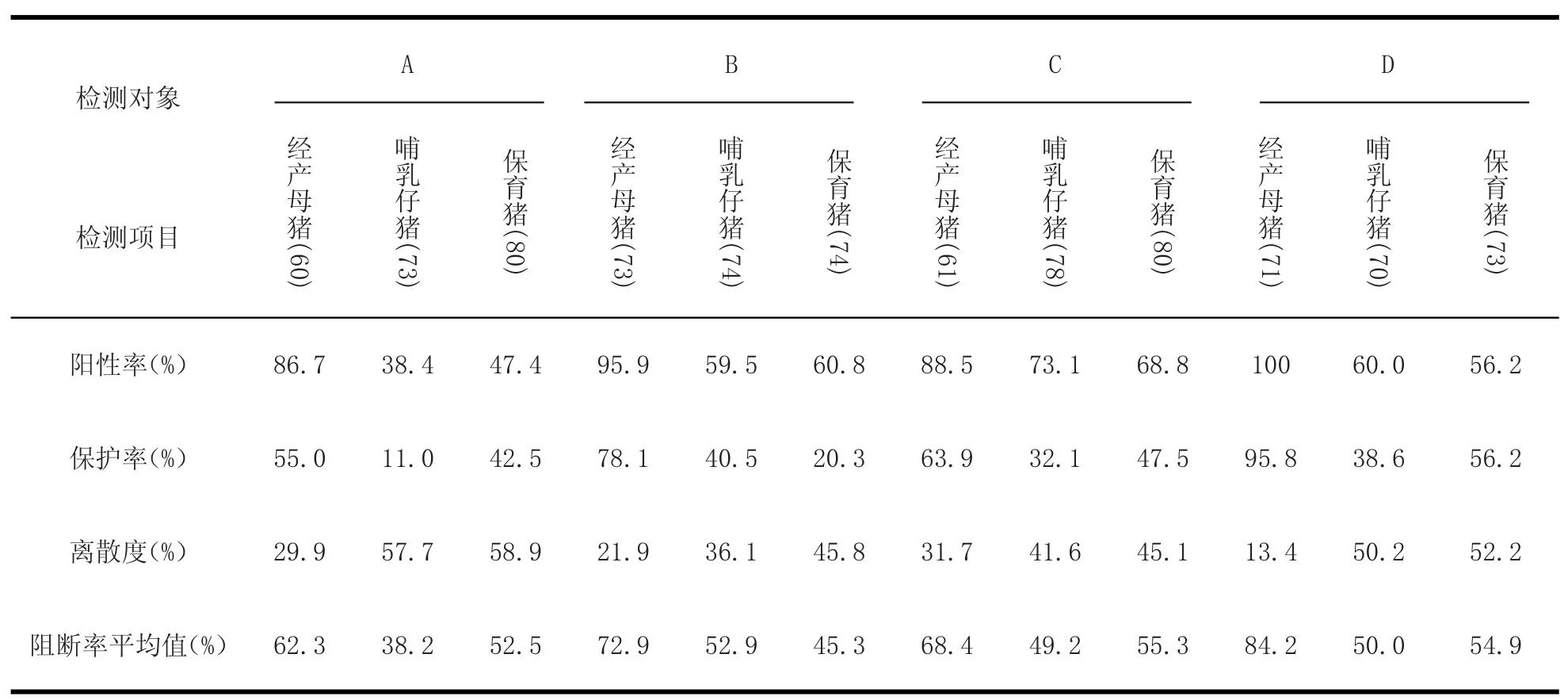
表4 免疫程序调整后的猪瘟抗体水平Table4 Leve ls of CSFV antibody after Imm une adjustm ent
加强普免后,经产母猪群某些猪只抗体水平仍未达到理想状态,对于多次免疫后抗体水平仍处于低下的母猪群应考虑予以淘汰。B场经产母猪瘟抗体水平能够稳定维持在理想状态。C场和D场猪瘟抗体水平也基本符合场内标准,可按照原有免疫程序执行。同时猪场应加强普免的管理和督促以及仔猪关键点的保健工作,落到实处。因为,免疫抗体评估和免疫程序调整是一个持续而长期的工作,要不断摸索,找到适合自己的免疫方案,避免盲目被动免疫的情况。
对于超前免疫存在很多争议,由于超前免疫措施的难操作性,在生产实际中不提倡采取超前免疫,但在母猪瘟抗体水平较低的情况下仔猪选择超前免疫却是比较合理有效的措施,因此当抗体水平控制到理想状态后应免去超前免疫。跟胎免疫是否可行也要根据猪场实际情况而定。目前,猪瘟免疫程序研究基本已成熟,规模猪场均可根据自身的生产情况制定合理有效的免疫程序,甚至很多猪场已经采取猪瘟净化措施。
在血清学抗体检测应用的过程中,必须合理选择抗体检测时间并结合生产实际来分析抗体检测结果,检测时间和对象不同,体现的意义和作用也不一样,例如,可以根据仔猪母源抗体水平检测来确定首次免疫时间。另外,免疫后各种疫苗的特性不同导致其在猪体内产生抗体的时间也存在某些差异,不宜过早或过迟进行抗体检测,一般在免疫后28~35 d进行疫苗抗体检测[6]。同时应该根据阳性率、离散度、猪瘟阻断率平均值等各项指标结合猪场生产实际情况来进行分析,不能单凭某一项指标来判定猪群的抗体水平。猪瘟抗体水平检测作用主要体现在了解猪群免疫状态、实时订制合理的免疫程序。但在猪瘟防控方面,应结合猪瘟病原检测,及时识别和淘汰带毒种猪,达到逐步净化猪瘟的目的,是未来猪瘟净化的一个趋势。
[1]HansonRP.Origin of hog cholera[J].J Am Vet Med Assoc,1957,131(5)∶211-218.
[2]OIE.Manual of Diagnostic Tests and Vaccines for Ter rest rial Animals[M].2011.
[3]刘志勇,韩庆安,刘乃强,等.规模养猪场主要疫病免疫效果评估模型的建立[J].中国兽医杂志,2011,47(7):88-90.
[4]李华,杨汉春,黄芳芳,等.猪繁殖与呼吸综合征病毒感染抑制猪瘟疫苗的免疫应答[J].中国兽医学报,2001, 21(3):219-221.
[5]杜喜忠,胡旭进,楼芳芳,等.猪瘟和猪高致病性蓝耳病母源抗体消长规律及疫苗免疫的干扰作用[J].浙江农业科学,2010,(5):1118-1120.
[6]徐静,邱文英,郭建宝,等.接种猪瘟疫苗后ELISA抗体反应规律[J].今日养猪业,2013,(2):14-18.
The classicalsw ine fever immune effectevaluation and ad justment immunization schedules for four scale pig farm s in hunan province
Wang Hui,Qiu Meizhen,Yang Jun,Du Li fei,Zhou Wangping,Fu Shengcai
(Hunan Institute of Animal Sciences&Veterinary Medicine,Hunan Changsha 410131)
In order to improve the immune ef fect and reduce the incidence of classical swine fever(CSF),this research select four scale pig farms to test the antibody level of CSF by ELISA detection technology,and then evaluate the immune ef fect.The resul ts showed that the detecting antibody levels were unquali f ied,In the four pig farms,the mul tiparity sows positive rate was 70.2%,89.9%,75.4%,68.6%respectively;The Lactation piglet positive rate was 30.0%,70.0%, 37.2%,30.3%;The nursery pig positive rate was 47.4%,37.1%,58.0%,8.5%.Then conduct supplementary immunization or adjust unreasonable immunization schedules and test the antibody level af ter 30 days.The resul ts showed that the detecting antibody levels were increased Signi f icant ly except the Lactation piglet of B,in the four pig farms,the mul tiparity sows positive rate was 86.7%,95.9%,88.5%,100.0%respectively;The Lactation piglet positive rate was 38.4%,59.5%, 73.1%,60.0%;The nursery pig positive rate was 47.4%,60.8%,68.8%,56.2%.Immune adjustment is reasonable.
Classical swine fever;Evaluation of immune ef fect;Adjustment of the immunization schedule
S858.28
1672-9692(2015)08-0052-06
2015-07-05
王慧(1988-),女,初级职称,硕士研究生,主要从事动物疫病防控工作。
