反转录病毒载体介导的P27kip1促HepG2细胞凋亡
2014-12-07潘永平邱梦标樊晓慧毛红霞熊水印粟庆娟
潘永平,龚 辉,邱梦标,樊晓慧,毛红霞,熊水印,粟庆娟
(南昌大学第四附属医院感染科,江西南昌330003)
肝细胞癌是人类最常见的恶性肿瘤之一,癌细胞的生物学特征是多种原癌基因的激活、抑癌基因的失活及一系列复杂的调控机制失常所致的生长失控。其主要分子机制是细胞周期紊乱和凋亡过少。P27kip1是一种细胞周期素依赖性激酶抑制剂,可将细胞阻滞于G1期,并诱导细胞凋亡,已经发现P27kip1在多种肿瘤组织中表达量降低[1],且在肿瘤细胞中,P27kip1减少的程度与细胞DNA损伤的程度有一定的关系[2]。因此,P27kip1途径可能成为肿瘤诊断[3]和治疗的新的靶点。
为了研究肝癌细胞中的P27kip1的表达情况,并考查外源导入P27kip1对肝癌细胞的影响,为基于P27kip1的肿瘤治疗研究提供理论依据,本实验构建了载有P27kip1基因的反转录病毒载体,筛选出了可稳定产生病毒的PA317包装细胞,构建了过表达P27kip1的 HepG2细胞,并检测了过表达 P27kip1对HepG2细胞的影响。
1 材料与方法
1.1 主要材料
pLNCX质粒、携带有人 P27kip1基因的 pUC18-P27质粒、DH5α菌种、PA317细胞、HepG2细胞由本实验室提供。质粒提取试剂盒(上海生工生物工程有限公司)。HindⅢ、ClaⅠ限制性内切酶、Taq酶(Promega公司),DMEM、FCS、胰蛋白酶、Lipofectamine-2000转染试剂盒、G418(Gibco公司)。鼠抗人P27kip1抗体(Santa Cruz公司)。
1.2 构建p LNCX-P27质粒
分别用HindⅢ及ClaⅠ酶切pUC18-P27质粒及pLNCX质粒,用T4连接酶将两者定向连接,转化DH5α感受态细菌,提取 pLNCX-p27质粒,经HindⅢ及ClaⅠ双酶切鉴定。
1.3 转染PA317细胞
采用脂质体介导法将15μL的重组pLNCX-p27质粒转染反转录病毒包装细胞 PA317,同时以空pLNCX载体作为对照组。转染48 h后,胰蛋白酶消化细胞,培养液中加入300μg/L G418进行筛选,每3~4 d换液1次,G418浓度逐渐增加至500μg/L,3周后获得稳定转染克隆。对稳定克隆扩大培养,部分冻存,部分继续在50 mL培养瓶中培养,细胞铺满后按1∶3的比例传代,并更换不含G418的培养液培养48 h,收集上清液,离心、0.22μm滤膜过滤后-70℃冰箱保存备用。
1.4 测定病毒滴度
检测前24 h传代 HepG2细胞,细胞生长达60%~70%汇合度时,取保存的病毒上清液加入无血清DMEM培养液,并以102、103和104倍稀释,稀释液分别加入HepG2细胞中,2.5 h后加入含有500μg/L G418及10%FCS的 DMEM培养液,每3~4 d换液1次,维持G418浓度不变,3周后计数抗性克隆数。病毒滴度=平均抗性克隆数×病毒液稀释倍数。
1.5 感染HepG2细胞
HepG2细胞以5×105个接种于250 mL培养瓶中,于37℃、5%CO2条件下培养,待细胞铺满瓶底约70%时,加入pLNCX-P27病毒悬液,另设对照组加入pLNCX空载体病毒液;同时加入聚凝胺至终浓度6 mg/L,继续培养24 h后按1∶5传代,24 h后加入G418至终浓度500 mg/L进行筛选,3周后对阳性细胞进行克隆化培养,建立HepG2-P27细胞系及对照组HepG2-pLNCX细胞系。
1.6 Western blot检测
裂解液破裂细胞,离心后取上清,检测总蛋白浓度,取50μg蛋白进行12%SDS-PAGE电泳,电泳之后电转移至硝酸纤维素膜上,加一抗于37℃孵育30 min,洗涤后加入辣根过氧化物酶标记的二抗于37℃孵育30 min,化学发光法显色拍照。
1.7 MTT
取生长状态良好的对数增殖期的细胞,设HepG2-P27细胞组、HepG2-pLNCX对照组和HepG2细胞空白对照组,每组24个复孔,常规消化记数后,用含10%胎牛血清的DMEM培养液调整细胞浓度至3×107按200μL每孔接种于96孔板,于37℃、5%CO2条件下培养,每3天换1次液。每24 h各取3个复孔进行检测,连续8 d。检测前4 h每孔加入MTT 20μL/孔,继续培养4 h后弃去培养液,加入二甲基亚砜100μL/孔,振荡15 min后,用酶标仪于490 nm波长下检测A490nm值。
1.8 流式细胞术检测细胞周期及细胞凋亡
HepG2-p27细胞及常规HepG2细胞各设置3个复孔,胰蛋白酶消化后收集细胞,用 PBS制成2×108/L的单细胞悬液,用FCM流式细胞仪进行PI单色荧光细胞流式计数,观察G1期、S期和G2期细胞所占百分数。用Annexin V/PI双染色法检测细胞凋亡情况。
2 结果
2.1 反转录病毒载体p LNCX-P27的构建
构建的含有 P27kip1基因的反转录病毒载体pLNCX-P27,经HindⅢ、ClaⅠ酶切,可出现594 bp的条带(图1),证明目的基因插入正确,载体构建成功。
2.2 病毒滴度检测
收集包装细胞产生的病毒液,计算pLNCX-P27病毒液滴度为2.9×104CfU/mL,对照组pLNCX空载体病毒液滴度为3.2×104CfU/mL。
2.3 Western blot结果
HepG2-P27组细胞中可高表达P27kip1蛋白,而空载体病毒及HepG2空白对照组中仅有微量P27kip1蛋白表达(图2),证明构建的反转录病毒pLNCX-P27可将P27kip1基因导入细胞并在细胞内高表达。
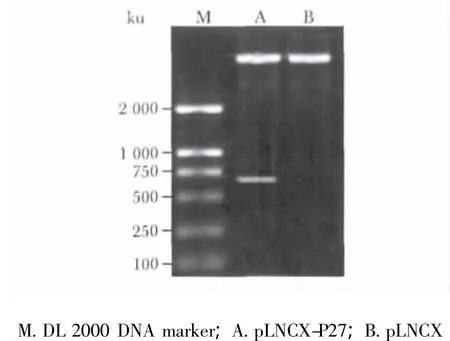
图1 p LNCX-P27质粒HindⅢ/ClaⅠ双酶切鉴定Fig 1 pLNCX-P27 vector digested by HindⅢand ClaⅠ

图2 P27kip1在HepG2中的表达Fig 2 Expression of P27kip1 in HepG2
2.4 P27kip1对Hep G2细胞形态的影响
正常HepG2细胞生长旺盛,镜下可见较多分裂相,细胞倍增快;而实验组细胞与对照组相比,增生效慢,且出现较多凋亡细胞:细胞体积明显缩小,胞核固缩,胞质中有空泡形成(图3)。
2.5 P27kip1对Hep G2生长速度的影响
与pLNCX空质粒组相比,pLNCX-P27组可明显抑制HepG2细胞的增长(p<0.01),而pLNCX组与HepG2空白对照组无差异(图4)。
2.6 P27kip1对Hep G2细胞周期的影响
导入P27kip1基因的HepG2-P27组处于G1期的细胞明显高于对照组(p<0.01),而处于S期的细胞显著减少(p<0.01)(图5)。
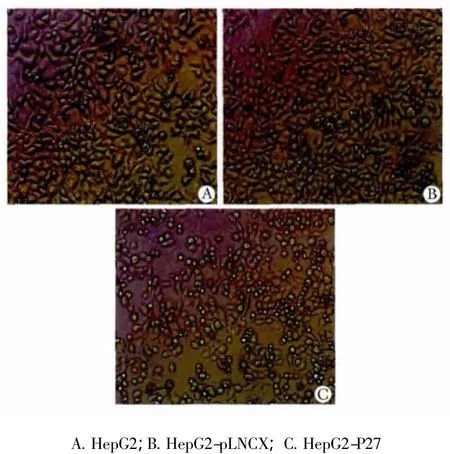
图3 P27kip1对HepG2生长形态的影响Fig 3 Effect of P27kip1 on Hep G2 morphology(×100)
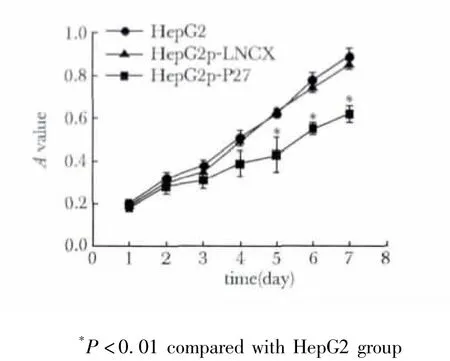
图4 P27kip1对HepG2生长速度的影响Fig 4 Effect of P27kip1 on HepG2 growth
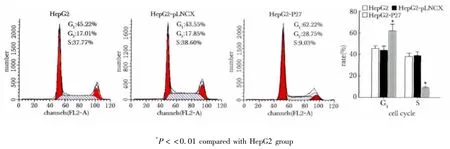
图5 P27kip1对Hep G2细胞周期的影响Fig 5 Effect of P27kip1 on the cell cycle of Hep G2

图6 P27kip1对Hep G2细胞凋亡的影响Fig 6 Effect of P27kip1 on apoptosis of Hep G2
2.7 P27kip1对HepG2细胞凋亡的影响
HepG2空白对照组、HepG2-pLNCX对照组与HepG2-P27三组细胞的凋亡比率依次为(6.32±1.16)%,(6.90±0.93)%和(27.85±4.42)%,空白对照组与空质粒对照组之间无统计学差别,导入P27kip1基因的 HepG2-P27组则明显高于对照组(p<0.01)(图6)。
3 讨论
肿瘤细胞的永生化和分裂失控是肿瘤细胞恶性增生的根本原因,而细胞周期调节蛋白在正常细胞的生长和肿瘤的发生发展中起着重要的作用。真核细胞的细胞周期由一系列的细胞周期素(cyclins)和细胞周期素依赖性激酶(cyclin dependent kinases,CDKs)的有序激活和失活调控,而细胞周期素依赖性激酶抑制剂(cyclin-dependent-kinase inhibitors,CKIs)是细胞周期负性调控因子[4]。P27kip1是 CKIs的主要成分之一,主要抑制细胞周期蛋白E-CDK2和细胞周期蛋白D-CDK4等G1期激酶复合物,使细胞不能通过G1期,并诱导细胞凋亡。人为地减少P27蛋白的表达,可使正常细胞出现恶性倾向[5],而增加其表达则可使某些肿瘤细胞恶性表现逆转。
本实验构建了含人P27kip1的重组反转录病毒载体,导入 PA317细胞,筛选出了稳定产生病毒的PA317-P27细胞,并用病毒成功感染HepG2细胞,经克隆化培养,成功建立了过表达P27kip1的肝癌细胞模型,并证实过表达的P27kip1将细胞阻滞于G1期,并通过诱导细胞凋亡等机制抑制 HepG2的生长。
[1]Rohlfing AK,Trescher K,Hahnel J,et al.Partial hepatectomy in rats results in immediate down-regulation of P27kip1in residual liver tissue by transcriptional and post-translational processes[J].Front Physiol,2013,4:139 -148.
[2]Ranchal I,Gonzalez R,Bello RI,et al.The reduction of cell death and proliferation by p27(Kip1)minimizes DNA damage in an experimental model of genotoxicity[J].Int JCancer,2009,125:2270-2280.
[3]Abdou A,Kandil M,El-Wahed MA,et al.The diagnostic value of p27 in comparison to p57 in differentiation between different gestational trophoblastic diseases[J].Fetal Pediatr Pathol,2013,32:162-164.
[4] Belletti B,Baldassarre G.New light on p27(kip1)in breast cancer[J].Cell Cycle,2012,11:3701-3702.
[5]Maass JC,Berndt FA,Canovas J,et al.P27kip1knockdown induces proliferation in the organ of corti in culture after efficient shRNA lentiviral transduction[J].JAssoc Res Otolaryngol,2013,14:295-299.
