自噬抑制剂促进缺氧诱导的大鼠乳鼠心肌细胞凋亡
2014-12-07王路乔黄茶花程晓曙
王路乔,黄 波,黄茶花,王 伶,程晓曙*
自噬(autophagy)是将细胞内受损、变性或衰老的蛋白质以及受损细胞器运输到溶酶体进行消化降解的过程,是一种广泛存在的正常生理过程和防御机制。体内外实验均证实心肌缺血缺氧都能诱发细胞自噬发挥心肌保护作用[1-2]。然而,缺氧过程诱发自噬增强是否能通过下调促凋亡蛋白Bim和caspase-3表达,抑制凋亡从而发挥心肌保护作用呢?目前这一机制还不十分明确。另外,近年来研究证实缺氧或缺血过程中自噬的诱导激活涉及到低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)的调控[3],那么缺氧过程自噬的心肌保护作用是否与HIF-1的调控有关呢?
1 材料与方法
1.1 SD大鼠乳鼠心肌细胞分离与培养
新生1~3 d Spradgue-Dawley乳鼠(南昌大学动物科学实验部),75%乙醇浸泡数秒后,取出心脏剥除心外膜及多余组织,剪成1.0 mm×1.0 mm×1.0 mm大小的组织块,0.08%胰蛋白酶和10%胶原酶37℃ CO2培养箱中消化2 h,离心重悬细胞,200目滤网过滤后差速贴壁2 h,将细胞悬液接种于培养皿中。24 h后第1次换液,一般培养至第4天时进行实验,实验前给细胞换液。
1.2 缺氧模型建立及分组
将原代培养的心肌细胞置于缺氧盒中通入含95%N2,5%CO2的混合气体30 min驱除缺氧小盒中的空气后,转移至培养箱中,分别缺氧0、2、4、8、14和24 h,取LC3-Ⅱ/Ⅰ(自噬标志物)表达显著增高时间点的细胞,缺氧前1 h加入终浓度为10 mmol/L的3MA预处理心肌细胞抑制自噬过程,即缺氧+3MA(anoxia+3MA)组,同时设立对照组(control)和单纯缺氧组(anoxia)。
1.3 药物及试剂
3-甲基腺嘌呤(3MA)(Sigma公司)。兔来源Bim(Cell singaling公司),caspase-3(Santa Cruz公司),HIF-1(Proteintech 公司),兔抗鼠的 β-actin,辣根过氧化物酶标记的山羊抗兔IgG(中杉金桥生物公司),化学发光剂(Thermo Scientific公司)。
1.4 细胞搏动频率、异常节律和乳酸脱氢酶LDH活性的检测
倒置显微镜下连续观察60 s,评测各组心肌细胞搏动频率和节律的变化。取各组中培养液500μL,南昌大学第二附属医院检验科测定乳酸脱氢酶LDH活性。
1.5 Western blot蛋白印迹
收集各组心肌细胞,总蛋白提取试剂盒提取各组细胞总蛋白。13%凝胶SDS-PAGE分离蛋白,电泳结束后转膜,5%脱脂奶粉室温封闭1 h,加入5%牛血清白蛋白稀释的兔抗Bim多克隆抗体(1∶1 000)4℃孵育过夜,caspase-3多克隆抗体(1∶1 000),HIF-1 多克隆抗体(1∶800),再加入辣根过氧化物酶标记的小鼠抗兔IgG(1∶5 000)杂交1 h。ECL显色液显色,胶片曝光,ImageTool分析软件对目的条带进行灰度值分析。
1.6 统计学分析
2 结果
2.1 各缺氧时间点心肌细胞自噬程度的变化
LC3-Ⅱ/Ⅰ反映自噬程度[2]。缺氧 8 h 后LC3-Ⅱ/Ⅰ较对照组显著升高(p<0.05),缺氧24 h后 LC3-Ⅱ/Ⅰ最大 (图1,表1)。
2.2 抑制自噬后心肌细胞搏动频率、异常节律和LDH活性的变化
正常心肌细胞搏动频率相近,节律规整;缺氧8 h后细胞搏动频率下降,幅度减弱,异常搏动增加。抑制自噬后细胞搏动频率显著降低,异常搏动增加,极不规律,且LDH活性明显增加(p<0.05)(表2)。
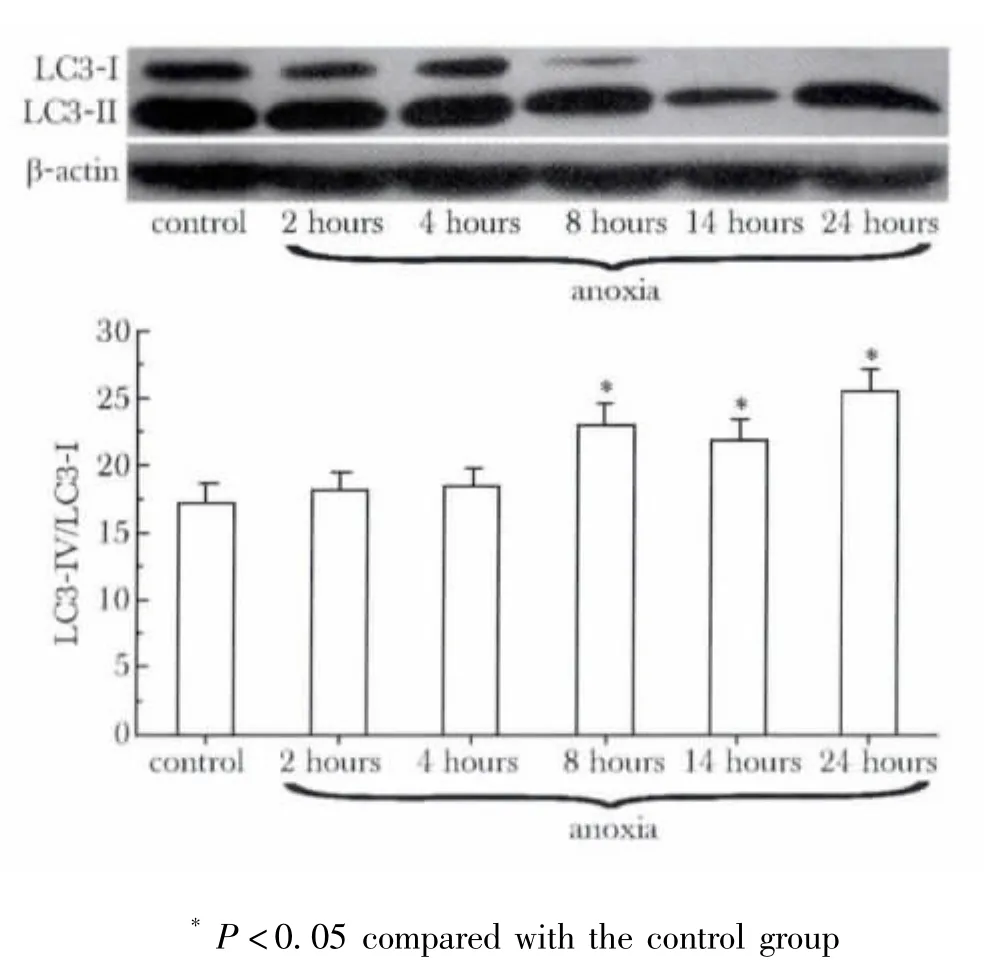
图1 缺氧模型中不同时间点心肌细胞自噬程度的变化Fig 1 Changes of degree of autophagy in anoxia model in cardiac myocytes for different times
表1 缺氧模型中不同时间点LC3-Ⅰ和LC3-Ⅱ的吸光度值Table 1 The average optical density(A)value in anoxia model in cardiac myocytes for different times,n=3)

表1 缺氧模型中不同时间点LC3-Ⅰ和LC3-Ⅱ的吸光度值Table 1 The average optical density(A)value in anoxia model in cardiac myocytes for different times,n=3)
*P < 0.05 compared with control.
anoxia 2 hours 4 hours 8 hours 14 hours 24 hours LC3-ⅠAOD value control 10±0.5 8±0.3 9±0.1 3±0.1 1±0.1 1±0.1 LC3-Ⅱ 25±1 24±1 24±1 23±1* 10±1* 18±1*
表2 各组心肌细胞搏动频率和异常节律的变化Table 2 The changes of beating rate and arrhythmin cardiac myocytes,n=3)

表2 各组心肌细胞搏动频率和异常节律的变化Table 2 The changes of beating rate and arrhythmin cardiac myocytes,n=3)
*P <0.05 compared with control;#p<0.05 compared with anoxia.
group beating rate(times/min)arrhythm of cells(times/min)LDH(U/L)control 185±5 7±2 81±12 anoxia 103±7* 18±3* 146±20*anoxia+3MA 45±6# 50±6# 210±29#
2.3 Western blot检测各组中 LC3-Ⅱ/Ⅰ、Bim、caspase-3和HIF-1的表达情况
缺氧后 LC3-Ⅱ/Ⅰ较对照组明显增强(p<0.05);自噬抑制后LC3-Ⅱ/Ⅰ较单纯缺氧组明显减弱(P <0.05)(图2,表3)。
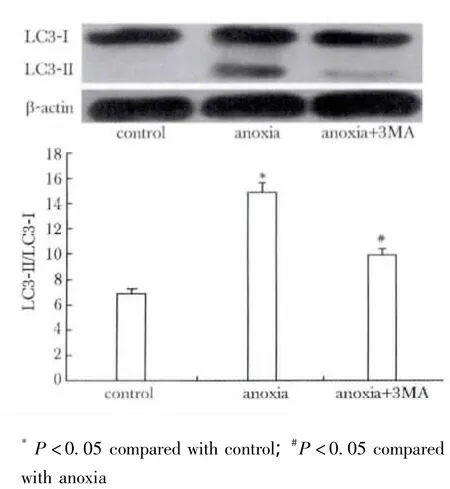
图2 3MA抑制缺氧诱导的自噬Fig 2 3MA inhibits autophagy induced by anoxia
表3 各组中LC3-Ⅰ和LC3-Ⅱ的吸光度值Table 3 The average optical density(A)value in control,anoxia and anoxia+3MA group,n=3)

表3 各组中LC3-Ⅰ和LC3-Ⅱ的吸光度值Table 3 The average optical density(A)value in control,anoxia and anoxia+3MA group,n=3)
*P <0.05 compared with control;#P <0.05 compared with anoxia.
expression of protein control anoxia anoxia+3MA LC3-Ⅰ20±2 22±3 21±2 LC3-Ⅱ 2±0.1 9±0.3* 5±0.1#
缺氧后促凋亡蛋白Bim和caspase-3表达较对照组显著上调(p<0.05),而抑制自噬后Bim和caspase-3表达较单纯缺氧组显著增加(p<0.05);缺氧刺激显著上调HIF-1表达(p<0.05),抑制自噬后HIF-1表达较单纯缺氧组明显下降。(图3)。
3 讨论
自噬是维持自稳、保证生存的重要生理过程之一,自噬在缺血性心脏病中的作用一直是研究探索的热点。本实验成功构建了心肌细胞缺氧模型,缺氧8 h自噬显著增强。研究表明缺血诱导的自噬具有心肌保护作用。例如,大鼠急性心肌缺血模型中,电镜下观察到缺血心肌组织中有自噬泡形成,增强自噬后心肌梗死面积显著减少,并在梗死边缘存活的心肌组织内看到大量自噬泡[4],其可能机制是:缺血导致AMP/ATP比值升高激活AMPK,降解无功能的蛋白质、脂肪酸等物质为细胞提供营养和能量[5];也有研究证实可能是自噬增强后清除受损线粒体减少Cytc释放,从而延迟或者抑制凋亡,发挥心肌保护作用[6]。
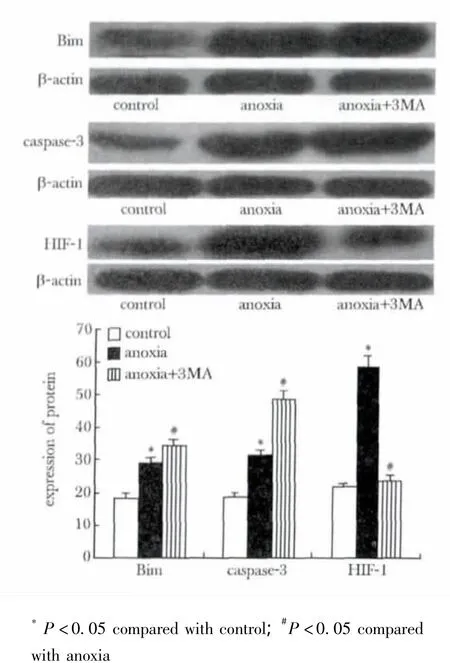
图3 各组中促凋亡蛋白Bim、caspase-3和HIF-1的表达Fig 3 The protein expression of Bim,caspase-3 and HIF-1 in control,anoxia and anoxia+3MA group
然而,很少有研究探索缺氧过程中自噬的心肌保护作用与下调促凋亡蛋白Bim和caspase-3表达抵抗凋亡有关。在心肌细胞中,主要涉及到受体介导的外凋亡途径和线粒体介导的内凋亡途径[7-8]。Bim属于BCL-2家族中的一员,作为促凋亡蛋白介导线粒体凋亡途径[9]。caspase属半胱氨酸-天冬氨酸蛋白酶家族,是内外凋亡途径的交汇点,其中caspase-3则是凋亡的最终执行者[10]。3-甲基腺嘌呤(3-Methyladenine,3MA)是一种广泛运用的自噬抑制剂[1],本实验中3MA显著抑制缺氧诱发的自噬,这一结果也支持先前的研究[11]。本研究表明,缺氧诱发自噬下调促凋亡蛋白Bim和caspase-3表达发挥抗凋亡作用,而一旦抑制自噬后显著减弱这种自噬的心肌保护作用。
此外,本实验进一步探索了缺氧诱导自噬发挥抗凋亡作用中,HIF-1的正调控作用。HIF-1是一种在缺氧缺血过程中由低氧刺激激活的转录因子。先前的研究证实,在肾脏、脑组织和癌细胞中,HIF-1都能调控缺氧诱导的自噬,其可能机制是HIF-1能介导BCL-2和BNIP3相互作用,导致选择性的线粒体自噬,或者通过抑制m-TOR诱发自噬[12]。本研究证实,HIF-1正调控大鼠乳鼠心肌细胞缺氧诱导的自噬发挥抗凋亡作用,而这一心肌保护机制有望成为缺血性心脏病治疗的一个新靶点。但心肌缺血过程中HIF-1精细调控细胞自噬的机制及其上游信号调控分子还不十分明确,我们在下一步将进行更具体的研究和探索。
[1] Nishida Y,Arakawa S,Fujitani K,et al.Discovery of Atg5/Atg7-independent alternative macroautophagy[J].Nature,2009,461:645 -658.
[2]Przyklenk K,Undyala VV,Wider J,et al.Acute induction of autophagy as a novel strategy for cardioprotection:getting to the heart of the matter[J].Autophagy,2011,7:432-433.
[3]Zhang H,Bosch-Marce M,Shimoda LA,et al.Mitochondrial autophagy is an HIF-1-dependent adaptive metabolic response to Anoxia[J].JBiol Chem,2008,283:10892-10903.
[4]Zhang J L,Lu J K,Chen D,et al.Myocardial autophagy variation during acute myocardial infarction in rats:The effects of carvedilol[J]. Chin Med J,2009,122:2372-2379.
[5]Busss J,Riffel Jh,Katusha,et al.Augmentationof autophagy by mTOR-inhibition in myocardial infarction:When sizematters[J].Autophagy,2010,6:304 -306.
[6]Mccormick J,Suleman N,Scarabelli TM,et al.STAT1 deficiency in the heart protects against myocardial infarction by enhancing autophagy[J].J Cell Mol Med,2012,16:386-393.
[7]戴日新,李浪.心肌细胞凋亡信号传导通路与心肌损伤[J].基础医学与临床,2010,30:775-777.
[8] Crow MT,Mani K,Nam YJ,et al.The mitochondrial death pathway and cardiac myocyte apoptosis[J].Circ Res,2004,95:957-70.
[9]Youle,RJ,Strasser A.The BCL-2 protein family:opposing activities that mediate cell death[J].Nat Rev Mol Cell Biol,2008,9:47 -59.
[10]Stennicke HR,Salvesen GS.Caspases-controlling intracellular signals by protease zymogen activation[J].Biochim Biophys Acta,2000,1477:299-306.
[11]Zhang Zl,Fan Y,Liu Ml.Ginsenoside Rg1 inhibits autophagy in H9c2 cardiomyocytes exposed to Anoxia/reoxygenation[J].Mol Cell Biochem,2012,365:243-250.
[12]Pouyssegur J,Dayan F,Mazure NM.Anoxia signalling in cancer and approaches to enforce tumour regression[J].Nature,2006,441:22-45.
