1α,25(OH)2 D3通过阻滞细胞周期抑制胃癌细胞系增殖
2014-12-07郭利华邵晓娜朱华陀陈文果虞朝辉陈李华
郭利华,邵晓娜,朱华陀,陈文果,李 岚,虞朝辉,陈李华
(浙江大学医学院附属第一医院消化内科,浙江杭州310003)
1α,25(OH)2D3对多种肿瘤细胞具有潜在的抗增殖作用,流行病学以及细胞体外实验研究结果发现活性维生素D3可以调节结肠癌、乳腺癌、前列腺癌细胞周期、细胞侵袭、诱导细胞凋亡、促进细胞分化的作用[1-3]。1α,25(OH)2D3的目的基因包括细胞周期调节因子P21、P27、cyclins、细胞间黏附、侵袭抑制因子以及编码细胞骨架蛋白等[4]。本研究的目的是观察1α,25(OH)2D3对胃癌细胞增殖、细胞周期的影响,阐述1α,25(OH)2D3发挥抗增殖作用的分子机制。
1 材料与方法
1.1 实验材料
人胃癌细胞系BGC-823和SGC-7901细胞(中国科学院上海细胞库);RPMI 1640培养基、0.25%胰蛋白酶和澳洲胎牛血清(Gibco公司);1α,25(OH)2D3、MTT和DMSO(Sigma公司);Trizol、PI染料和 RNA酶(Sangon公司);PrimeScriptTMRT Master Mix和SYBR® PrimeScriptTM(Takara公司)。
1.2 细胞培养
采用含10%牛血清的RPMI 1640培养基培养BGC-823、SGC-7901人胃癌细胞系,在37℃,含5%CO2、湿度100%恒温孵育箱中培养。2~3 d后,加2 mL 0.25%胰蛋白酶消化3 min,加等体积的培养液终止消化,1 000×g离心5 min。
1.3 MTT细胞增殖检测
细胞以2 000个/孔种植于96孔板,4 h后,各组细胞加入不同浓度的1α,25(OH)2D3(1 ×10-10、1×10-9、1×10-8和 1 ×10-7mol/L)并设置阴性对照,每组4个复孔。细胞培养72 h后,每孔加20μL的MTT(5 g/L),培养箱中继续培养4 h;吸取上清,每孔加150μL DMSO,室温下摇床上摇晃10 min,用酶标仪检测490 nm的A值。计算生长抑制率=[(A实验组-A对照组)/A对照组]×100%。
1.4 细胞周期检测
将BGC-823和SGC-7901细胞用无血清的培养基以(4~5)×105个/孔铺于6孔板,24 h后更换含10%胎牛血清的培养基,加入终浓度为100 nmol/L的1α,25(OH)2D3,对照组加入等量的 RPMI1640培养基,继续培养72 h。细胞用0.5%胰蛋白酶消化,接着用PBS洗2次,每次1 000×g离心5 min;弃上清后用预冷的70%乙醇固定,4℃过夜;离心除去乙醇,PBS洗涤2次,然后加5uL的RNA酶(5 g/L),室温下处理15 min;每管加5μL的PI(5 g/L)染料,室温避光孵育30 min;1 h内流式检测。应用ModFit LTTM软件分析细胞周期结果。
1.5 RT-qPCR
将BGC-823和SGC-7901细胞铺于6孔板,实验组加100 nmol/L 1α,25(OH)2D3继续培养,72 h之后,吸去培养基,每孔加1 mL Trizol(BBI)抽提Total RNA,采用NanoDrop® ND-2000测定RNA浓度和纯度,根据RNA浓度结果将各组调成一致的浓度,再应用 RT试剂(Takara)将 RNA反转录成cDNA。定量PCR引物如下:内参GAPDH引物:上游 5'-TCAACGACCACTTTGTCAAGCTCA-3',下游 5'-GCTGGTGGTCCAGGGGTCTTACT-3';P21引物:上游5'-AGGAAGACCATGTGGACCTGTCAC-3',下游 5'-A CCAAATGCGTGTCCTCAGAGT-3';cyclin E1引物:上游 5'-GCAGTATCCCCAGCAAATC-3',下游 5'-TCAA GGCAGTCAACATCCA-3';cyclin D1引物:上游5'-GCTGTGCATCTACACCGACAACTC-3',下游 5'-AGG TTCCACTTGAGCTTGTTCACC-3';CDK6引物:上游5'-ATATCTGCCTACAGTGCCCTGTCTC-3',下游 5'-G TGGGAATCCAGGTTTTCTTTGCAC-3'。定量PCR反应条件是:95℃预热2 min,95℃解链10 s,扩增:40循环95℃/10 s,60℃/34 s,72℃/15 s;扩增反应结束后,按95℃/10 s;60℃/60 s;95℃/15 s的反应条件建立PCR产物熔解曲线;数据采用2-△△CT法进行分析。
1.6 统计学分析
实验数据采用SPSS16.0软件分析,计量资料以均数±标准差表示,不同浓度间比较采用方差分析,多组间比较采用LSD分析。
2 结果
2.1 1α,25(OH)2D3 抑制 BGC-823、SGC-7901增殖
1×10-10~1×10-7mol/L 的1α,25(OH)2D3对BGC-823和SGC-7901胃癌细胞增殖均具有一定的剂量依耐性,不同浓度的1α,25(OH)2D3对细胞增殖抑制作用程度不同,而且随浓度升高抑制作用逐渐增强。1×10-8和1×10-7mol/L对 BGC-823和SGC-7901细胞增殖抑制率高于1×10-10mol/L(p<0.05)(表1)。
2.2 1α,25(OH)2D3对胃癌细胞周期的影响
10-7mol/L 1α,25(OH)2D3干预胃癌细胞系72 h之后,流式细胞术 (flow cytometry,FCM)检测细胞周期分布情况,G0/G1期细胞比例较对照组明显增加(p<0.05),S期细胞比例下降(p<0.05),G2/M期细胞比例减少(p<0.05)(表2,图1)。
2.3 RT-qPCR检测1α,25(OH)2 D3对细胞周期相关基因表达的影响
1×10-7mol/L 1α,25(OH)2D3处理 BGC-823和SGC-7901胃癌细胞72 h后,P21 mRNA表达升高,而cyclin D1、cyclin E1和CDK6 mRNA表达降低(p<0.05)(图2)。
3 讨论
1α,25(OH)2D3是维生素D最主要的活性形式,近年来的流行病学研究数据表明血清25OHD水平与一些恶性肿瘤发病率呈负相关[5];而且大量体外细胞实验研究证明,1α,25(OH)2D3对多种肿瘤细胞的增殖、分化、凋亡等活动具有一定程度地调节作用[6]。1α,25(OH)2D3结合到维生素 D 受体VDR,激活的VDR与维甲酸X受体(Retinoid X Receptor,RXR)形成VDR/RXR共因子,它结合到目的基因维生素D反应元件启动子区调节基因转录[7]。
表1 MTT法检测1α,25(OH)2 D3对胃癌细胞增殖的影响Table 1 The effect of 1α,25(OH)2D3 on gastric cancer cells proliferation was detected via MTT assay,n=3)
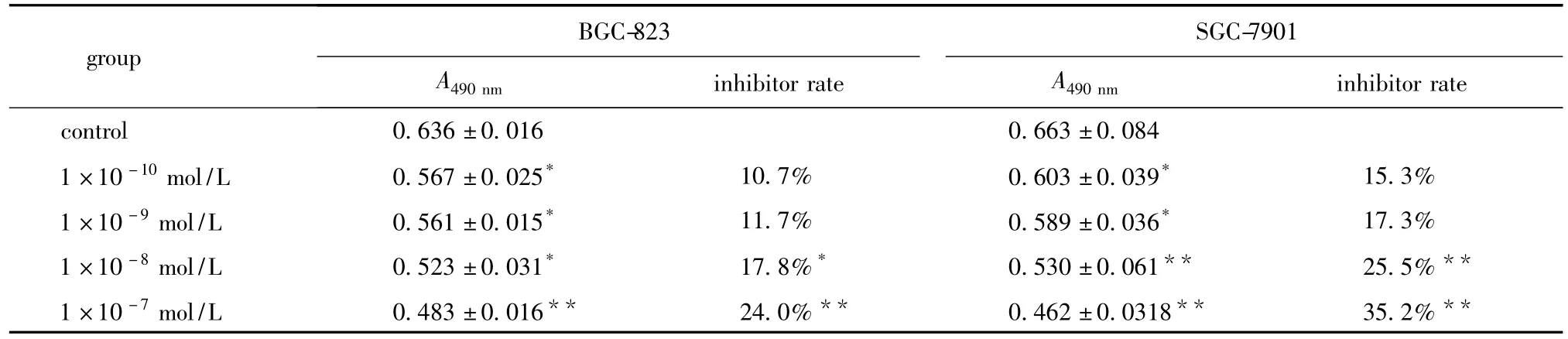
表1 MTT法检测1α,25(OH)2 D3对胃癌细胞增殖的影响Table 1 The effect of 1α,25(OH)2D3 on gastric cancer cells proliferation was detected via MTT assay,n=3)
*P <0.05,**P <0.01 compared with control group.
BGC-823 group SGC-7901 A490 nm inhibitor rate A490 nm inhibitor rate control 0.636±0.016 0.663±0.084 1×10-10 mol/L 0.567±0.025* 10.7% 0.603±0.039* 15.3%1×10-9 mol/L 0.561±0.015* 11.7% 0.589±0.036* 17.3%1×10-8 mol/L 0.523±0.031* 17.8%* 0.530±0.061** 25.5%**1×10-7 mol/L 0.483±0.016** 24.0%** 0.462±0.0318** 35.2%**
,n=3)表2 1,25(OH)2 D3对细胞周期的影响Table 2 The effect of 1α,25(OH)2 D3 on cell cycle

,n=3)表2 1,25(OH)2 D3对细胞周期的影响Table 2 The effect of 1α,25(OH)2 D3 on cell cycle
*P <0.05 compared with control group.
cell lines group G0/G1 rate(%) Srate(%) G2/M rate(%)BGC-823 control 53.69±1.44 31.69±0.56 14.61±1.16 1,25D3 66.56±0.76* 24.17±1.25* 9.27±1.78*SGC-7901 control 69.38±0.64 23.14±0.96 7.48±0.87 1,25D3 77.29±1.33* 14.89±0.85* 8.49±0.79*

图1 流式检测1α,25(OH)2 D3对细胞周期的影响Fig 1 The effect of 1α,25(OH)2 D3 on the cell cycle was detected via Flow cytometry
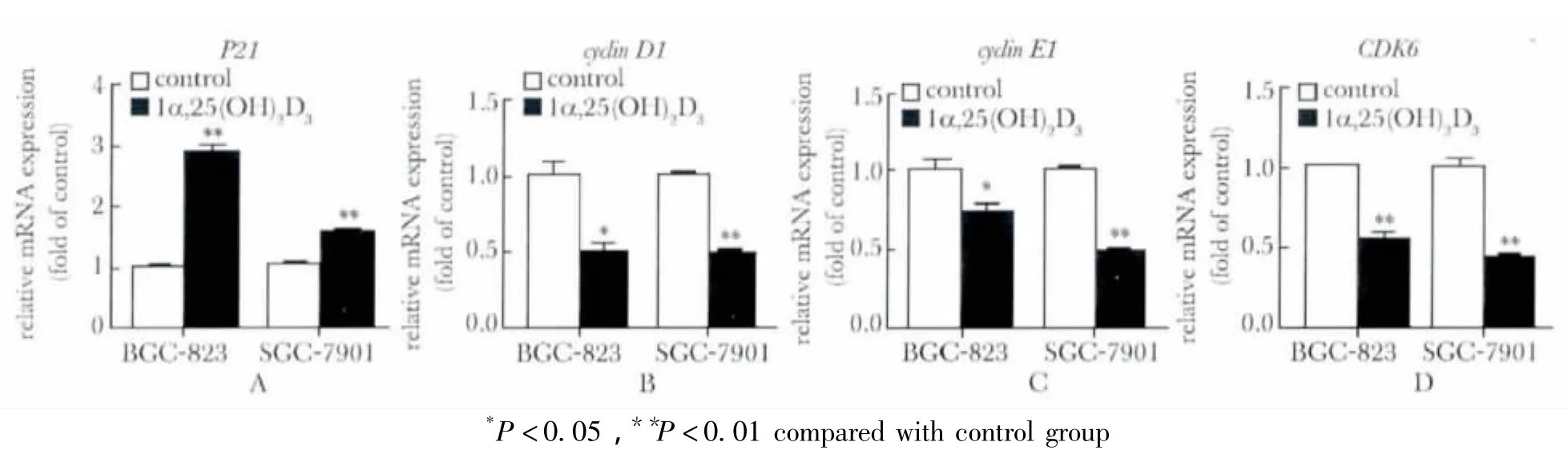
图2 1α,25(OH)2 D3对细胞周期相关基因mRNA表达的影响Fig 2 The effect of 1α,25(OH)2 D3 on cell cycle-related genes mRNA expression,n=3)
1α,25(OH)2D3显著性抑制胃癌细胞增殖,并呈现浓度依赖性,1α,25(OH)2D3引起 BGC-823、SGC-7901胃癌细胞G0/G1期细胞比例增加,S期细胞比例减少。细胞周期结果表明1α,25(OH)2D3使细胞主要分布于DNA静止期G0/G1期,阻止其进入S期,诱导细胞周期阻滞,结果导致细胞周期延长,从而使细胞增殖减慢。
细胞周期各个时期由不同细胞周期蛋白(cyclin)、周期蛋白依赖性激酶(cyclin-dependent kinases,CDK)、CDK 抑制蛋白(cyclin-dependent kinase inhibitor,CKI)来调控所调控。正常细胞中,cyclin Dl与CDK4/CDK6先结合形成复合体,CDK4/CDK6发挥激酶活性使pRb磷酸化[8],进入S期必需的转录因子 E2F从 Rb-E2F复合体中解离[9];这促进cyclin E积累而刺激CDK2活性,从而激活另一些转录因子,使与DNA合成有关的基因表达,细胞即由G1期进入 S 期[10]。细胞在 1α,25(OH)2D3干预下将降低细胞周期蛋白、细胞周期蛋白依赖性激酶表达阻碍细胞G1期进入S期[11]。除了周期蛋白和磷酸化对CDK活性进行调节外,CKI(如P2l)对CDK活性起负调控作用。P21能抑制包括cyclinE-CDK2在内的多种G1期Cyclin-CDK激酶活性,使细胞不能通过 G1期[12-14]。本研究中,胃癌细胞系 BGC-823、SGC-7901 在1α,25(OH)2D3干预后上调 CDK抑制蛋白P21 mRNA水平,下调周期蛋白cyclin D1、cyclin E1,下调周期蛋白依赖性激酶CDK6 mRNA水平,导致细胞阻滞于G1/S检测点,从而防止细胞过度增殖。
总之,本研究的结果提示1α,25(OH)2D3抗胃癌细胞增殖作用可能与其阻滞细胞周期、调节细胞周期相关蛋白表达有关。
[1]Sung V,Feldman D.1,25-Dihydroxyvitamin D3decreases human prostate cancer cell adhesion and migration[J].Mol Cell Endocrinol,2000,164:133 -143.
[2] Bessler H,Djaldetti M.1alpha,25-dihydroxyvitamin D3modulates the interaction between immune and colon cancer cells[J].Biomed Pharmacother,2012,66:428 -432.
[3]Lopes N,Sousa B,Martins D,et al.Alterations in Vitamin D signalling and metabolic pathways in breast cancer progression:a study of VDR,CYP27B1 and CYP24A1 expression in benign and malignant breast lesions[J].BMC Cancer,2010,10:483.
[4]Jensen SS,Madsen MW,Lukas J,et al.Inhibitory effects of 1alpha,25-dihydroxyvitamin D(3)on the G(1)-Sphasecontrolling machinery[J].Mol Endocrinol,2001,15:1370-1380.
[5]Peters U,Hayes RB,Chatterjee N,et al.Circulating vitamin D metabolites,polymorphism in vitamin D receptor,and colorectal adenoma risk[J].Cancer Epidemiol Biomarkers Prev,2004,13:546-552.
[6]Vuolo L,Di Somma C,Faggiano A,et al.Vitamin D and cancer[J].Front Endocrinol(Lausanne),2012,3:58.
[7]Carlberg C,Quack M,Herdick M,et al.Central role of VDR conformations for understanding selective actions of vitamin D(3)analogues[J].Steroids,2001,66:213 - 221.
[8]Deshpande A,Sicinski P,Hinds PW.Cyclins and cdks in development and cancer:a perspective[J].Oncogene,2005,24:2909-2915.
[9]Harbour JW,Dean DC.The Rb/E2F pathway:expanding roles and emerging paradigms[J].Genes Dev,2000,14:2393-2409.
[10]Coqueret O.Linking cyclins to transcriptional control[J].Gene,2002,299:35-55.
[11]Artaza JN,Sirad F,Ferrini MG,et al.1,25(OH)2vitamin D3inhibits cell proliferation by promoting cell cycle arrest without inducing apoptosis and modifies cell morphology of mesenchymal multipotent cells[J].J Steroid Biochem Mol Biol,2010,119:73 -83.
[12]Owa T,Yoshino H,Yoshimatsu K,et al.Cell cycle regulation in the G1phase:a promising target for the development of new chemotherapeutic anticancer agents[J].Curr Med Chem,2001,8:1487-1503.
[13]Polyak K,Lee MH,Erdjument-Bromage H,et al.Cloning of p27Kip1,a cyclin-dependent kinase inhibitor and a potential mediator of extracellular antimitogenic signals[J].Cell,1994,78:59 -66.
[14]Campanini F,Santucci MA,Brusa G,et al.Expression of P21(WAF1/CIP1/SID1)cyclin-dependent kinase inhibitor in hematopoietic progenitor cells[J].Gene,2001,273:173-180.
