PTEN对髓系白血病细胞VEGF及MMP表达的影响
2014-12-07成志勇王亚丽王凤云梁丽青谢旭磊
成志勇,王亚丽,王凤云,韩 英,谷 蕾,梁丽青,谢旭磊
浸润与转移是恶性肿瘤的重要生物学特征。血管内皮生长因子(vascular endothelial growth factor,VEGF)及金属基质蛋白酶(matrix metalloproteinase,MMP)相互影响、相互作用下,促进了肿瘤细胞的浸润及转移[1-2]。
PTEN(phosphatase and tensin hemology deleted on chromosome ten gene)基因是迄今为止发现的第一个编码蛋白具有蛋白磷酸酶及脂质磷酸酶双重活性的抑癌基因,PTEN低表达、缺失及突变等均可影响其抑制肿瘤生长、浸润和侵袭功能。其主要通过对细胞内多种信号传导通路的调控,参与抑制肿瘤细胞的侵袭、浸润及转移[3-4]。实验通过对髓系白血病细胞的研究,探讨PTEN对髓系白血病细胞中VEGF及MMP相互作用的影响。
1 材料与方法
1.1 研究资料与对象
1.1.1 主要试剂:反转录反应体系、SYBR Green Real Master Mix(北京天根);PTEN、VEGF鼠抗人单克隆抗体(Santa Cruz公司);明胶(石家庄博海)。
1.1.2 临床资料:慢性髓系白血病患者来源于保定市第一医院血液科及河北医科大学第二医院,符合WHO诊断标准。10例慢性期 CML患者(CMLCP),其中男6例,女4例,中位年龄为39岁(25~67岁);10例急变期CML患者(CML-BC),男5例,女5例。中位年龄为40岁(27~65);10例健康志愿者作为正常对照(NC)。所有患者均获得伦理委员会的审查批准,同时签署知情同意书。
1.1.3 腺病毒载体:含有野生型PTEN基因腺病毒(Ad-PTEN-GFP)和空载体腺病毒(Ad-GFP),在人胚肾细胞系293A细胞中进行扩增及滴度测定。
1.1.4 细胞系:人胚肾细胞系293A细胞用含10%胎牛血清高糖DMEM培养基培养,人慢性髓系白血病K562细胞用含10%胎牛血清的RPMI 1640培养基培养,细胞均在37℃,5%CO2的饱和湿度环境孵育。
1.2 方法
1.2.1 病毒转染:按感染复数(multiplicity of infection,MOI)为200,在100μL无血清培养液混合病毒液后,加入 K562细胞,37℃,5%CO2培养2 h,加入含10%胎牛血清RPMI 1640培养液继续培养,流式细胞仪检测表达绿色荧光蛋白细胞比例,并计算转染效率。
1.2.2 实时荧光定量PCR(FQ-RTPCR):收集以不同MOI转染3 d的K562细胞,PBS清洗2次备用。Trizol提取细胞总RNA,电泳鉴定、定量,反转录合成cDNA。SYBR反应体系共25μL,反应条件为94 ℃ 5 min、94 ℃ 45 s、60 ℃ 1 min,30 个循环,同时设空白对照。PCR反应前3~15个循环的荧光信号作为荧光本底信号,调节基线至适宜处,各荧光曲线与基线交叉点的循环数即为Ct值。根据公式△Ct=Ct目的基因- Ctβ-actin和△△Ct=2-△Ct,计算检测基因的mRNA相对表达量,每组重复3次并取平均值。所检测目的基因 PTEN、VEGF、MMP-2、MMP-9和β-actin的相关PCR引物序列见表1。
1.2.3 Western blot:收集各组细胞,每组1×107细胞,加入200μL预冷的蛋白裂解液4℃裂解1 h,冰浴下超声裂解15 min。4℃ 12 000 r/min离心20 min,上清用考马斯亮蓝测定蛋白浓度,置-20℃保存。取80μg样品蛋白质加入等体积上样缓冲液,经5%浓缩胶和10%SDS-PAGE凝胶电泳后,用水浴式电转仪转至硝酸纤维素膜上。经5%牛血清白蛋白37℃封闭1 h,分别加入小鼠抗人单克隆抗体(Santa Cruz,USA),4℃孵育过夜。TBS漂洗5 min×3次,加入山羊抗小鼠HRP标记二抗,37℃孵育1 h,TBS漂洗5 min×3次。化学发光法检测后分析结果。

表1 FQPCR扩增引物序列Table 1 Primer sequence of FQPCR
1.2.4 细胞生长抑制实验(MTT法):取100μL对数增殖期细胞,接种5 000个细胞/孔于96孔板,每组3个复孔。分为对照组、Ad-GFP组、Ad-PTENGFP 组,以 MOI=200,转染细胞。在培养后 0、2、3、4、5和7 d,不同时间点每孔加入噻唑蓝(MTT)溶液(5 g/L)10μL,37℃孵育4 h后离心弃培养液,另加入二甲基亚砜(DMSO)100μL振荡15 min,酶标仪检测每孔A490值,计算不同组对K562细胞生长抑制率,绘制生长抑制曲线。
1.2.5 细胞侵袭实验:将50 mg/L的Matrigel 4℃融化,用无血清RPMI 1640培养基将其1∶8稀释混匀。200μL包被Transwell小室聚碳酸脂膜上室面,4℃风干。
将不同组细胞加入无血清培养基孵育12 h。取1×105细胞加入800μL无血清培养基中,加入0.1%的牛血清白蛋白维持渗透压,放入transwell小室上层。下室加入含10%小牛血清的RPMI1640培养基1 000μL,孵育24h。取出Transwell小室,用下室培养液反复淋洗,将脱落及淋洗下来的细胞在倒置显微镜下计数荧光细胞数量。整个操作过程在冰上及无菌条件下进行并重复试验3次。
1.2.6 明胶酶谱检测 MMP-2,MMP-9:取15μL培养上清在非变性条件下进行SDS聚丙烯酰胺凝胶电泳(SDS-PAGE),80 mg/mL的聚丙烯酰胺凝胶中含2 mg/mL明胶。电泳结束,将凝胶置2.5%的Triton X-100中复性45 min,再置于孵育液(含50 mmol/L Tris/HCl pH 8.0,50 mmol/L NaCl,10 mmol/L CaCl2)37℃作用12 h。用0.5%考马斯亮蓝染色并用30%甲醇,10%乙酸脱色,胶上的亮带即为明胶酶活性部位。adobe photoshop软件分析条带。
1.3 统计学分析
所有数据用SAS 8.0统计软件分析处理,计量资料以均值±标准差)表示,进行方差分析、t检验、χ2检验及相关分析。
2 结果
2.1 PTEN、VEGF、MMP-2和 MMP-9 mRNA 在CML骨髓单个核细胞中的表达
在CML-BC中PTEN mRNA表达最低,与CMLCP及NC比较,表达水平有显著性差异(p<0.01),而后二者差异无显著性。
VEGF、MMP-2、MMP-9 mRNA 在 CML-BC 患者中表达水平均最高(p<0.05),其次为CML-CP,在NC中表达水平最低(表2)。
2.3 PTEN mRNA及蛋白检测
以MOI=200转染K562细胞72 h,流式细胞仪检测腺病毒感染K562细胞效率为(81.2±5.4)%(图1A)。

表2 PTEN、VEGF、MMP-2、MMP-9 mRNA在CML及对照组中的表达差异Table 2 The PTEN,VEGF,MMP-2,MMP-9 mRNA expression levels in different groups of CML(x±s,n=10)
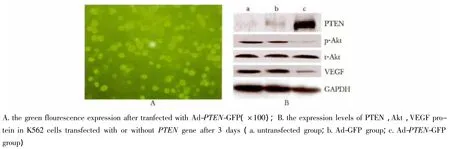
图1 K562细胞转染或未转染PTEN基因3 d后绿色荧光表达及PTEN mRNA、蛋白及Akt、VEGF蛋白表达水平Fig 1 The expression of green flourescence and PTEN mRNA,protein and Akt and VEGF protein in K562 cells transfected with or without PTEN gene
转染3 d,PTEN mRNA及蛋白表达水平达到最高,与细胞绿色荧光蛋白表达率一致。转染3 d,Ad-PTEN-GFP组PTEN表达mRNA水平(23.58±4.52)及蛋白表达水平(0.912±0.102)均高于Ad-GFP组的mRNA(0.650±0.516)及蛋白(0.117±0.028)表达水平和未转染对照组的mRNA(0.575±0.226)及蛋白(0.086±0.021)表达水平,(p<0.01)(图1B)。
2.4 细胞生长抑制实验
以MOI=200转染K562细胞后第4~7天细胞增殖抑制率出现明显区别,在第5天细胞生长抑制率最大为38.6%,Ad-GFP与Ad-PTEN-GFP组比较(p<0.01)(图2)。
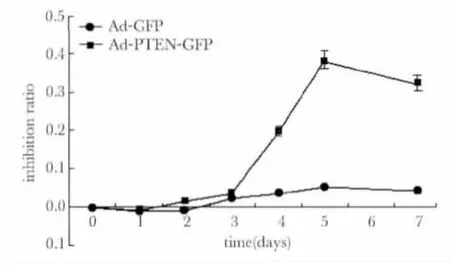
图2 不同转染组K562细胞增殖抑制曲线图Fig 2 K562 cells growth inhibiting curve of different transfection group
2.5 细胞侵袭实验
以MOI=200转染K562细胞后,未转染组、Ad-GFP组和Ad-PTEN-GFP组的漏出具有荧光细胞的数量分别为199±33、182±28和20±5(p<0.01),以Ad-PTEN-GFP组漏出绿色荧光细胞数量最少。
2.6 K562细胞中PTEN对p-Akt影响
细胞内总Akt表达水平无明显变化,而p-Akt表达水平明显减低,与转染Ad-GFP组比较降低96.15%(图1B)。
2.7 K562细胞中PTEN基因对VEGF、MMP-2及MMP-9基因及蛋白表达的影响
以MOI=200转染K562细胞系3 d,Ad-PTENGFP组 PTEN mRNA表达水平为 MOI=0时的41.01倍,VEGF mRNA表达水平降低 79.12%,MMP-2 mRNA降低82.99%,MMP-9表达水平降低82.52%(表3)。Pearson直线相关法分析显示,随着感染复数的增加PTEN mRNA表达水平逐渐增加,VEGF、MMP-2、MMP-9 mRNA 表达水平逐渐减低,呈负相关,相关系数r分别为(r=-0.903p<0.05)、(r=0.998p<0.05)和(r= -0.901p<0.05),而 VEGF mRNA表达水平与 MMP-2及MMP-9表达水平呈正相关,相关系数分别为:(r=0.998,P <0.05)及(r=0.991,P <0.05)。
以MOI=200转染K562细胞系3 d,显示转染Ad-PTEN-GFP组VEGF蛋白表达水平明显减低(p<0.05)(图1B)。明胶酶谱检测试验显示,转染Ad-PTEN-GFP组MMP-2和MMP-9蛋白表达水平明显低于未转染组和Ad-GFP组(p<0.05)(图3)。与转染Ad-GFP组比较VEGF、MMP-2、MMP-9蛋白表达水平分别降低80.88%、65.03%、78.99%。
表3 以不同感染复数转染K562 PTEN基因3 d后PTEN、VEGF、MMP-2和MMP-9 mRNA表达水平变化Table 3 PTEN,VEGF,MMP-2,MMP-9 mRNA expression levels after 3days of transfection Ad-PTEN-GFP into K562 cells with different MOI,n=3)
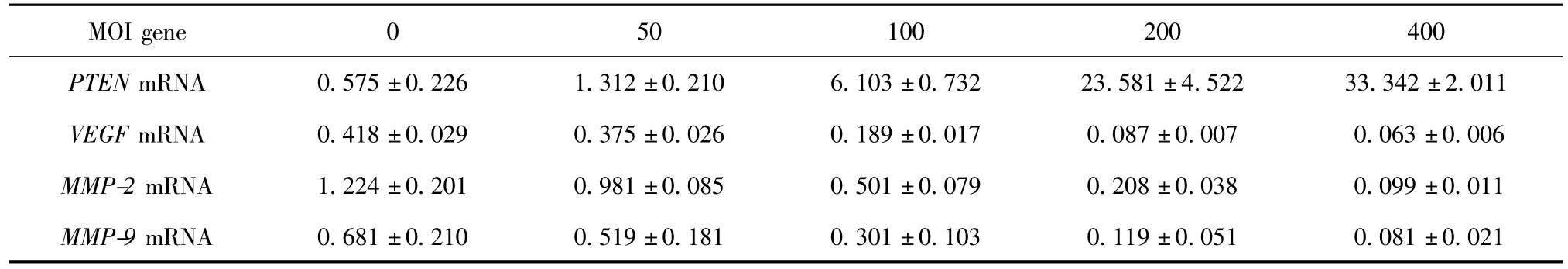
表3 以不同感染复数转染K562 PTEN基因3 d后PTEN、VEGF、MMP-2和MMP-9 mRNA表达水平变化Table 3 PTEN,VEGF,MMP-2,MMP-9 mRNA expression levels after 3days of transfection Ad-PTEN-GFP into K562 cells with different MOI,n=3)
.581±4.522 33.342±2.011 VEGF mRNA 0.418±0.029 0.375±0.026 0.189±0.017 0.087±0.007 0.063±0.006 MMP-2 mRNA 1.224±0.201 0.981±0.085 0.501±0.079 0.208±0.038 0.099±0.011 MMP-9 mRNA 0.681±0.210 0.519±0.181 0.301±0.103 0.MOI gene 0 50 100 200 400 PTEN mRNA 0.575±0.226 1.312±0.210 6.103±0.732 23 119±0.051 0.081±0.021
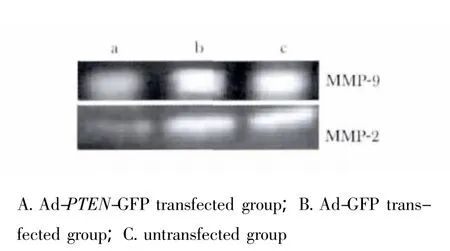
图3 不同组转染组转染3 d后MMP-2,MMP-9明胶酶谱检测蛋白的表达差异Fig 3 The expression levels of MMP-2,MMP-9 mRNA and protein in K562 cells transfected with or without PTEN gene
3 讨论
肿瘤血管新生是指肿瘤细胞通过分泌多种促血管生长因子诱导血管生成,从而促进肿瘤生长和转移[5]。其中主要包括VEGF、血管生成素、环氧化酶以及多种 MMP[1,6-7]。
VEGF及其受体是肿瘤血管新生、侵袭的主要调控因子,VEGF特异性地作用于血管内皮细胞,具有强烈的促进血管生成作用,并增加血管通透性。进一步可以促进血管内皮细胞分泌表达MMP-2、MMP-9,而增强肿瘤细胞的生长、浸润和转移能力[1-2]。MMP在降解基质过程中亦能够促进血管生成因子如VEGF的释放,并促进肿瘤的血管新生,产生肿瘤转移的血行通路[1-2],二者形成反馈作用。
本研究显示在髓系白血病中均存在VEGF、MMP-2及MMP-9异常表达,在进展期白血病,如慢性髓系白血病急变期VEGF及MMP-2、MMP-9表达水平明显增加,表明二者与疾病进展密切相关。
研究显示抑癌基因PTEN在造血系统肿瘤如白血病、骨髓瘤[6-8]中存在不同程度的缺失或低表达。PTEN表达缺失或突变可以导致多种促血管新生因子的表达增加,促进肿瘤血管的新生,增强肿瘤细胞的侵袭和转移[6-7,9-10]。本研究结果表明,CML急变期患者较慢性期患者PTEN表达水平明显减低,而VGEF、MMP表达水平明显升高,促进CML细胞增殖、血管新生,细胞侵袭性增加,从而导致疾病进展。
PI3K/Akt信号通路激活后,能够促进VEGF合成[11-12],VEGF 与其 受体结 合后能 够反 馈 激活PI3K。PI3K/Akt及VEGF活化后进一步促进MMP表达,介导肿瘤细胞浸润及转移。PTEN基因通过抑制PI3K/Akt信号活化,抑制VEGF、MMP等多种促血管新生因子的合成[13-14]。本研究显示,K562细胞转染野生型PTEN基因后,细胞增殖受抑,侵袭性减低,PI3K/Akt信号通路受抑,VEGF及MMP-2、MMP-9表达水平明显减低,PTEN与VEGF及MMP表达呈负相关。
上述研究显示髓系白血病患者PTEN表达的减低,导致 VEGF及 MMP表达增强。PTEN/PI3K/Akt/VEGF/MMP信号传导通路相互联系、相互作用,参与了髓系白血病血管新生、侵袭及转移。
[1]Shi YL,Xu T,Li LP,et al.Over-expression of VEGF and MMP-9 in residual tumor cells of hepatocellular carcinoma after embolization with lipidol[J].J Huazhong Univ Sci Technolog Med Sci,2013,33:90 -95.
[2]Zheng H,Takahashi H,Murai Y,et al.Expressions of MMP-2,MMP-9 and VEGF are closely linked to growth,invasion,metastasis and angiogenesis of gastric carcinoma[J].Anticancer Res,2006,26:3579 -3583.
[3]Tian T,Nan KJ,Guo H,et al.PTEN inhibits the migration and invasion of HepG2 cells by coordinately decreasing MMP expression via the PI3K/Akt pathway[J].Oncol Rep,2010,23:1593 -1600.
[4] Tibarewal P,Zilidis G,Spinelli L,et al.PTEN protein phosphatase activity correlates with control of gene expression and invasion,a tumor-suppressing phenotype,but not with AKT activity[J].Sci Signal,2012,5:ra18.
[5]Edwards LA,Woo JH,ham LA,et al.Suppression of VEGF secretion and changes in glioblastoma multiforme microenvironment by inhibition of integrin-linked kinase(ILK)[J].Mol Cancer Ther,2008,7:59 -70.
[6]成志勇,张昕,王哲等,PTEN和COX-2在髓系白血病中的表达及作用机制探讨。中华检验医学杂志[J],2012,35:165-169
[7]Cheng ZY,Liang WT,Yang XY,et al.PTEN's regulation of VEGF and VEGFR1 expression and its clinical significance in myeloid leukemia[J].Med Oncol,2012,29:1084-1092.
[8]Wang SY,Hao HL,Deng K,et al.Expression levels of PTEN,FAK in multiple myeloma patients and its relationship with clinical stage and extramedullary infiltration[J].Leuk Lymphoma,2012,53:1162 -1168.
[9]Tian T,Nan KJ,Wang SH,et al.PTEN regulates angiogenesis and VEGF expression through phosphatase-dependent and-independent mechanisms in HepG2 cells[J].Carcinogenesis,2010,31:1211 -1219.
[10]Zhu L,Loo WT,Louis WC.PTEN and VEGF:possible predictors for sentinel lymph node micro-metastasis in breast cancer[J].Biomed Pharmacother,2007,61:558 - 561.
[11]Ma J,Sawai H,Ochi N,et al.PTEN regulates angiogenesis through PI3K/Akt/VEGF signaling pathway in human pancreatic cancer cells[J].Mol Cell Biochem,2009,331:161-171.
[12]Simonetti O,Lucarini G,Goteri G,et al.VEGF is likely a key factor in the link between inflammation and angiogenesis in psoriasis:results of an immunohistochemical study[J].Int J Immunopathol Pharmacol,2006,19:751-760.
[13]Fang J,Ding M,Yang L,et al.PI3K/PTEN/Akt signaling regulates prostate tumor angiogenesis[J].Cell Signal,2007,19:2487 -2497.
[14]Wang S,Cheng Z,Deng K et al.Effect of wild type PTEN gene on proliferation and invasion of multiple myeloma[J].Int J Hematol,2010,92:83-94.
