腺病毒转染与蛋白负载在促进树突状细胞成熟中的作用对比
2014-12-03崔慧霞张文陆
崔慧霞,张文陆
(辽宁医学院1.护理学院基护教研室;2.附属第一医院综合八病区,辽宁 锦州 121001)
肿瘤生物治疗已成为继手术、放疗、化疗后的第四大治疗模式。其中,树突状细胞(dendritic cell,DC)是肿瘤生物治疗研究的热点。DC是功能最强的专职性抗原提呈细胞(antigen presenting cell,APC),可将抗原信息以主要组织相容性复合体(major histocompability complex,MHC)-抗原肽复合体的形式提呈给初始T淋巴细胞,从而诱导其成为特异性的细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTL),因此DC是机体免疫反应的始动者[1]。不成熟的DC抗原提呈能力较弱,成熟的DC才具有强大的抗原提呈能力。因此,在体外诱导培养的DC中常加入某些刺激剂以促进其成熟。为了促进DC对特异性抗原的提呈,在培养的过程中常加入抗原蛋白或编码蛋白的腺病毒,而这2种刺激剂中的哪一种更能促进DC的成熟,已有文献说法不一,故本研究拟比较腺病毒转染和蛋白负载在促进DC成熟中的作用。
1 材料与方法
1.1 材料与试剂
新鲜外周血来源于健康志愿者;表达人乳腺珠蛋白(mammaglobin&x100ccf;A,MGBA)的重组腺病毒Ad&x100ccf;MGBA和空腺病毒Ad&x100ccf;null为本研究室构建;人重组乳腺珠蛋白购自台湾Abnova公司;重组人粒单核细胞集落刺激因子(granulocyte&x100ccf;macrophage colony&x100ccf;stimulating factor,GM&x100ccf;CSF)、重组人肿瘤坏死因子(tumor necrosis factor&x100ccf;α,TNF&x100ccf;α)、重组人白细胞介素4(interleukin&x100ccf;4,IL&x100ccf;4)均购自厦门特宝公司;淋巴细胞分离液购自天津灏洋生物技术有限公司;IL&x100ccf;12p70ELISA检测试剂盒购自达科为生物科技有限公司;藻红蛋白(phycoerethrin,PE)标记的鼠抗人CD80、别藻青蛋白(allophycocyanin,APC)标记的鼠抗人CD83、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的鼠抗人CD86及相应的同型对照抗体均购自美国BD公司。
1.2 方法
1.2.1 DC的培养及实验分组:从健康志愿者的外周血中,用密度梯度离心法分离单个核细胞,用RPMI1640完全培养基于37Ⅴ、5%CO2条件下静置培养2 h,非贴壁细胞弃除,贴壁细胞用含1 000 IU/mL GM&x100ccf;CSF和500 IU/mL IL&x100ccf;4的新鲜培养液培养,每2~3日换液。将体外诱导培养的DC共分成4组:(1)DC组:为对照组,常规培养;(2)MGBAp DC组:在培养第4天添加40 μg/mL纯化的人MGBAp;(3)Ad&x100ccf;null DC组:在培养第5天按MOI200加入腺病毒空载体Ad&x100ccf;null;(4)Ad&x100ccf;MGBA DC组:在培养第5天按MOI200加入重组腺病毒Ad&x100ccf;MGBA。
1.2.2 形态观察:上述各组DC培养至第7天,用倒置相差显微镜观察各组DC的形态。并收集各组DC用于后续的研究。
1.2.3 各组DC表型的检测:收集培养至第7天的各组DC,PBS洗涤2次,调整细胞密度为1×106/mL,每个EP管中加入0.5 mL细胞悬液,分别加入PE标记的CD80、APC标记的CD83、FITC标记的CD86及对应的同型对照抗体,4避光孵育30~40 min,PBS洗涤2次,0.5 mL PBS重悬细胞后于流式细胞仪中上机分析。
1.2.4 各组DC细胞上清中IL&x100ccf;12的表达:检测各组DC上清中IL&x100ccf;12的表达,具体按ELISA试剂盒操作说明书进行。在酶标仪上检测各组的OD值,再根据标准曲线换算出IL&x100ccf;12的浓度。
1.3 统计学分析
2 结果
2.1 腺病毒转染与蛋白负载对DC形态的影响
用倒置相差显微镜观察培养7 d的DC,结果如图1所示:与未处理组相比,用2种腺病毒转染组DC以及蛋白添加组DC均出现了典型的形态变化:细胞体积增大,外形不规则,且有典型的树突状突起;而未作任何处理的DC虽然体积也较以前增大,但典型的突起较少。提示腺病毒转染及蛋白负载均能促进DC形态上的成熟。
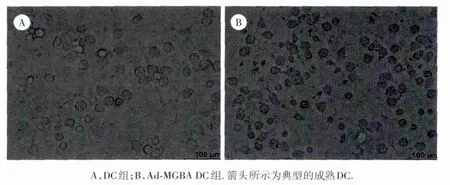
图1 相差显微镜下培养7 d的D C的形态特点×400
2.2 腺病毒转染与蛋白负载对DC表型的影响
如图2、3所示:与普通DC相比,病毒转染组与蛋白负载组DC表面标记CD80、CD83和CD86均上调,说明腺病毒转染和蛋白负载均能能促进DC表型的成熟;而虽然2个病毒转染组与蛋白负载组之间在CD86的表达上无差别,但在CD80和CD83的表达上,腺病毒转染组,尤其是Ad&x100ccf;MGBA DCs组均高于蛋白转染组,说明腺病毒转染比蛋白负载更能促进DC表型的成熟。值得注意的是,两腺病毒转染组,即Ad&x100ccf;null DC组和Ad&x100ccf;MGBA DC组间并无显著差别。
2.3 腺病毒转染与蛋白负载对DC IL&x100ccf;12分泌的影响
如图4所示:普通DC组IL&x100ccf;12的分泌显著低于其他3组DC,提示病毒转染和蛋白负载DC均能有效刺激DC分泌IL&x100ccf;12;蛋白负载与病毒转染间虽无统计学差异,但从平均值上分析,腺病毒转染组,尤其是Ad&x100ccf;MGBA转染组的IL&x100ccf;12的分泌高于蛋白负载组。同DC表型结果一样,2组腺病毒转染组之间在IL&x100ccf;12的分泌上也无显著差别。
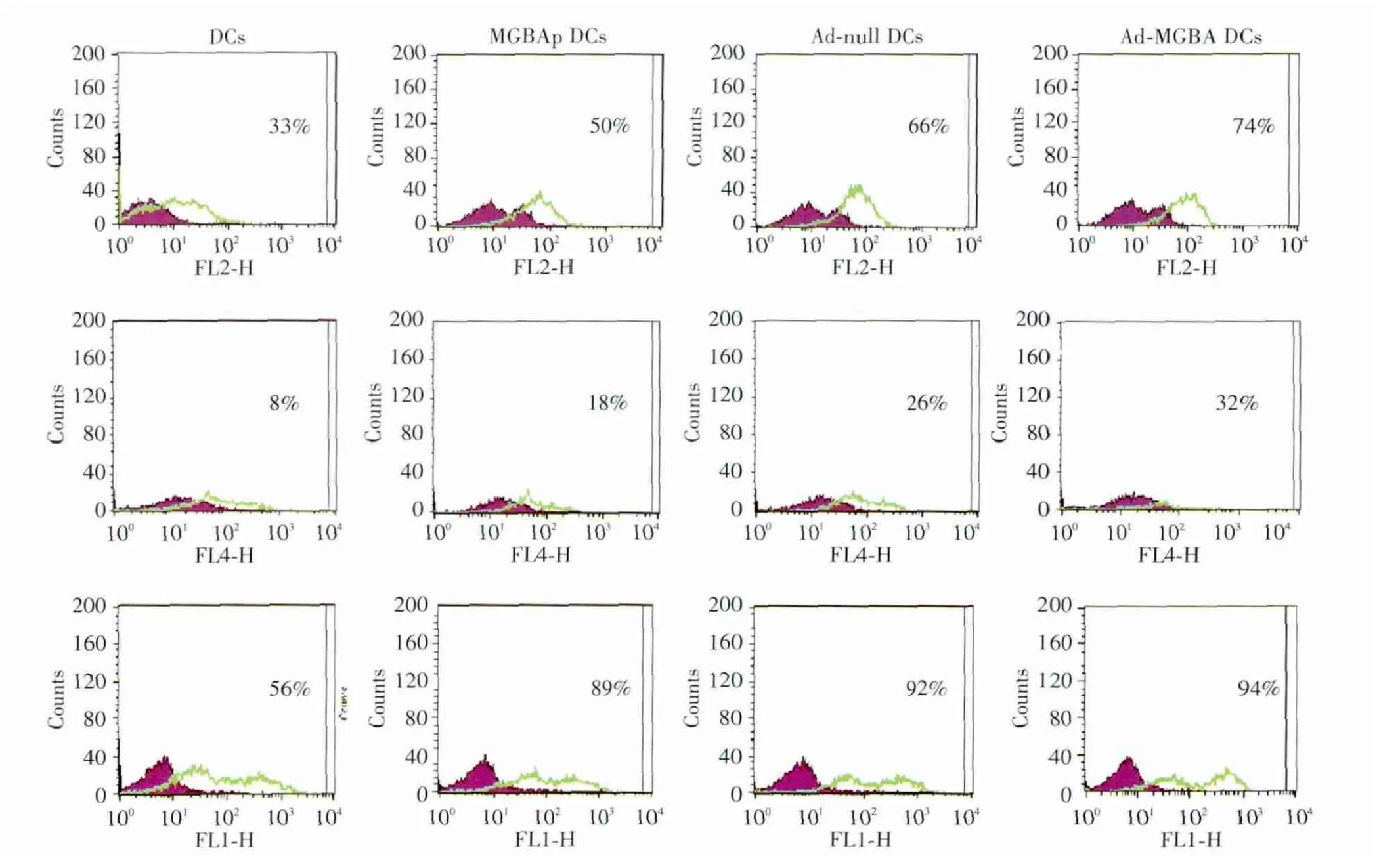
图2 腺病毒转染对D C表型的影响
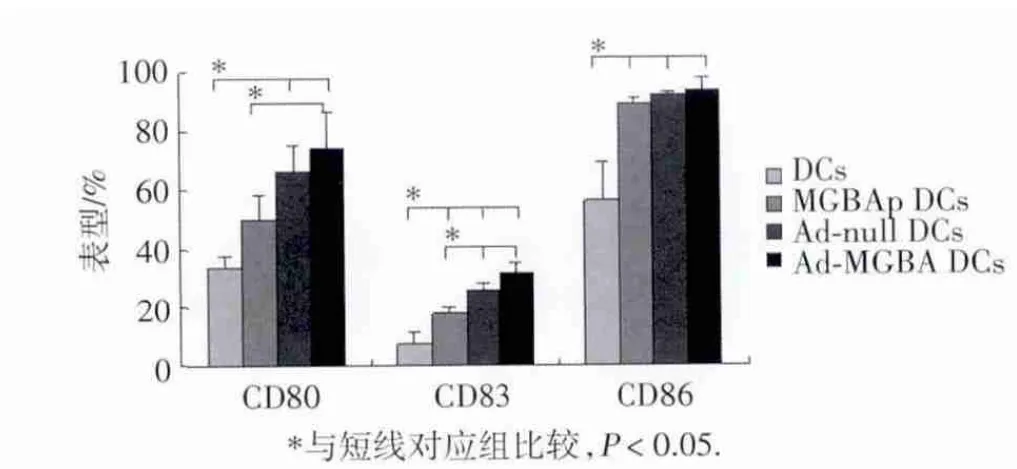
图3 腺病毒转染对D C表型影响的统计学分析
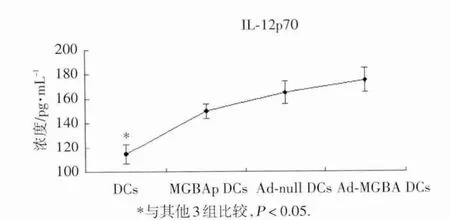
图4 腺病毒转染对D C IL&x100ccf;12分泌的影响
3 讨论
DC的主要功能是抗原提呈作用,可将抗原信息递呈给T淋巴细胞并将其激活,从而启动机体的细胞免疫。然而DC的这种功能是随着其成熟而逐渐增强的。不成熟DC体积小,没有或有很少的突起,此时抗原摄取能力较强,而提呈能力较弱;随着DC的成熟,其抗原提呈能力越来越强,在形态上也出现了明显的变化,表现为体积增大并出现典型的突起,即毛刺样外观[1,2]。DC可以从人外周血单核细胞中进行体外分离诱导培养,在培养的过程中可加入抗原信息诱导其对特异性抗原的提呈,抗原蛋白负载DC和编码抗原的腺病毒转染DC是常用的2种方法[2,4],而究竟这2种方法中的哪一种更能促进DC的成熟,目前仍有争议,因此本研究对这2种方法进行了比较。本研究结果发现,腺病毒转染和蛋白负载均能促进DC形态上的成熟,即均出现了典型的毛刺样外观,而未加任何处理的DC毛刺则较少(图1)。
DC激活初始T淋巴细胞需要两者表面共刺激分子的参与[5]。CD80、CD83和CD86是DC表面表达的主要共刺激分子,且其表达随着DC的成熟而逐渐上调。其中,CD83被认为是DC成熟的标记分子。本研究结果发现,与普通DC组相比,2种病毒转染DC组和蛋白负载组均促进了这3种共刺激分子的表达,且病毒转染组在CD80和CD83的表达上要优于蛋白负载组(图2、3)。
IL&x100ccf;12不仅有利于T细胞的激活,而且能促使Th细胞向Th1方向分化,从而有利于细胞免疫[6]。因此,研究中常监测IL&x100ccf;12的表达来判断DC在免疫调节中的作用。本研究结果显示,2组腺病毒转染组和蛋白负载组IL&x100ccf;12的表达均显著高于普通DC组,虽然统计上无显著差别,但从均值上分析,2组腺病毒转染组的IL&x100ccf;12的分泌量高于蛋白负载组。
无论是腺病毒转染还是外来蛋白刺激,DC最终都是将蛋白裂解成小分子的多肽,再与MHC分子结合后表达在细胞表面供T细胞识别。因此,对DC而言外来的腺病毒和蛋白都是异己成分从而被其提呈并促进其成熟。但腺病毒转染能够在DC细胞内表达活性的蛋白,从而持续地刺激DC,促进其对抗原的提呈,那么是腺病毒本身还是表达的活性蛋白促进了DC的成熟呢?本研究发现,转染腺病毒的2组DC,尤其是表达MGBA的重组腺病毒转染组,无论是在共刺激分子表达上还是IL&x100ccf;12的分泌上均高于蛋白负载组,但2组腺病毒转染组间并无统计学差异。回顾文献,发现对于此方面的机制尚未完全阐明,有的研究认为是腺病毒本身的壳体成份——五位体刺激DC致使其成熟;也有研究认为腺病毒进入DC细胞后再进入细胞核起到了类似于转录因子的作用,从而促进一大批分子的表达,其中就包括上述共刺激分子和IL&x100ccf;12;在这2种机制中均是腺病毒本身的作用促进DC的成熟,而与其是否表达目的基因无关[7]。总之,腺病毒转染较蛋白负载更能促进DC的成熟。
综上所述,腺病毒转染和蛋白负载均能够促进DC的成熟,能够促进DC共刺激分子的表达,促进IL&x100ccf;12的分泌,然而腺病毒转染比蛋白负载更能促进DC的成熟。
[1]崔慧霞,李妍,祁馨卉,等.腺病毒转染对树突状细胞成熟的影响[J].中国医科大学学报,2013,42(5):412-415.
[2]Peng W,Zhao G,Ma Y,et al.Dendritic cells transfected with PEG10 recombinant adenovirus elicit anti&x100ccf;tumor immune response in vitro and in vivo[J].Vaccine,2011,29(18):3501-3506.
[3]Wintermeyer P,Gehring S,Eken A,et al.Generation of cellular immune responses to HCV NS5 protein through in vivo activation of dendritic cells[J].J Viral Hepat,2010,17(10):705-713.
[4]Chen JH,Yu YS,Chen XH,et al.Enhancement of CTLs induced by DCs loaded with ubiquitinated hepatitis B virus core antigen[J].World J Gastroenterol,2012,18(12):1319-1327.
[5]姜娜,潘蕾,李媛,等.慢性丙型肝炎患者抗病毒治疗前后外周血树突状细胞表面共刺激分子的变化及初步分析[J].临床肝胆病杂志,2012,28(6):446-449.
[6]Aline F,Brand D,Pierre J,et al.Dendritic cells loaded with HIV&x100ccf;1 p24 proteins adsorbed on surfactant&x100ccf;free anionic PLA nanoparticles induce enhanced cellular immune responses against HIV&x100ccf;1 after vaccination[J].Vaccine,2009,27(38):5284-5291.
[7]Philpott NJ,Nociari M,Elkon KB,et al.Adenovirus&x100ccf; induced maturation of dendritic cells through a PI3 kinase&x100ccf;mediated TNF&x100ccf;a induction pathway[J].Proc Natl Acad Sci USA,2004,101(16):6200-6205.
