应用改良扩张器构建大鼠皮肤软组织扩张模型
2014-11-02杨登峰苏映军宋雅娟马显杰
杨登峰, 马 静, 苏映军, 宋雅娟, 余 州, 雷 蕾, 马显杰
实验研究
应用改良扩张器构建大鼠皮肤软组织扩张模型
杨登峰, 马 静, 苏映军, 宋雅娟, 余 州, 雷 蕾, 马显杰
目的应用改良设计的短注射导管枕形扩张器构建大鼠皮肤软组织扩张模型,并探讨其产生的扩张应力对大鼠皮肤细胞增殖分化的影响,验证扩张模型的扩张效果,为研究扩张皮肤新生机制提供一个稳定的动物模型。方法SD大鼠随机分为A、B两组(每组各30只),A组大鼠采用改良设计的扩张器,B组大鼠采用上海威宁公司生产的普通扩张器;选择SD大鼠近颈部切口,以注射壶外置的方式埋置扩张器,制作皮肤软组织扩张模型。分别采集A组在不同扩张时间点(1、2、3、4、5周)的扩张中心区域皮肤和正常皮肤组织作为标本;利用HE染色方法观察扩张后皮肤结构的变化;根据增殖细胞表达增殖细胞核抗原,采用免疫组织化学染色方法观察扩张皮肤中细胞增殖的情况。结果A组应用自行改良设计的扩张器,选择大鼠近颈部切口构建的皮肤软组织扩张模型,术后外置的注射壶不易被大鼠咬掉,且术后注水及护理更简单,模型稳定性显著高于B组。HE染色结果表明,扩张后皮肤的表皮层明显增厚,真皮层变薄;免疫组织化学染色结果显示,增殖细胞呈点状分布,主要集中于表皮基底层和毛囊鞘。结论自行改良设计的短注射导管枕形扩张器,是构建大鼠皮肤软组织扩张模型的良好实验材料;扩张应力对大鼠的皮肤结构和增殖产生了影响。
皮肤软组织扩张术; 动物模型; 扩张器; 皮肤增殖
皮肤软组织扩张术早已成为整形外科领域最为常用的治疗手段之一,因其具有良好的修复效果,深受医师和患者的欢迎[1],但也存在治疗周期较长的缺点。如何在尽量短的时间内扩张出面积大、质量好的新增皮肤成为研究努力的方向[2]。要想通过干预措施,提高扩张效率,就得通过实验研究来阐明扩张皮肤组织增生的机制,首先需要建立一个良好稳定的皮肤软组织扩张动物模型。自2012年12月至2013年4月,我们采用一种自行改良设计的短注射导管枕形扩张器,使其更适合构建鼠的皮肤软组织扩张模型,并通过HE染色进行组织学观察、增殖细胞核抗原(PCNA)免疫组织化学染色,观察扩张应力对皮肤细胞增殖的影响,验证其扩张效果。
1 材料与方法
1.1 实验材料、实验动物及扩张模型的制备、分组与标本采集
1.1.1 实验材料与实验动物 自行改良设计的短注射导管枕形扩张器(20 ml),注射导管长约1.5 cm(陕西咸阳硅橡胶制品厂制作;专利号:ZL201320034912.1),见图1;普通圆形扩张器,注射导管长约6 cm(上海威宁整形制品有限公司),见图2。7周龄SD大鼠60只(由第四军医大学实验动物中心提供)。
1.1.2 扩张模型的制备、分组与标本采集 ①手术方法: 2%戊巴比妥钠溶液腹腔注射麻醉,碘伏消毒背部皮肤,以脊柱为中线,在背部皮肤表面用亚甲蓝标记拟埋置扩张器的边界,在近颈部垂直于脊柱线横行切开全层皮肤,切口长约1.5 cm;用剥离剪在深筋膜浅层钝性分离预扩张的区域,剥离范围不超过标记线,形成组织腔隙,盐水湿纱布填塞止血;分别置入自行改良设计的短注射导管枕形扩张器或威宁公司生产的普通扩张器,注射壶外置,全层缝合切口,最后将注射壶再次单独打结固定于颈部皮肤。术后动物单笼喂养,无须限制其活动,见图3。②实验动物分组与标本采集:A组埋置自行改良设计的短注射导管枕形扩张器,B组埋置上海威宁公司生产的普通扩张器,各30只。分别于手术后第1天开始注水,注水1 ml/d,直至注满20 ml。A组分别于术后第1、2、3、4、5周在扩张区域皮肤中心部位切取1.0 cm×1.0 cm的皮肤组织,并切取正常未扩张的皮肤组织做对照,标本置于10%福尔马林溶液中固定,常规石蜡包埋与切片,切片厚度4 μm。
1.2 观察指标
1.2.1 扩张模型稳定性的比较 统计A、B两组扩张器在整个扩张过程中发生注射壶被鼠咬掉的个数,计算模型构建成功的百分率,比较两组模型构建的稳定性。
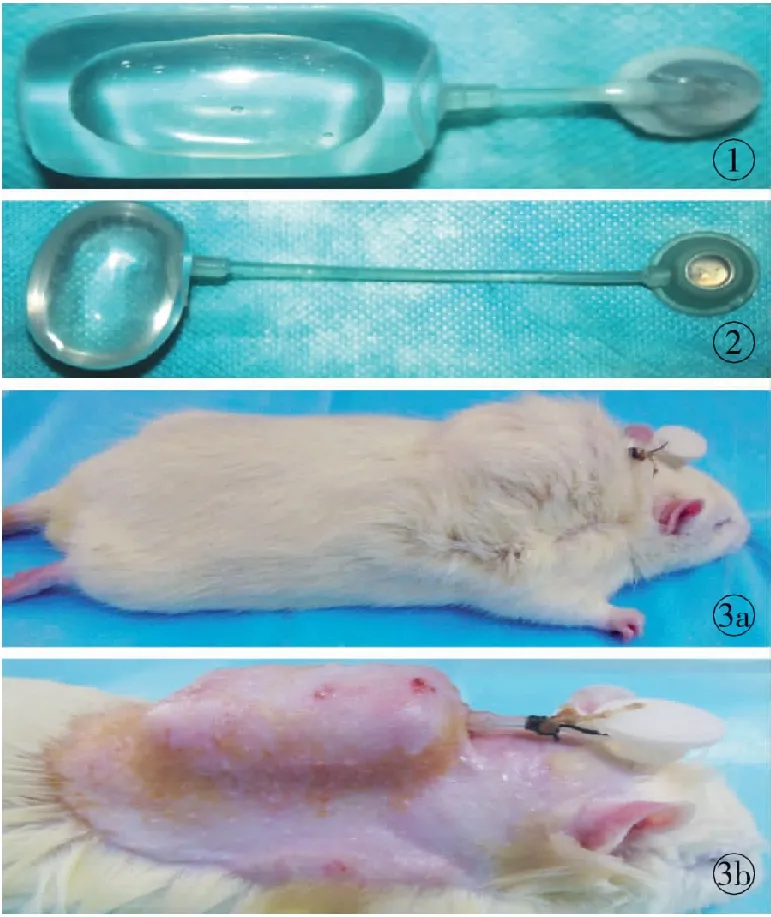
图1 自行改良设计的扩张器图2 上海威宁公司生产的普通扩张器图3 扩张动物模型 a.脱毛前 b.脱毛后
Fig1 Improved expander.Fig2 Ordinary expander (Shanghai Winner company).Fig3 Animal model of skin and soft tissue expansion. a. before depilation. b. after depilation.
1.2.2 组织学观察 取A组各扩张时间点和正常皮肤组织石蜡切片,进行常规的脱蜡和水化,HE染色,在光学显微镜下观察,比较各扩张时间点皮肤组织和正常皮肤组织的外形、表皮和真皮厚度、表皮层细胞数目、排列层次、分布特征及真皮层胶原纤维排列的变化规律。
1.2.3 免疫组织化学染色 取A组各扩张时间点和正常皮肤组织石蜡切片,根据增殖细胞表达增殖细胞核抗原(PCNA),免疫组织化学染色(SP法):以兔抗大鼠PCNA IgG单克隆抗体(美国ABCAM公司,工作浓度为1∶1000)为一抗,即用型快捷免疫组化MaxVisionTM试剂盒(兔,福州迈新),DAB显色试剂盒(×20,福州迈新)进行免疫组织化学染色,并以PBS代替一抗作为阴性对照。以细胞核呈棕黄色着色为阳性细胞,观察A组各扩张时间点皮肤组织中阳性细胞的分布,双盲法在200倍光学显微镜下,每张切片随机选取10个视野,采用Image Pro Plus(IPP)6.0图像分析软件进行免疫组织化学定量分析,计算其中染色为阳性的细胞个数,取其平均值,比较各个扩张时间点与正常皮肤组织中阳性细胞数目的差异。
1.3 统计学处理
2 结果
2.1 扩张模型稳定性的比较
A组中构建的30只扩张动物模型在扩张的5周内,无一例发生注射壶被鼠咬掉,并且短注射导管能够限制扩张囊的位置,使其不会因为鼠的剧烈运动而在皮下游走,扩张的皮肤区域更为恒定,模型构建的成功率为100%。B组中构建的30只扩张动物模型,即使将长导管埋在皮下,由于鼠的活动性特别大,在术后前3 d,埋在皮下的长导管很容易延伸到切口外面而被鼠咬断。在扩张的第1周,有11只扩张器的注射壶被鼠咬掉,后4周有3只注射壶被鼠咬掉。由于注射导管长,有4只扩张囊因鼠的剧烈活动在皮下游走移位,模型构建的成功率只有40%。A组模型构建的稳定性明显高于B组。
2.2 HE染色结果
未扩张的正常皮肤组织表皮层比较平整,表皮钉突短而尖,极性过度明显。真皮层胶原纤维束大小均匀、排列整齐,未见到炎症细胞浸润(图4)。扩张后的皮肤组织表皮层明显增厚,表皮皱褶明显、凹凸显著,表皮钉突变得长而钝并深入真皮层内,形成岛状结构;细胞胞体变大,纵轴变长,细胞层次和数目明显增加,排列较为紧密,基底层的变化最为显著,极性过度不明显。真皮层稍微变薄,胶原纤维束明显变大,排列欠整齐,间距增宽,其间可见到有炎症细胞浸润(图5)。以上这些变化,从扩张后第1周开始出现,扩张后第4周最为显著。
2.3 免疫组织化学染色结果
扩张皮肤PCNA表达情况:①在正常未扩张皮肤组织中,只在表皮基底层观察到PCNA阳性表达的增殖细胞,沿表皮基底层散在点状分布,数目较少,真皮层尚未发现PCNA+细胞(图6)。②在受到扩张应力刺激的皮肤组织中,PCNA+细胞的数目明显增多,在表皮基底层和真皮的毛囊鞘周围均可见到PCNA+细胞,PCNA+细胞呈点状密集分布于表皮基底层,呈现复层排列,最高可达2、3层,在棘细胞层和颗粒细胞层也可见到少量点状分布。在真皮层也可见到环绕毛囊鞘外周呈点状分布的PCNA+细胞(图7)。实验结果表明:扩张后第3周,PCNA+细胞数目达到最高峰,数目高于其他各扩张时间点。扩张后各时间点皮肤组织中,阳性细胞数目显著高于正常未扩张皮肤组织(P<0.05),见表1。
3 讨论
自从C Radovan (1976年)发明了皮肤软组织扩张术,该项技术早已在临床中广泛应用于整形外科领域的修复重建中,从1985年开始在我国推广应用已有近30年的历史。有关皮肤软组织扩张术的文献报道数量巨大,但主要集中于临床应用方面;有关基础理论研究的文献相对较少,基础研究也主要集中在扩张后皮肤局部组织形态与病理、生理的变化,扩张方法改进的研究,皮瓣预构和延迟作用等方面的研究[3],有关扩张机械应力作用下皮肤组织增生的机制仍不清楚。基础理论的研究必然离不开动物模型的建立,既往我们研究所已有李江、胡亚兰、王晓燕等[3-5]用家猪为实验动物构建模型;贺忠文、陈惠平等[6-7]分别用家犬和兔子为实验动物构建模型,但用这些大动物构建模型存在手术麻醉困难、术后护理不便、大批量构建模型成本高等问题,而且能够用于这些大动物的抗体等分子生物学试剂很有限,使得研究深度受到限制。为了避免使用大动物带来上述存在的问题和局限因素,刘洋、李翅翅等[8-10]用鼠为实验动物构建模型。但刘洋等并未详细介绍模型的构建方法;李翅翅等使用的是上海威宁公司生产的10 ml扩张器,最初选择背部近尾处横行切口[9],但在手术后的饲养阶段发现,由于鼠的活动性大,身体容易屈曲,尾端外置的注射壶很容易被鼠咬掉,导致模型构建的成功率相对较低。因此,李翅翅等改变切口位置,选择近颈部横行切口[10],但由于威宁公司生产的微型扩张器注射导管偏长,即使将长导管埋在皮下,由于鼠的活动性特别大,在术后前3 d伤口未愈合时,埋在皮下的长导管很容易延伸到切口外面而被鼠咬断;就需要用悬吊等方法限制鼠的自由活动,但这样就给术后饲养带来了很大的不便,而且影响鼠的生命质量。为了避免注射壶被鼠咬掉,同时又不限制鼠的自由活动,我们自行改良设计了短注射导管枕形扩张器(20 ml),选择近颈部横行切口,主要有以下优点:①改良设计的扩张器注射导管长度只有1.5 cm,手术时将注射壶打结固定于颈部,没有多余长度的导管可以从皮下延伸出来,因此注射壶不容易被鼠咬掉;②注射壶固定于颈部不易被鼠咬掉,因此,无需限制鼠的自由活动,可减少对鼠生命质量的影响,而且术后护理、饲养更方便;③注射导管较短可以限制扩张囊在鼠皮下的游走,使皮肤扩张的位置不会因为鼠的活动性大而发生改变;④枕形扩张囊的设计比起圆形扩张囊可以使扩张位置更恒定,也限制了扩张囊因鼠的活动剧烈而游走,并且在切取扩张皮肤作标本时,扩张中心位置更容易标记和选择。
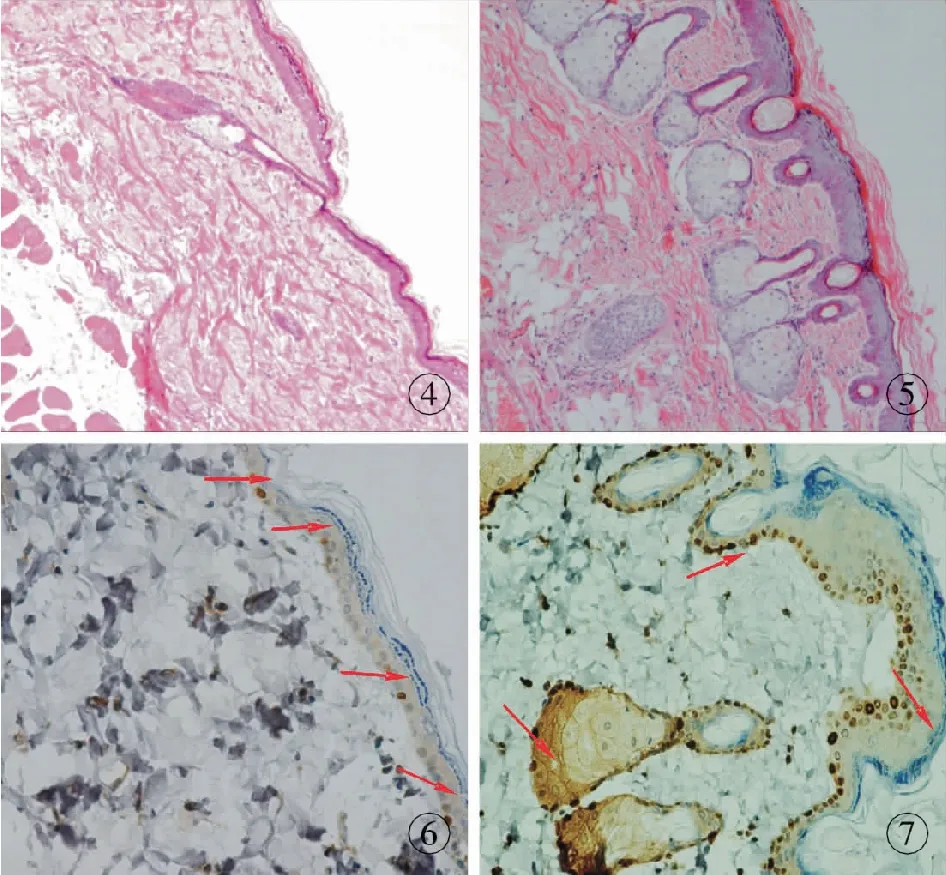
图4 正常未扩张皮肤(HE ×100)图5 扩张后第4周皮肤(HE ×100)图6 正常未扩张皮肤(PCNA ×200)图7 扩张后第3周皮肤(PCNA ×200)
Fig4 Unexpanded skin (HE ×100).Fig5 Expanded skin at 4 weeks (HE ×100).Fig6 Unexpanded skin (PCNA ×200).Fig7 Expanded skin at 3 weeks (PCNA ×200).
表1 正常未扩张和扩张后各时间点皮肤组织中PCNA阳性细胞数目

注:与正常未扩张皮肤比较,*P<0.05
目前,公认的扩张后新增皮肤面积的来源有3种:①生物性生长[11-12];②弹性蠕变;③周围组织移位。其中,生物性生长是证明皮肤扩张成功的标志。PCNA是反应细胞增殖的良好标志物,实验通过PCNA免疫组织化学染色,证实了扩张后的大鼠皮肤组织中PCNA的高表达,此外,HE染色的镜下结构也表明扩张后的皮肤组织表皮层明显增厚。这些实验结果与临床上人体扩张后皮肤组织在形态学上的变化及实验结论相一致[13],证明了该扩张模型的扩张效果,能够产生“额外”的新生皮肤。笔者详细介绍了采用自行改良设计的短注射导管枕形扩张器构建大鼠皮肤软组织扩张模型的实验方法,并通过HE染色结果显示的组织学变化和PCNA免疫组织化学染色结果显示的扩张应力对皮肤细胞增殖产生的促进作用,证明了其扩张效果;希望能为其他研究扩张皮肤新生机制的研究者,提供一个良好的扩张器材料和构建动物模型稳定的实验方法。
[1] 马显杰, 李 杨, 李威扬, 等. 扩张后前臂任意型皮瓣修复全鼻瘢痕畸形[J]. 中华医学美学美容杂志, 2013,19(1):5-7.
[2] 杨 力, 潘 勇, 郭树忠, 等. 颜面部皮肤扩张术治疗后的进一步美容修复[J]. 中国美容整形外科杂志, 2009,20(4):209-212.
[3] 李 江, 鲁开化, 艾玉峰, 等. 持续恒压扩张和常规间断扩张后皮 肤超微结构的改变[J].中华整形外科杂志,2002,18(6):365-366.
[4] 胡亚兰, 郭树忠, 鲁开化. bFGF 和硫糖铝在持续恒压扩张术中局部联合应用对组织细胞增殖的影响[J].中华整形外科杂志, 2003,19(3):203-206.
[5] Xiaoyan Wang, Chichi Li, Yan Zheng, et al. Bone marrow mesenchymal stem cells increase skin regeneration efficiency in skin and soft tissue expansion[J]. Expert Opin Biol Ther, 2012,12(9):1129-1139.
[6] 贺忠文, 袁志芳. 皮肤扩张术机理探讨[J]. 中华整形外科杂志, 2000,16(2):84-86.
[7] 陈惠平, 肖 燕, 黄莹滢, 等. 早期连续快速扩张法对扩张囊外纤维包膜影响的研究[J]. 中国美容整形外科杂志, 2013,24(1):28-30.
[8] 刘 洋, 李建福, 付小兵, 等. 皮肤软组织扩张术对大鼠表皮细胞增殖分化的影响[J]. 第三军医大学学报, 2006,28(15):1557-1559.
[9] 李翅翅, 郑 岩, 王晓燕, 等. 小鼠皮肤软组织扩张模型的研究[J]. 中华实验外科杂志, 2011,28(1):56-56.
[10] Li C, Zheng Y, Wang X, et al. Bone marrow-derived stem cells contribute skin regeneration in skin and soft tissue expansi-on[J]. J Cell Physiol, 2011,226(11):2834-2840.
[11] De Filippo RE, Atala A. Stretch and growth: the molecular and physiologic influences of tissue expansion[J]. Plast Reconstr Surg, 2002,109(7):2450-2462.
[12] Melis P, Noorlander ML, van der Horst CMAM, et al. Rapid alignment of collagen fibers in the dermis of undermined and not undermined skin stretched with a skin-stretching device[J]. Plast Reconstr Surg, 2002,109(2):674-680.
[13] 刘虎仙, 田孝臣, 贾赤宇, 等. 皮肤扩张后表皮干细胞异位现象初步研究[J]. 中华烧伤杂志, 2009,25(6):437-440.
Applicationofimprovedexpanderonconstructratmodelofskinandsofttissueexpansion
YANGDeng-feng,MAJing,SUYing-jun,etal.
(InstituteofPlasticSurgery,XijingHospital,theFourthMilitaryMedicalUniversity,Xi′an710032,China)
ObjectiveThe rat model of skin and soft tissue expansion was constructed to explore the effect of the tensile stress on the skin cell differentiation and further to detect the result of expansion which could offer the stable animal model for the newborn mechanisms of expanded skin.MethodsSD rats were randomly divided into two groups (30 rats in each group). Improved expanders were applied in group A, and ordinary expander which were produced by Shanghai Winner company were applied in group B. Both the expanders were implanted under superficial fascia on the back of SD rats. Samples of normal skin and expanded skin were collected from rats in group A. The structure of skin was observed with HE staining, and the distribution characteristics of PCNA positive cells were observed with immunohistochemistry staining.ResultsStability of the model in group A was significantly higher than that in group B. After the expansion, the epidermis obviously was thickened, and the dermis were thinned. Punctate distribution of proliferating cells was mainly observed in the basal layer of the epidermis and hair follicle sheath with immunohistochemistry staining.ConclusionIn this study, we provided a good expander material and stable experimental methods to construct an animal model of skin and soft tissue expansion.
Skin and soft tissue expansion; Animal model; Expander; Skin proliferation
10.3969/j.issn.1673-7040.2014.04.018
R332
A
1673-7040(2014)04-0241-04
2013-11-04)
国家自然科学基金资助项目(81171826;81272117);陕西省社发攻关项目(2012SF2-01-2)
710032 陕西 西安,第四军医大学西京医院 全军整形外科研究所
杨登峰(1984-),男,安徽阜阳人,硕士研究生.
马显杰,710032,第四军医大学西京医院 全军整形外科研究所,电子信箱: majing@fmmu.edu.cn
