秋季东海二甲基亚砜的分布与影响因素研究
2014-10-26高楠张洪海杨桂朋
高楠,张洪海,杨桂朋*
(1.中国海洋大学 化学化工学院,山东 青岛266100)
1 引言
二甲基硫(di methylsulfide,DMS)是海水中最重要的、含量最丰富的还原态挥发性生源硫化物,它可以通过海-气交换进入大气并对气候和环境变化产生重要的影响[1]。二甲基亚砜(di methylsulfoxide,DMSO)是海水中主要的溶解态甲基硫化物之一,其既可以通过海水中DMS的光化学氧化[2]、细菌氧化[3—4]和浮游植物自身合成[5],又可以在某些厌氧细菌的作用下被还原生成DMS[6]。因此,DMSO作为DMS的一个潜在的源与汇,在DMS的生物地球化学循环过程中起着重要作用。
目前,国际上针对 DMSO在海洋[7—9]、雨水[10]和大气[11]中的分布以及来源途径、影响因素等已经开展了一系列的研究,DMS氧化生成DMSO的产率通过两者的转化模型也得到了初步估算[12],为探讨DMSO的迁移转化及进一步对DMS生物地球化学及环境的影响提供了资料。然而,国内有关海洋DMSO的研究工作仍处于起步阶段[13—15]。此外,东海是西太平洋最大的边缘海,受到多个洋流的相互作用[16—17];作为赤潮高发区[18],海水中物理条件和化学成分的变化对有机硫化物DMSO的生产与消耗有着重要的影响。但目前东海DMSO的研究工作仍十分有限[19]。因此本文选择东海作为研究海域,对秋季DMSO在表层海水及PN断面中的垂直分布规律及影响因素进行了研究,并探讨了DMSO与DMS、二甲巯基丙酸内盐(DMSP,DMS的前体物质)及环境因子的相互关系。此研究有助于了解中国近海DMSO的来源、分布及转化途径,为更加深入地认识中国海域DMS的生物地球化学循环过程提供一定的科学依据,进而发展建立生源硫的生物地球化学模型,了解天然硫排放对区域和全球环境气候变化的影响。有0.2 mL 25%HCl的42 mL玻璃样品瓶中,装入滤膜的样品瓶添加40 mL高纯水,拧盖密封,分别用来测定DMSOd及DMSOp。所有样品0~4℃ 避光保存,待返回陆地实验室后一个月内完成测定。现场海洋环境参数由直读式温盐深仪CTD(Seabird 911 plus)在采集海水样品时同步获得。
2 样品采集与分析
2.1 样品采集
2010年11月16日—12月10日(秋季)随“东方红2”号调查船对东海进行了调查取样(图1),共包括49个大面站位,其中在PN断面各站点采集分层海水以研究垂直分布特征(表1)。海水样品用12 L Niskin Rosette采水器采集后,立即取40 mL用内置What man GF/F玻璃纤维滤膜(直径47 mm)的 Nalgene过滤器(美国)重力过滤,滤液和滤膜分别装入盛
图1 2010年秋季东海调查站位

表1 2010年秋季东海PN断面采样深度(m)
2.2 分析方法
(1)DMSO的分析
海水中DMSO的测定采用NaBH4还原法[20],即将样品中的DMSO还原为DMS进行间接测定。由于样品中存在的原有DMS及可以被NaBH4还原的DMSP干扰,因此测定前首先加入2 mL 10 mol/L KOH碱解样品中的DMSP为DMS,然后通过高纯N2吹扫30 min除去海水样品中自身存在及DMSP碱解生成的DMS,再进行DMSO的还原测定。处理后的样品添加36% 的HCl调节p H为4,加入0.12 g NaBH4静置还原15 min,然后加入1 mL 5%HCl静置4 min,最后采用冷阱吹扫-捕集气相色谱法测定DMS[21],间接 获 得 DMSO 含 量[22]。方 法 检出 限 为2.7 p mol(10-12mol)S,对应的 DMSO为0.75 n mol(40 mL),相对标准偏差 ±5%。
(2)相关参数的分析测定
对于叶绿素a(Chl a)样品的分析,取300 mL海水样品经What man GF/F玻璃纤维滤膜过滤(p≤15 k Pa),滤膜对折用锡纸包裹后冷冻保存。分析时以10 mL 90%(V/V)丙酮水溶液避光萃取滤膜上的Chl a,后采用F-4500分子荧光仪(日本日立)测定[23]。DOC测定采用高温催化氧化法,所用仪器为岛津TOC-VCPH型总有机碳分析仪[24]。总细菌丰度分析采用DAPI荧光染色计数法[25]。海水样品经过0.2μm的黑色核孔滤膜过滤后,用DAPI染色5~10 min,在全自动荧光显微镜(CTR 5000,德国徕卡)下计算细菌丰度。
3 结果与讨论
3.1 DMSOd与DMSOp浓度的水平分布
秋季东海表层海水Chl a的浓度变化范围较大(0.07~8.59μg/L),平均值为(0.69±0.48)μg/L。PN09站位出现Chl a浓度最大值,可能是调查期间附近海域发生藻类的“水华”,导致了Chl a浓度高值(图2a)。此外,长江口附近海域也出现Chl a浓度高值区,浓度水平均在1.00μg/L以上,这主要是由于长江口附近海域受人为活动影响严重,生产力水平较高,浮游植物生长旺盛所致。
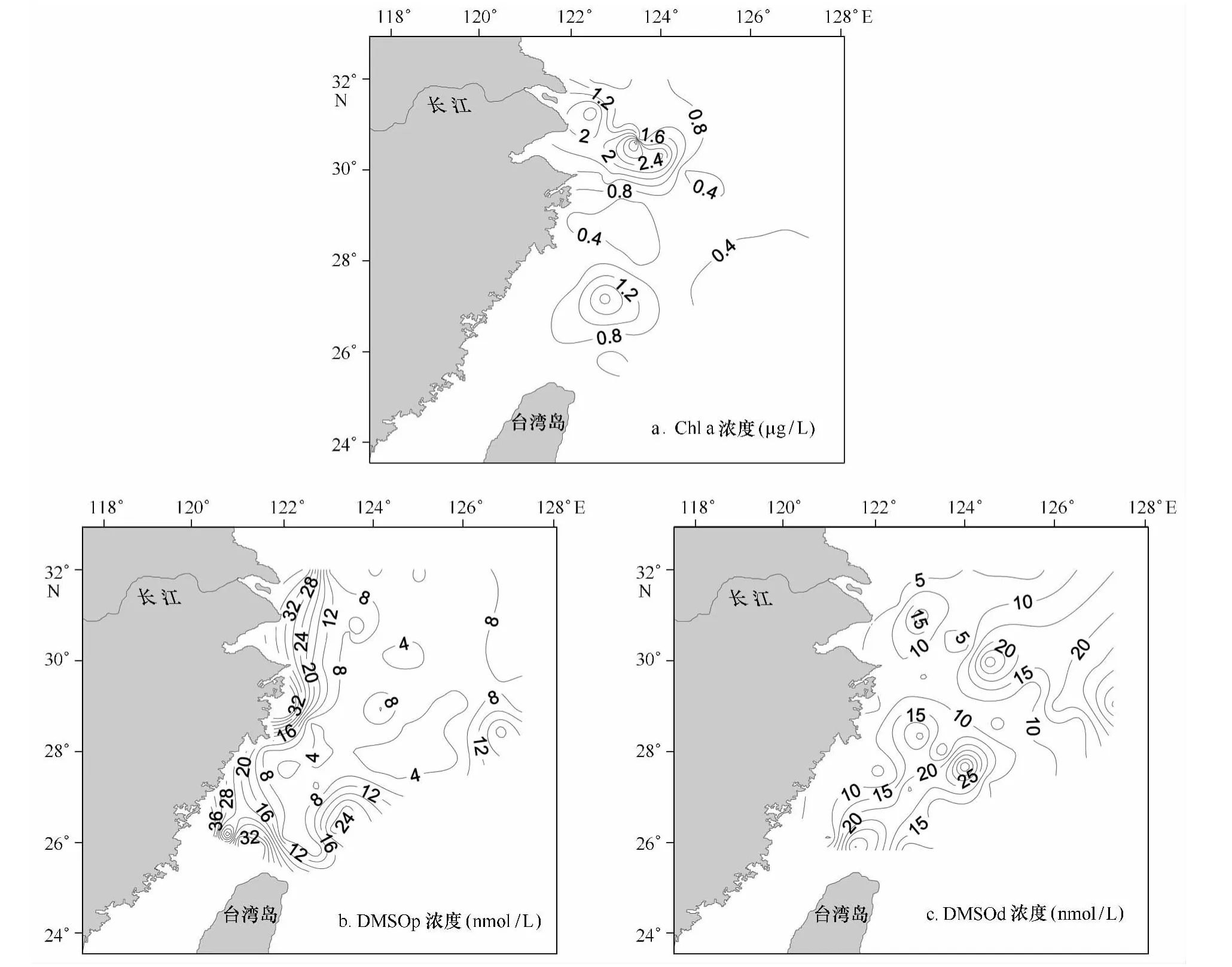
图2 东海表层海水中Chl a浓度(a)、DMSOp浓度(b)和DMSOd浓度(c)的水平分布
调查海域DMSOp的浓度范围介于2.49~85.5 nmol/L之间,平均值为(17.2±1.40)nmol/L,与2009年冬季(12月)基本相当[19]。水平分布上,DMSOp浓度呈现近岸高、远海低的趋势,可能受到人为活动的影响。由图2b可以看出,DMSOp高值区出现在长江口和东海西南部海域,与Chl a的高值分布相吻合,说明该海域表层海水中较高的DMSOp浓度部分来源于浮游植物的直接生产贡献[26—28]。
DMSOd的浓度范围(图2c)与DMSOp基本相当,介于2.27~86.6 nmol/L之间,平均值为(15.3±1.29)nmol/L,与2009年冬季测定结果相差较大,可能与高值区(长江口)高浓度的DOC有关[19];此外,秋季长江冲淡水的影响可能也是造成浓度低于冬季的原因。浓度最低值出现在东海北部海域DH01站位,而高值区主要分布在DH25站位所在的27°30′~30°30′N、124°E以西的上升流海域[29]。另外,与DMSOp不同,研究海域内DMSOd没有表现由近岸向远海明显降低的分布趋势,表明DMSOd浓度受人为活动的影响相对较小。
3.2 PN断面DMSOp与DMSOd浓度的垂直分布
东海PN断面与黑潮主轴垂直,同时还会受到台湾暖流、长江冲淡水和陆架混合水的影响,使得该断面各要素分布较为复杂[30]。该断面上Chl a、DMSOd及DMSOp浓度的垂直分布如图3所示。Chl a在垂直分布上整体浓度变化较小,然而在相同深度下,出现“水华”的PN09和PN08站位Chl a值明显高于其他站位,低值区主要出现在远海站位的100 m水深以下。
垂直分布中DMSOp浓度整体变化不明显,最高值出现在近岸站位PN10的最底层,达到34.0 nmol/L,与2009年冬季相同海域的调查数据相比,最高值虽然出现在不同站位,但呈现了相似的分布趋势[19]。由于海水样品中DMSOp大部分都是在直径大于5μm的颗粒物中检出的[5],除了浮游植物藻细胞内,DMSO也存在于碎屑以及粪粒等沉积物中,从而通过悬浮进入底层海水,导致DMSOp浓度在底层出现高值。
由图3可以看出,DMSOd浓度随深度的增加而降低,与杨洁[22]的研究结果相一致。由于DMSOd是DMS细菌氧化和光化学氧化的重要产物,通常在表层浓度较高,并随着深度增加有减小的趋势[31]。同航次中DMS也被观测到在表层具有较高的浓度(PN断面表层最高值为5.95 nmol/L),它可能是表层海水中DMSOd浓度较高的重要原因。此外,远海PN03b站位最底层200 m处出现的DMSOd浓度高值,可能是由于站位底层较高的DMSOp浓度引起的,因为DMSOp可以通过渗透到细胞外进入海水成为DMSOd。
3.3 DMSO与环境因素相关性分析
3.3.1 DMSOp与环境因素相关性分析
海水中DMSOp可以由浮游植物直接产生,Chl a作为衡量海区内浮游植物生物量的重要指标,二者之间的相互关系是人们关心的热点问题。2010年夏季长江口附近海域DMSOp与Chl a没有发现相关性,而秋季则有很好的相关性[22];此外,Si mó和 Vila-Costa[7]对多个海域中DMSOp和Chl a的数据进行相关性分析,并没有发现相关性存在;而北极巴芬湾(Arctic Bffin Bay)中DMSOp却与Chl a线性相关[26]。将本航次秋季东海表层海水DMSOp与Chl a浓度进行线性拟合(表2),也未发现两者的相关性。得出以上不同结论的原因可能在于不同海区或同一海区不同季节浮游植物组成及丰度存在明显差异[32],而且不同藻种合成DMSO和生产Chl a的能力也存在很大不同[33],从而难以从大的时空尺度发现DMSOp与Chl a相关性的一致规律。
DMSOp/Chl a比值常被用来估算浮游植物生物量生产DMSO的能力,不同海区该比值的大小主要取决于海区内占优势藻类对DMSO的贡献。秋季表层海水中DMSOp/Chl a比值为(23.3±1.29)mmol/g,低于同年夏季长江口附近海域的调查结果[22],表明秋季东海海域优势藻种生产DMSO能力弱于夏季,可能与秋季浮游植物群落以硅藻(DMSO的低产藻种)为主有关[32]。此外,DMSO分子结构类似于季铵类化合物氧化三甲胺(T MAO),在藻细胞内被认为具有渗透压调节功能[34-35]。研究发现DMSOp/Chl a比值与盐度具有一定的正相关(n=40;r=0.515;p<0.001),表明盐度的变化会影响藻细胞中DMSO向体外的渗透,进而对细胞内渗透压起到调节作用。此外,DMSOp与颗粒态DMSPp浓度存在一定的相关性(n=33;r=0.386;p=0.015),进一步说明DMSOp与DMSPp有着共同的来源,即生物体的自身合成,并且两者可能具有相似的生理功能。
DMSOp与盐度没有明显相关性,产生这种差别的原因主要是因为不同站位盐度不同,造成浮游植物组成及生物量的差异,盐度引起的细胞内DMSO的改变及藻种的变化是两个不同的过程,因而对DMSOp的生产带来的影响可能无法通过简单相关性关系解释。海水温度反应了海水受太阳光辐射的强度[7],DMSO作为细胞内抗氧化系统的一部分,叶绿体光化学合成副产物活性氧自由基会参与反应,但在增加抗氧化活性时是促进DMS向DMSO转化或DMSO向甲基磺酸盐(MSA)转化[36]仍不确定,可能是造成温度与DMSO没有明显相关性的主要原因。
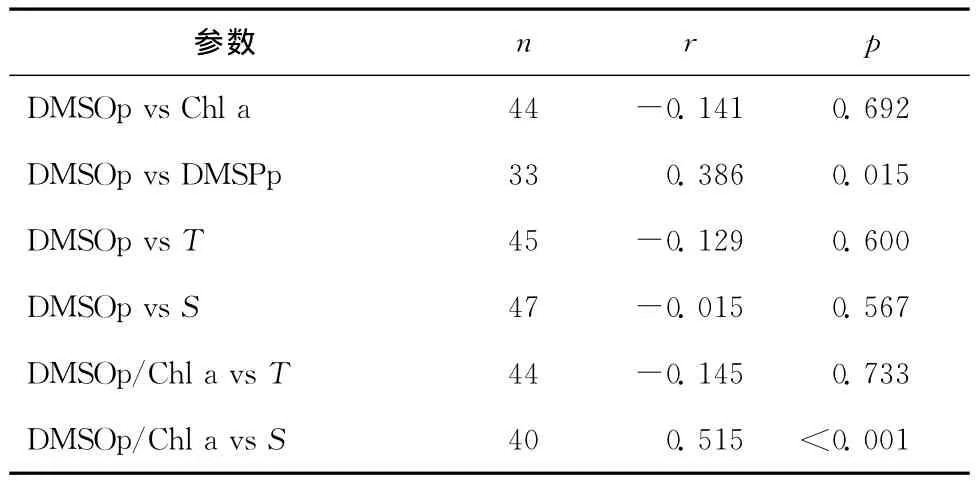
表2 东海表层海水中DMSOp与Chl a、DMSPp、温度、盐度以及DMSOp/Chl a与温度、盐度之间的相互关系
3.3.2 DMSOd与环境因素相关性分析
海洋环境中DMSOd的来源主要有3条途径:DMS的光化学氧化和微生物氧化以及细胞内DMSO的释放[37]。本文中将DMSOd浓度分别与DMS、DMSOp进行线性拟合(见表3),发现DMSOd的浓度与DMS有一定的正相关性(n=35;r=0.444;p=0.004),说明DMS的两种氧化途径可能是影响东海海域DMSOd来源与分布的重要因素。
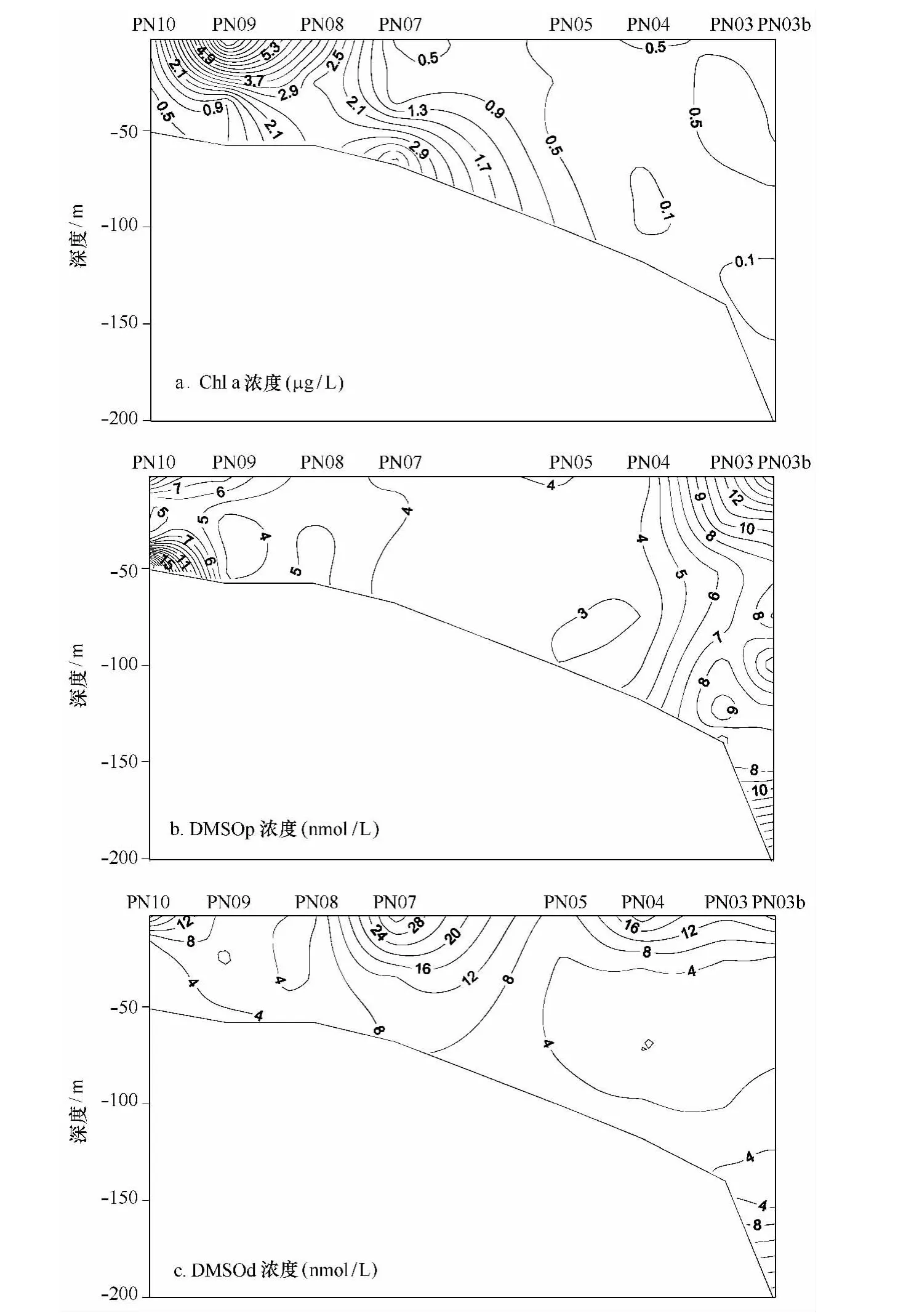
图3 东海PN断面Chl a浓度(a)、DMSOp浓度(b)和DMSOd浓度(c)垂直分布
此外,DMS的光化学氧化速率受到溶解有机碳(DOC)、温度和水深等因素的影响[38-39],而 DMS的微生物氧化速率可以通过总细菌丰度来进行初步评价。因此,本文中我们对DMSOd与海区内的海水温度、DOC、总细菌丰度以及NO-3进行相关性分析(见表3),仅发现DMSOd与温度(n=43;r=0.460;p=0.001)具有一定的相关性,原因可能是DMS的光化学氧化速率常数随温度的升高呈指数增加[39],从而贡献较高的DMSOd浓度。
DMS的光化学反应可以发生在UV及可见光区,但DMSO并不是DMS光化学反应的唯一产物,反应会受到光强度、DOC、DMS浓度等多因素影响。Hatton[40]认为在 DOC浓度为0.9 mg/d m3的情况下,UVA/可见光区中有99%的DMS转化为DMSO,因此DOC是DMSOd光化学生成的一个重要条件。Bouillon和Miller[41]认为DMS的表观量子系数会受到NO-3浓度影响,因此无法通过DMS与DOC或NO-3单一的相关性关系判断各环境因素对DMS光化学反应的影响。另外,不同细菌对DMS的氧化降解也不尽相同,无氧及有氧条件下细菌均可消耗DMS,DMS被利用目的不同,产物也随之不同,而且只有特定的细菌种群氧化DMS生成DMSO[3],从而导致难以获得DMSOd与总细菌丰度的相关关系。

表3 东海表层海水中DMSOd与DMS、DMSOp、温度、DOC、总细菌丰度、NO-3之间的相互关系
4 结论
(1)秋季东海表层海水中DMSOp与DMSOd浓度相接近,但二者水平分布有一定差异。DMSOp分布与Chl a相类似,呈现由近岸到远海逐渐降低的趋势,浓度高值出现在长江口及东海西南部海域,DMSOd高值区则主要集中在东海西南部上升流附近海域。
(2)PN断面垂直分布上,DMSOp浓度变化较小,在近岸底层出现高值;DMSOd浓度在表层出现高值,随深度增加逐渐降低。
(3)东海表层海水中DMSOp与DMSPp以及DMSOp/Chl a比值与盐度分别存在一定的相关性,说明藻细胞中DMSOp与DMSPp功能相似,都具有一定的渗透压调节功能。
(4)秋季东海DMSOd与DMS表现出一定的正相关关系,说明秋季DMS氧化也是表层海水DMSOd的一个重要来源途径。
[1]Andreae M O.Ocean-at mosphere interactions in the global biogeochemical sulf ur cycle[J].Marine chemistry,1990,30:1—29.
[2]Bri mblecombe P,Shooter D.Photo-oxidation of di methylsulfide in aqueous solution[J].Marine Chemistry,1986,19:343—353.
[3]Zeyer J,Eicher P,Wakeham S G,et al.Oxidation of DMS to DMSO by phototrophic purple bacterica[J].Applied and Environmental Microbiology,1987,53:2026—2032.
[4]Zhang L.Oxidation of di methylsulfide by Peseudomonas acidovorans DMR-11 isolated from peat biofilter[J].Biotechnology Letters,1991,13:223—228.
[5]SimóR,Hatton A D,Malin G,et al.Particulate dimethyl sulphoxide in sea water:production by microplankton[J].Marine Ecology Progress Series,1998,167:291—296.
[6]Hatton A D,Darroch L,Malin G.The role of di methylsulphoxide in the marine biogeochemical cycle of dimethylsulphide[J].Oceanography Marine Biology Annual Review,2004,42:29—56.
[7]SimóR,Vila-Costa M.Ubiquity of algal dimethylsulfoxide in the surface ocean:Geographic and temporal distribution patterns[J].Marine Chemistry,2006,100:136—146.
[8]del Valle D A,Kieber D J,Toole D A,et al.Dissolved DMSO production via biological and photochemical oxidation of dissolved DMS in the Ross Sea,Antarctica[J].Deep-Sea ResearchⅠ,2009,56:166—177.
[9]Hatton A D,Turner S M,Malin G,et al.Dimethylsulphoxide and other biogenic sulphur compounds in t he Galapagos Plu me[J].Deep-Sea ResearchⅡ,1998,45:1043—1053.
[10]Andreae M O.Di methylsulfoxide in marine and freshwaters[J].Li mnology and Oceanography,1980,25:1054—1063.
[11]Berreshei m H,Eisele F L,Tanner D J,et al.At mospheric sulfur chemistry and CCN concentrations over the Northeastern Pacific coast[J].Journal of Geophysical Research,1993,98:12701—12711.
[12]Putaud J P,Davison B M,Watts S F,et al.Dimethylsulfide and its oxidation products at t wo sites in Brittany(France)[J].At mospheric Environment,1999,33:647—659.
[13]Li M,Yuan D X,Li Q L,et al.Sequential analysis of dimethyl sulf ur compounds in seawater[J].Chinese Chemical Letters,2007,18:99—102.
[14]李猛,袁东星,汤坤贤.围隔藻类水华演替过程中二甲基硫化物的含量动态[J].生态学报,2007,27(12):5308—5317.
[15]孙倩,金晓英,李猛,等.厦门西海域典型站位二甲基硫化物的周日变化初探[J].环境化学,2006,25(3):351—355.
[16]Milliman J D,Meade R H.World wide delivery of river sedi ment to the oceans[J].Jour nal of Geology,1983,91:1—21.
[17]苏纪兰.中国近海的环流动力机制研究[J].海洋学报,2001,23(3):1—16.
[18]周名江,朱明远,张经.中国赤潮的发展趋势和研究现状[J].生命科学,2001,13(2):53—59.
[19]Yang J,Yang G P.Distribution of dissolved and particulate dimethylsulfoxide in the East China Sea in winter[J].Marine Chemistry,2011,127:199—209.
[20]Si móR,Malin G,Liss P S.Refinement of the borohydride reduction method for trace analysis of dissolved and particulate dimethyl sulfoxide in marine water samples[J].Analytical Chemistry,1998,70:4864—4867.
[21]Yang G P,Jing W W,Li L,et al.Distribution of dimethylsulfide and di methylsulfoniopropionate in t he surface microlayer and subsurface water of the Yellow Sea,China during spring[J].Jour nal of Marine Systems,2006,62:22—34.
[22]杨洁.中国海域中二甲基亚砜的分析测定与分布研究[D].青岛:中国海洋大学,2011.
[23]张洪海,杨桂朋.胶州湾及青岛近海微表层与次表层中二甲基硫(DMS)与二甲巯基丙酸(DMSP)的浓度分布[J].海洋与湖沼,2010,41(5):683—691.
[24]张艳萍.中国近海溶解碳水化合物的浓度分布与影响因素[D].青岛:中国海洋大学,2010.
[25]何真.中国陆架海挥发性卤代烃的分布、来源与海-气通量研究[D].青岛:中国海洋大学,2013.
[26]Bouillon R C,Lee P A,de Mora S J,et al.Vernal distribution of dimethylsulphide,dimethylsolphoniopropionate,and di methylsulpoxide in the North Water in 1998[J].Deep-Sea ResearchⅡ,2002,49:5171—5189.
[27]Riseman S F,Di Tullio G R.Particulate dimethylsulfoniopropionate and dimethylsulfoxide in relation to iron availability and algal community structure in the Peru Up welling System[J].Canadian Journal of Fisheries and Aquatic Sciences,2004,61:721—735.
[28]Lee P A,Haase R,de Mora S J,et al.Di methylsulfoxide(DMSO)and related sulfur compounds in t he Saguenay Fjord,Québec[J].Canadian Journal of Fisheries and Aquatic Sciences,1999,56:1631—1638.
[29]曹欣中.浙江近海上升流季过程的初步研究[J].水产学报,1986,10(1):51—56.
[30]李玲,诸裕良,倪晓.东海PN断面水文、生化要素的时空分布特征[OL].[2007-07-19].中国科技论文在线,http://www.paper.edu.cn/releasepaper/contont/200707-346
[31]Del Valle D A,Kieber D J,Kiene R P.Depth-dependent fate of biologically-consumed di methylsulfide in the Sargasso Sea[J].Marine Chemistry,2007,103:197—208.
[32]宋书群.黄、东海浮游植物功能群研究[D].青岛:中国科学院海洋研究所,2010.
[33]Hatton A D,Wilson S T.Particulate di methylsulphoxide and di methylsulphoniopropionate in phytoplankton cultures and Scottish coastal waters[J].Aquatic Science,2007,69:330—340.
[34]Lee P A,de Mora S J.Intracellular di methylsulfoxide(DMSO)in unicellular marine algae:speculations on its origin and possible biological role[J].Journal of Phycology,1999,35:8—18.
[35]Gröne T,Kirst G O.The effect of nitrogen deficiency,methionine and inhibitors of methionine metabolism on the DMSP contents of Tetrasel mis subcordifor mis(Stein)[J].Marine Biology,1992,112:497—503.
[36]Sunda W,Kieber D J,Kiene R P,et al.An antioxidant f unction for DMSP and DMS in marine algae[J].Nature,2002,418:317—320.
[37]del Valle D A,Kieber D J,Bisgrove J,et al.Light-sti mulated production of dissolved DMSO by a particle-associated process in the Ross Sea,Antarctica[J].Li mnology and Oceanography,2007,52:2456—2466.
[38]Brugger A,Slezak D,Obernosterer I,et al.Photolysis of dimethylsulfide in the northern Adriatic Sea:Dependence on substrate concentration,irradiance and DOC concentration[J].Marine Chemistry,1998,59:321—331.
[39]Toole D A,Kieber D J,Kiene R P,et al.High dimethylsulfide photolysis rates in nitrate-rich Antarctic waters[J].Geophysical Research Letters,2004,31:L11307.
[40]Hatton A D.Influence of photochemistry on the cycling of di methylsulphide in the northern North Sea[J].Deep-Sea ResearchⅡ,2002,49:3039—3052.
[41]Bouillon R C,Miller W L.Deter mination of apparent quantu m yield spectra of DMS photodegradation in an in situ iron-induced Northeast Pacific Ocean bloom[J].Geophysical Research Letters,2004,31:L06310.
