白令海和楚科奇海表层沉积物中多环芳烃降解微生物多样性
2014-10-26张荣秋董纯明盛华芳白秀花矫立萍刘金禄汪卫国周宏伟邵宗泽
张荣秋,董纯明,盛华芳,白秀花,矫立萍,刘金禄,汪卫国,周宏伟,邵宗泽*
(1.国家海洋局 第三海洋研究所 海洋生物遗传资源重点实验室,福建 厦门361005;2.国家海洋局 第三海洋研究所海洋-大气化学与全球变化重点实验室,福建 厦门361005;3.国家海洋局 第三海洋研究所 海洋与海岸地质环境实验室,福建 厦门361005;4.南方医科大学 公共卫生与热带医学学院环境卫生系,广东 广州510515)
1 引言
多 环 芳 烃 (polycyclic aromatic hydrocarbon,PAH)是陆地向海洋中输入的重要持久性污染物之一,由于它对哺乳动物具有致畸、致癌和致突变的特性,美国环保局将其列为优先治理的环境污染物[1—2]。环境中PAHs污染的治理,除使用物理化学的方法外,生物修复的方法越来越受到重视。目前,海洋环境中已经发现多种能够降解PAHs的细菌,如解环菌Cycloclasticus、新鞘氨醇杆菌Novosphingobium、海杆菌Marinobacter、假交替单胞菌Pseudoalteromonas、假单胞菌Pseudomonas和海神单胞菌属Neptunomonas等[3—4]。
由于PAHs化学性质稳定,易在环境中长期残留,所以在“全球蒸馏效应”的作用下,能够从人类活动地区向北极迁移[5—9]。有研究表明,北极地区动物体内、陆地土壤、海洋沉积物中均能检测到PAHs[10—11]。北极地区常年低温,影响了PAHs的生物利用性,同时由于气候环境条件恶劣导致采样困难,所以相比于其他海洋环境,有关北极地区PAHs降解微生物的研究报道较少,且多集中在极地的陆地土壤环境中,优势降解菌以Pseudomonas为主[12—14]。而有关极地海洋表层沉积物中PAHs降解微生物种群的研究,特别是白令海至楚科奇海大尺度范围内,海洋表层沉积物中PAHs降解菌种群结构的研究还未见报道。
本研究以萘、菲、芘为唯一碳源和能源,对采自白令海至楚科奇海8个站位的14个表层沉积物进行了富集,并通过平板分离的可培养手段,及DGGE和Illumina高通量测序的非培养手段分析了降解菌群的结构,并对其中可培养菌株的PAHs降解能力进行了初步的研究。
2 材料和方法
2.1 材料
2.1.1 样品采集
2010年7—9月,“雪龙”号破冰船在执行中国第四次北极科学考察期间,白令海和楚科奇海8个站位的14份表层沉积物样品被采集。除B07站位样品由多管采泥器采集外,其他样品均由箱式采泥器采集。样品信息见图1和表1。
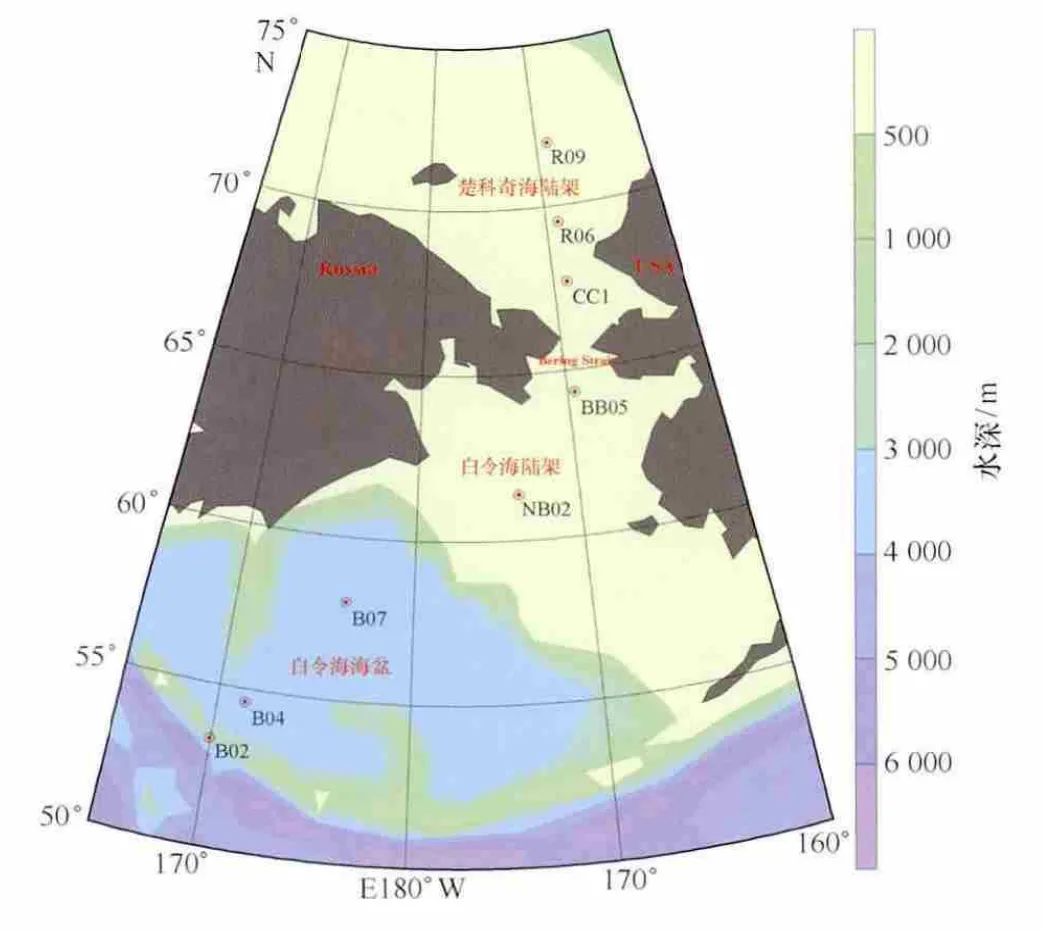
图1 采样站位
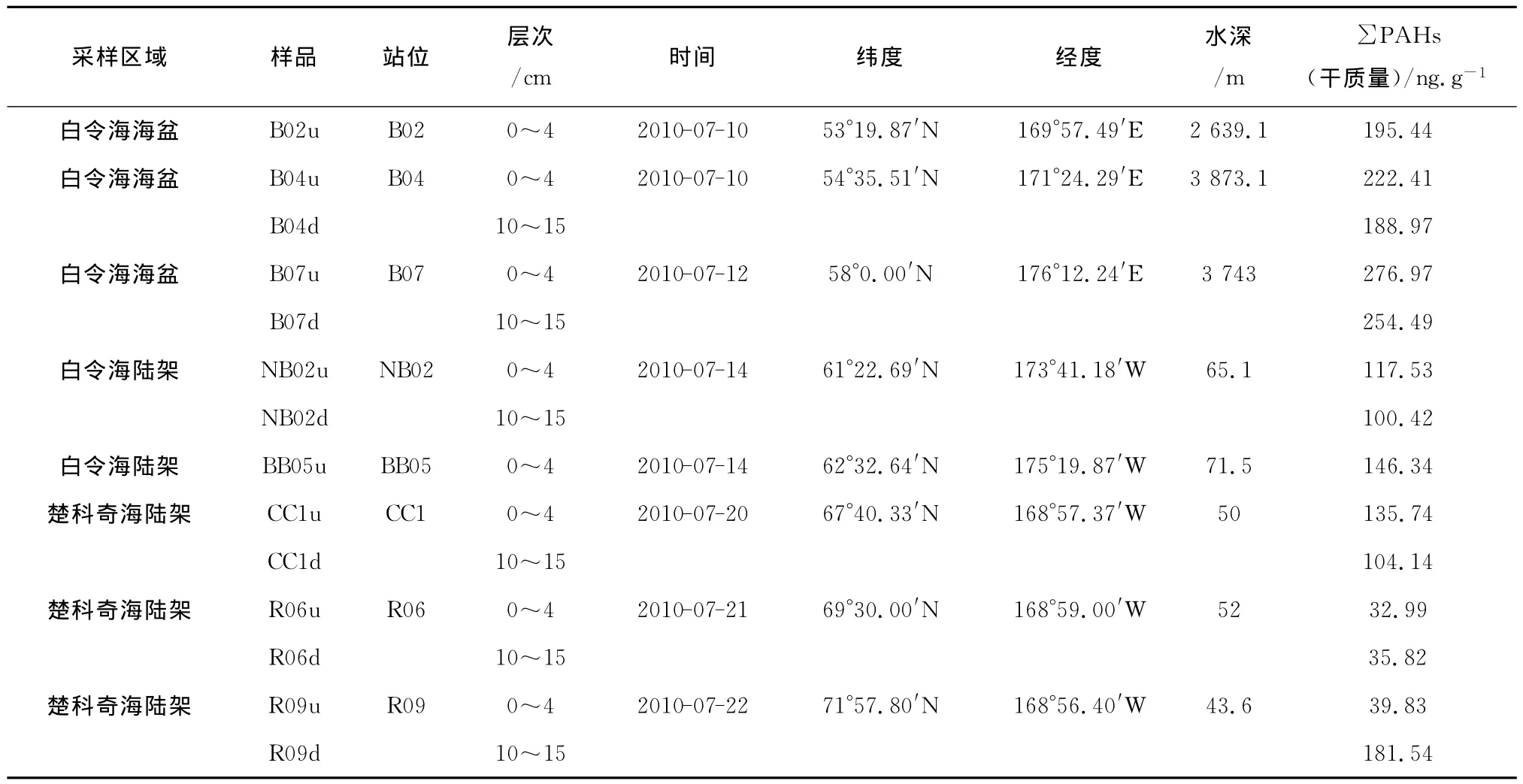
表1 白令海和楚科奇海表层沉积物采样站位
2.1.2 培养基
降解菌群富集用NH培养基配制方法参考文献[4],但使用原位海水替代实验室陈海水。降解菌分离用的M8培养基参考文献[15]配制。
2.1.3 引物
细菌16S r RNA基因扩增引物,16SF(5’-AGAGTTTGATCCTGGCTCAG-3’),16SR (5’-ACGGCTACCTTGTTACGACT -3’);Box-PCR 引物,BOXA1R (5’- CTACGGCAAGGCGACGCTGACG-3’);PCR-DGGE引物,V3F (5’-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGG GGGGCCTACGGGAGGCAGCAG-3’);V3R (5’-ATTACCGCGGCTGCTGG-3’);细菌16Sr RNA V6区Illumina高通量测序Barcode引物967F(5’-NNNNNNNNGTCNACGCGAAGAACCTTANC-3’),1046R(5’-GCATTCGACAGCCATGCANCACCT-3’)。
2.1.4 主要试剂及仪器
萘(纯度大于99.8%)购自国药集团化学试剂有限公司;菲和芘(纯度大于97%)购自Sigma-Aldrich公司;PCR相关试剂购自Fer mentas公司;恒温摇床和超净工作台(上海智诚分析仪器制造有限公司);生化培养箱(上海精宏实验设备有限公司);AlphaInnotech凝胶成像仪(SanLeandro,California);PCR扩增仪(Bio-Rad);Decode System 电泳仪(Bio-Rad公司);p GEMⓇ -T Easy Vector Systems(Promega)。
2.2 沉积物中PAHs含量分析
沉积物中PAHs的抽提、纯化、GC-MS定量分析方法参考文献[15],其中美国环保局推荐优先治理的16种PAHs被定量分析,定量方法采用内标法。
2.3 PAH降解菌的富集和分离鉴定
14份沉积物样品在船上采集后,分别取5 g接种于250 mL NH富集培养基中,并补加1 mL内含PAHs的原油(萘、菲、芘在培养基中终浓度分别为:200、100和50 mg/L),于4℃静置避光培养(约2~3个月)。回实验室后,取10 mL富集物转接到100 mL新鲜的NH培养基中,并补加PAHs混合物(终浓度同上),25℃,150 r/min避光培养4周。随后,富集物梯度稀释涂布M2培养基平板,25℃避光培养2周后,挑取不同形态的单菌落,在M2平板上划线纯化两次后保藏菌种,同时收集部分菌体用于基因组DNA的抽提。
2.4 细菌DNA提取和系统进化分析
菌株及菌群基因组DNA的提取按照细菌基因组DNA提取试剂盒说明书进行。同一站位分离的菌株利用BOX-PCR(94℃,4 min;94℃,15 s,53℃,30 s,65℃,8 min,共35个循环;65℃,25 min)剔除重复菌株。剩余菌株的16Sr RNA基因被扩增、测序并提交NCBI Blast N 和 EzBio Cloud网站(http://eztaxon-e.ezbiocloud.net/)进行系统发育分析;最后用 MEGA(version 4.0)软件构建系统进化树(Neighbor-Joining算法)。
2.5 富集菌群结构的PCR-DGGE和Illumina高通量测序分析
富集菌群16S r RNA基因V3区扩增、纯化和DGGE电泳分析,亮带切胶回收,测序过程参考文献[15]。同时,我们利用细菌16S r RNA基因V6区barcode引物扩增各个富集菌群的16Sr RNA基因V6区,PCR产物纯化后等摩尔比混合后,提交Illumina HiSeq2000测序平台进行Pair-end(100 bp)测序分析。测序后高通量数据分析采用BIPES流程,read的聚类采用TSC算法[16-17],并以97%的序列相似性作为OTU划分的标准,read系统发育地位的确定采用GAST(Global Alignment for Sequence Taxonomy)方法[18-19]。菌群聚类分析采用 PRI MER (v6.1.5)软件;CA分析使用Canoco(V4.5)软件。
2.6 可培养菌株PAH降解能力验证
从平板上刮取新鲜的菌株培养物,接种于50 mL内含PAHs混合物的NH培养基中,25℃,150 r/min培养3周,通过测定细胞浓度(OD600),及观察比较培养物颜色变化情况来判断菌株是否利用PAHs。
3 结果
3.1 沉积物中PAHs定量分析
GC-MS定量结果表明,14个表层沉积物中PAHs总干质量介于32.99~276.97 ng/g(见表1),海盆区(白令海)表层沉积物中PAHs含量高于陆架区(白令海和楚科奇海),所有样品中3环及3环以下PAHs的量占PAHs总量的90%以上。菲和芴分别是每个样品中含量最高的两种PAHs。
3.2 可培养菌株的分离鉴定与系统进化分析
4℃富集菌群转接到25℃培养4周后,14个富集菌群中分离获得51株细菌。系统进化分析表明它们分属于γ-proteobacteria,α-proteobacteria,Actinobacteria,Fir micutes和Bacteroidetes门中的17个属(见图2)。其中γ-proteobacteria门是优势类群,占可培养菌株总数的58.82%,它们多归属于Marinobacter、Halomonas、Pseudoalteromonas和Pseudomonas属;Actinobacteria门占19.61%,主要种属是Dietzia、Salinibacterium和Isoptericol a;归属于α-proteobacteria、Bacteroidetes和Fir micutes门菌株的比例较小,分别是7.84%、7.84%和5.88%。总体上而言,Marinobacter是25℃富集菌群中优势属,占可培养菌株总数的29.41%。
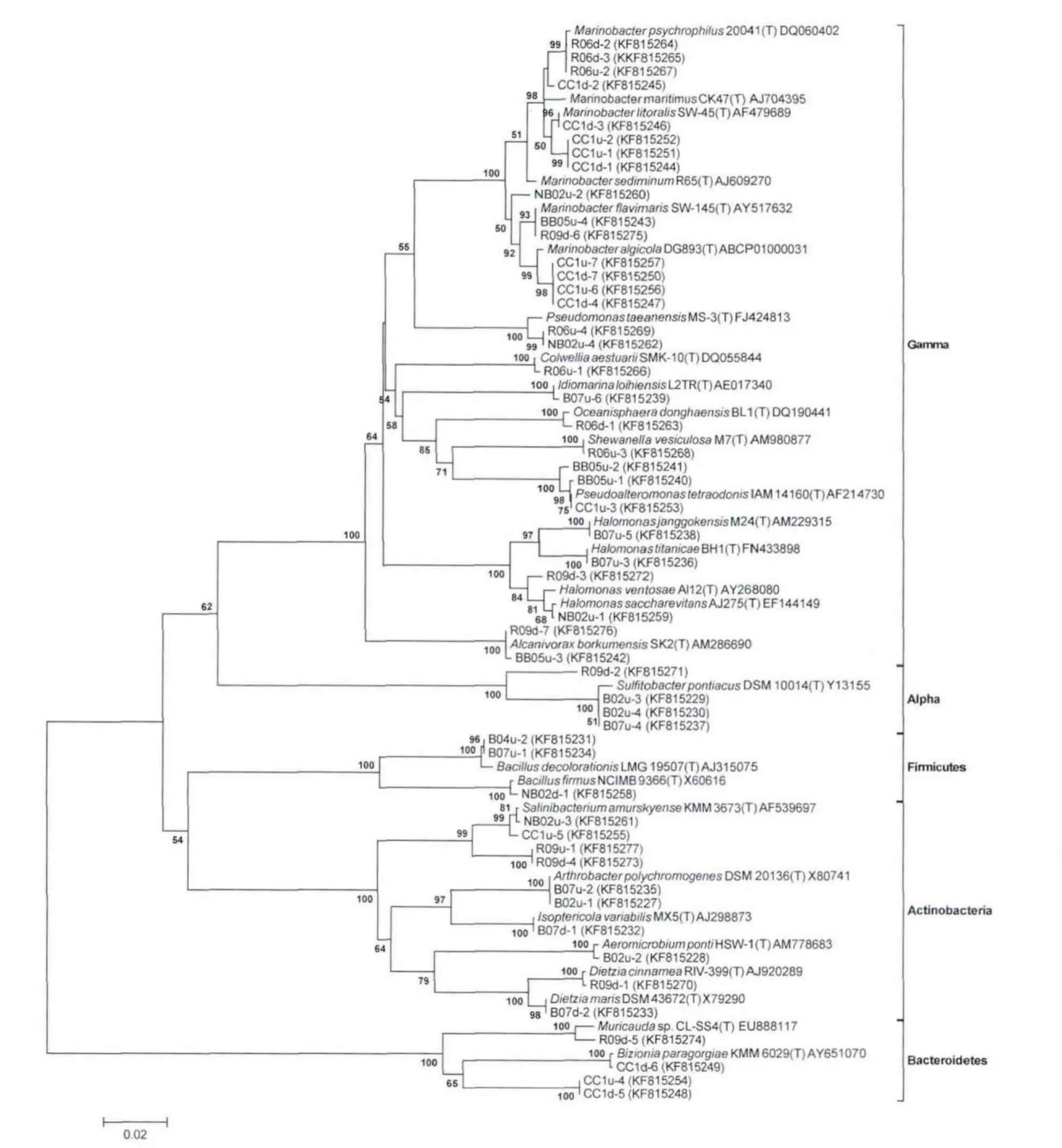
图2 富集菌群中可培养菌株的16Sr RNA基因系统发育树
3.3 菌株PAH降解能力验证
将富集菌群中可培养菌株接种于补加PAHs的NH培养基中,3周后观察其生长情况(见表2)。菌株以3种PAHs为碳源和能源生长的情况表明,共有7株菌可单独利用PAHs生长,其中2株迪茨氏菌(Dietzia)都具有很好的降解效果。

表2 可培养菌株对PAHs降解能力的验证
3.4 菌群组成的PCR-DGGE分析
为了分析PAHs降解菌群的种群组成,我们以25℃富集菌群的总DNA为模板,利用细菌16Sr RNA基因V3区引物进行扩增,获得长约200 bp的扩增产物,随后进行变性梯度凝胶电泳(DGGE)分析(图3)。通过对菌群中亮带的切胶回收、克隆测序和比对分析,鉴定亮带所对应的菌株,从而解析菌群中的优势菌株。
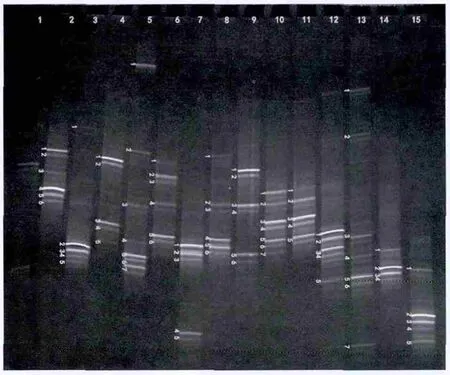
图3 PAHs降解菌群组成的DGGE分析
DGGE结果表明,14个菌群中除R06d和B07u等2个菌群结构较为简单外,其余12个菌群中亮带均较多,这说明PAHs降解菌群中细菌种群多样性较高(图3)。14个菌群中所有切胶测序的79个亮带对应的最近缘菌株共来自26个细菌属,包括γ变形菌门的Marinobacter,Pseudoalteromonas,Pseudomonas,Halomonas,Thal assolituus,Oceanisphaer a,Coclei monas,Rhodanobacter,Methylophaga,Alcanivor ax和Marinomonas;α变形菌门的Sinor hizobium,Roseovarius,Sul f itobacter,Sphingosinicella,Methylobacterium;β变形菌门的Achromobacter;CFB类群的Maribacter,Bacillus,Salegentibacter,Muricauda和Sedi minicol a;以 及 Actinobacteria门 的Dietzia,Nocar dioides,Salinibacterium和Saccharothrix。上述种属中有12个获得了纯培养菌株,这包括γ变形菌门的Marinobacter,Halomonas,Pseudoalteromonas,Pseudomonas,Alcanivorax和Oceanisphaer a;α变形菌门的Sul f itobacter;CFB 类 群 的Bacill us,Maribacter和Muricauda,以及Actinobacteria门的Salinibacterium和Dietzia。
3.5 菌群结构的Illumina高通量测序分析
为了进一步分析14个降解菌群的种群结构,我们利用Illu mina HiSeq2000测序平台,采用Pair-end 100 bp测序策略,对菌群中细菌16S V6高变区进行了高通量测序。14个菌群共获得172 410条reads,去除低质量reads及嵌合体(Chi mera)后,共获得149 838条Clean reads(约61 bp),平均每个菌群获得10 700条Clean reads,随后这些Clean reads被用于种群结构分析。聚类分析结果表明,这些Clean reads归属于15 455个Unique,5 585个OTU(见表3)。多样性指数结果表明,来自白令海盆及陆架富集菌群的多样性指数较高,如B04站位;而来自楚科奇海的较低,如R06站位。
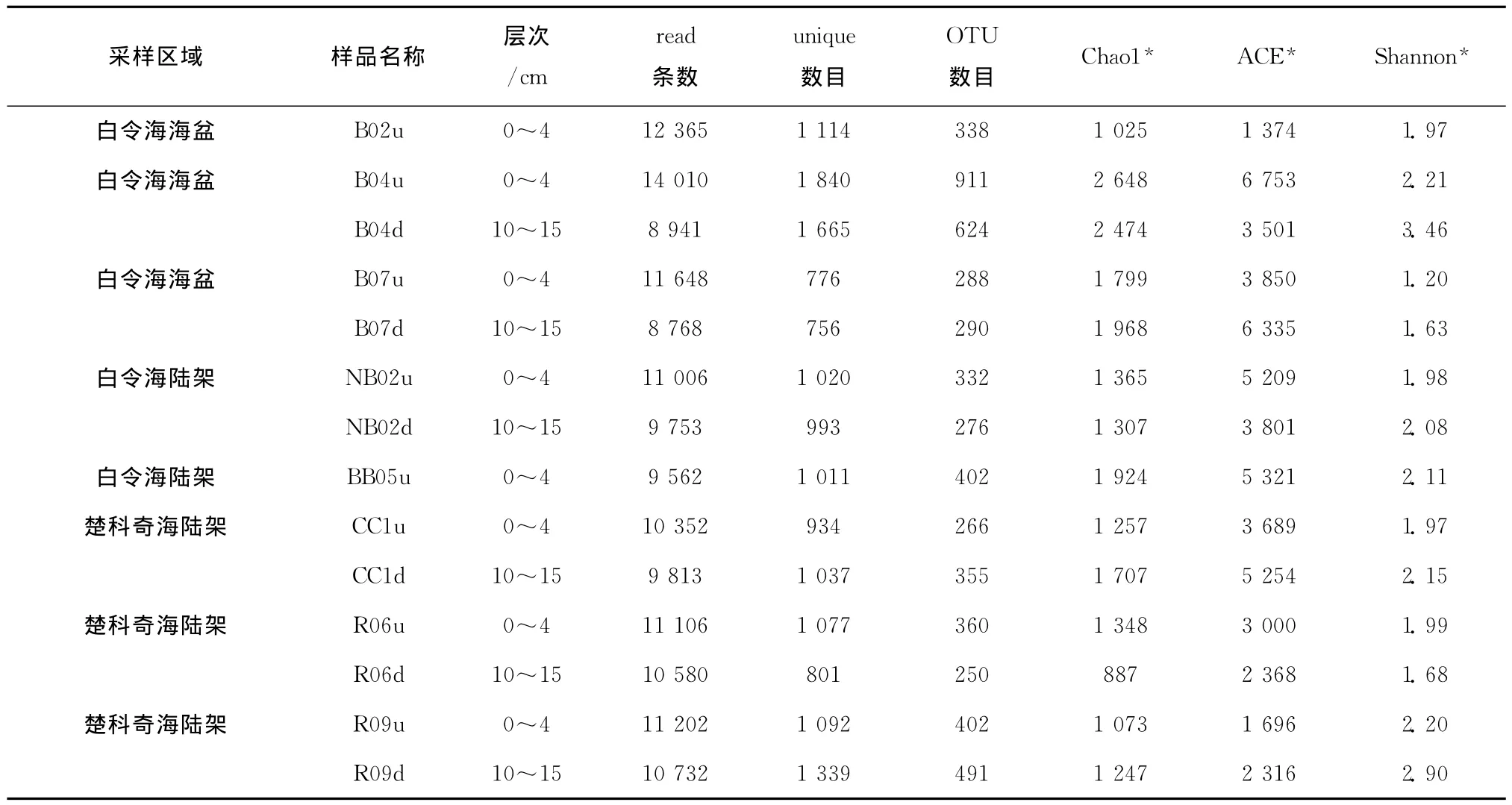
表3 富集菌群Illumina高通量测序结果及多样性评估
3.5.1 稀释度曲线
稀释度曲线显示,所有菌群中检测到的OTU(97%序列相似度)数目介于200~600个(图4);同时,所有菌群的覆盖率介于72%~87.1%,这些结果说明14个PAHs富集菌群中细菌多样性丰富。相比较而言,B04u和B04d两个菌群中微生物多样性最丰富,其稀释度曲线还未趋于饱和。
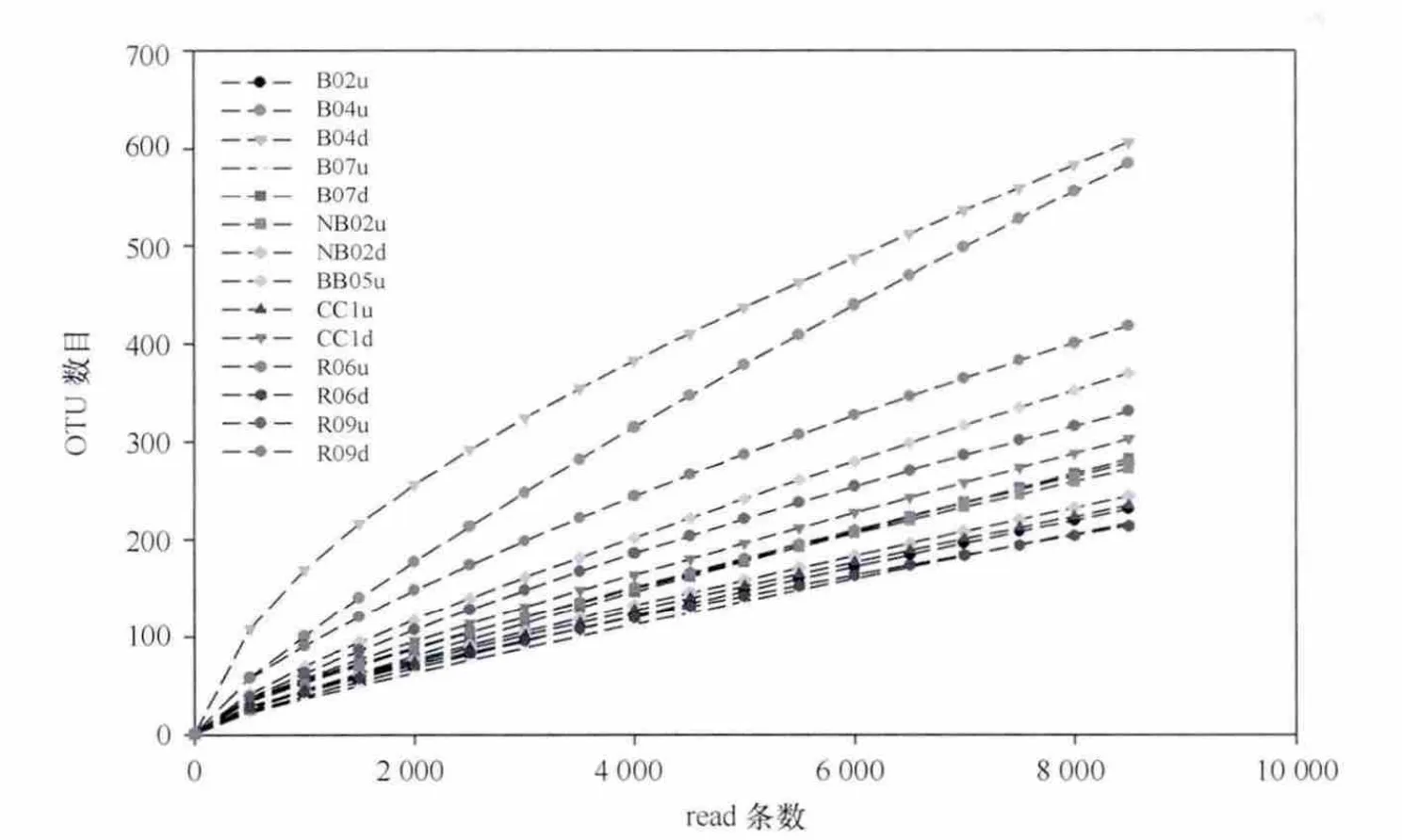
图4 PAHs降解菌群的稀释度曲线
3.5.2 种群结构聚类分析
14个菌群的聚类和CA分析均表明,所有14个富集菌群可以分为2个类群:陆架类群(Bering and Chukchi Shelves)和海盆类群(Bering Basin)。陆架类群中包括9个来自水深较浅的白令海和楚科奇海陆架;而海盆类群的5个菌群均来自水深较深的白令海海盆(图5A)。CA分析结果表明,除B07u菌群外,陆架和海盆两个类群能够很好地被PC2轴区分(variable value=23.8%),特别是9个来自陆架区的菌群在CA结果中高度集中(图5B),这表明这9个菌群的结构存在较高的相似性。相反,4个来自海盆区的菌群在CA结果中分布的较分散。
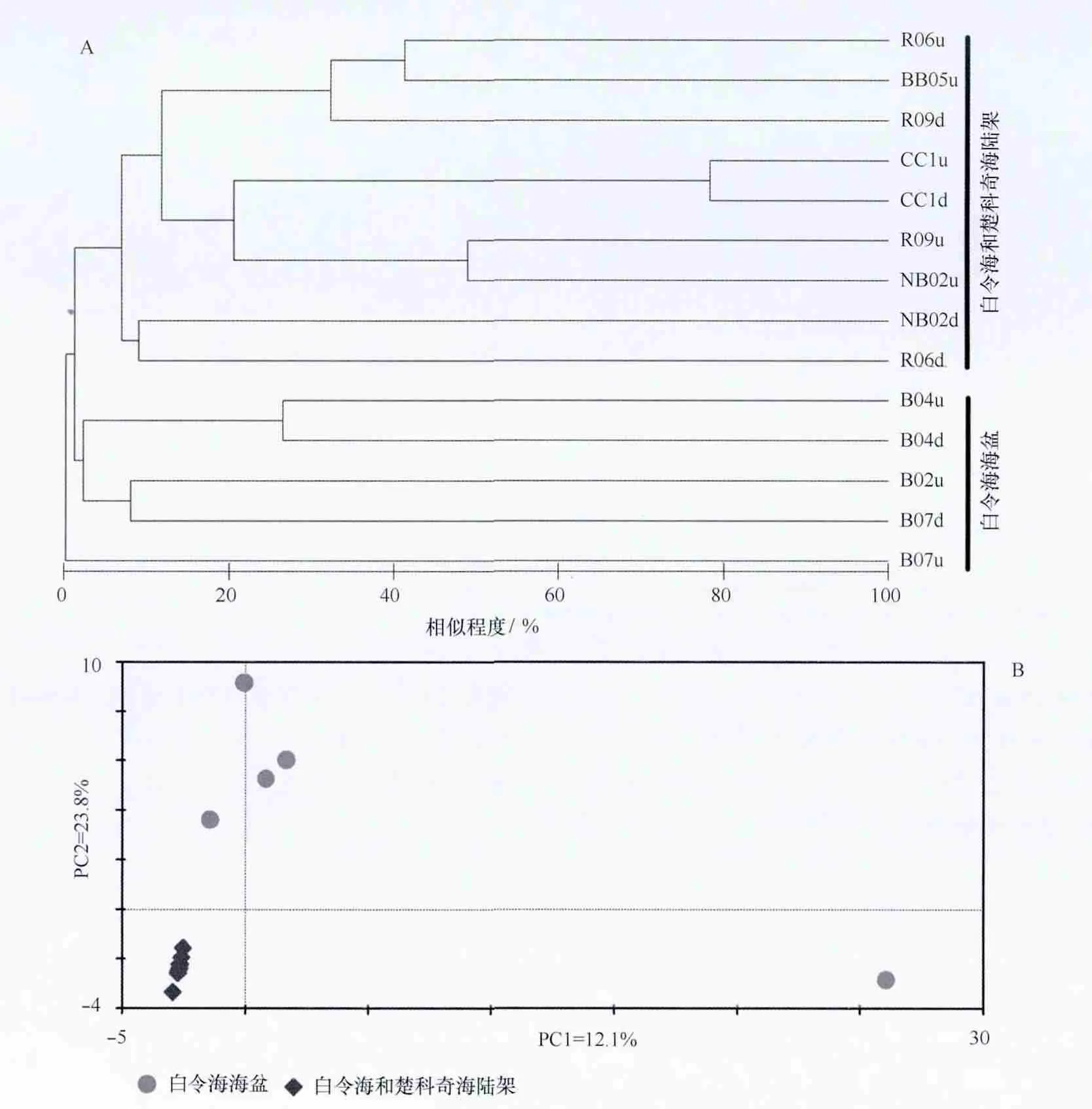
图5 PAHs降解菌群结构的聚类分析
3.5.3 种群结构分析
在所有14个测序菌群的149 838条Reads中,属于Proteobacteria门的reads占绝对优势(75.5%),而分列第二位和第三位Actinobacteria和Fir micutes门的比例仅为12.5%和9.5%。除B02u、B04u、B07d和NB02d站位外,γ变形菌群的细菌是各个富集菌群中的优势类群,特别是在陆架区的降解菌群中,比例更是高达66.4%。
14个菌群共检测到232个属,丰度最高的10个属依次是:Pseudomonas,Marinobacter,Halomonas,Bacillus,Pseudoalteromonas,Sul f itobacter,Shewanell a,Leif sonia,Dietzia和Roseovarius(见图6)。但具体到每个菌群,种属组成变化较大,例如已报道的PAHs降解菌Pseudomonas主要集中在陆架区的NB02u、CC1u、CC1d和 R09u站位;Marinobacter主要在集中在陆架区的BB05u、R06u、R06d和R09d站位;Pseudoalteromonas则主要集中在陆架区的BB05u、CC1u、CC1d和R09u站位;Dietzia则主要集中在陆架区的B07d站位;Halomonas多分布在B07u、NB02u和R09d站位。此外,我们也发现了海洋专属的PAHs降解菌Cycloclasticus,它多分布在陆架区的富集菌群中(0.01%~7.74%),特别是在BB05u站位中比例高达7.7%。
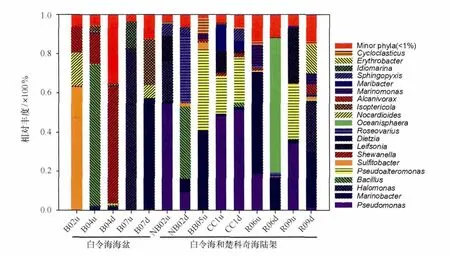
图6 富集菌群在属水平上相对丰富分析
4 讨论
北极地区相对于其他环境,受人类活动影响较小,虽然环境受污染程度较轻,但是持久性有机污染物能够通过“全球蒸馏效应”在极地冷却沉降,本研究也从白令海至楚科奇海表层沉积物中检测到多种PAHs,这为PAHs降解菌的存在提供了物质基础。但是,相比于近海环境,本研究中14个表层沉积物中16种PAHs总量远低于近岸环境[20—22]。
平板纯培养、PCR-DGGE和Illumina高通量测序结果都表明,14个菌群中优势的降解菌主要是γ变形菌门的Marinobacter,Pseudoalteromonas,Pseudomonas和Actinobacteria门的Dietzia菌;然而,多数近海和大洋环境中优势的PAHs降解菌多是Cyclocl asticus,Novosphingobium和Pseudomonas[4,15,23—25]。前期对北极地区土壤中PAHs降解菌群的研究发现,Pseudomonas往往是菌群中的优势菌[12—14],所以推测本研究中PAHs降解菌群中的Pseudomonas可能是随陆源河水输入到白令海和楚科奇海中。Pseudoalteromonas菌代谢功能多样,是极地等低温环境中常见的可培养类群,也经常被发现于极地来源的石油及PAHs降解菌群中[26—29],所以其在本研究的降解菌群中是优势种属符合前期研究结果。Marinobacter菌是海洋环境中专属的烃类降解菌[30],前期已有报道证实在北极石油污染的海冰中Marinobacter是其中重要的类群[31],同时近期也有研究表明它可以降解PAHs[32],所以我们的结果暗示了它和Pseudomonas菌可能是北极低温环境中重要的PAHs降解菌。此外,放线菌门的Dietzia菌虽然不是降解菌群中优势的种属,但单菌降解实验结果表明,它们对PAHs具有一定的降解效果(表2)。
在进行降解菌群结构分析时,虽然PCR-DGGE是经典的方法,但是它只能检测到菌群中丰度大于1%的类群[33]。而Illumina测序技术能够提供更高的测序通量和深度,能够发现菌群中丰度更低(<0.01%)的种属。如本研究中用纯培养和PCRDGGE技术分别获得了17和26个细菌属,而通过Illumina高通量测序技术,共检测到232个细菌属,这其中包括多种纯培养及PCR-DGGE技术未检测到的PAHs降解菌,如:Cycloclasticus,Sphingopyxis,Alteromonas,Neptunomonas和Sphingomonas等。以上结果暗示了,多种类型的PAHs降解菌存在于北极表层沉积物中,但仅有少量能够长期适应北极特殊环境的PAHs降解菌成为降解菌群中的优势类群。
5 结论
白令海及楚科奇海表层沉积物中PAHs总干质量介于32.99~276.97 ng/g,且呈现由深海海盆向陆架降低的趋势。纯培养、PCR-DGGE及Illu mina高通量测序结果均表明,该区域中优势的PAHs降解菌是Marinobacter,Pseudoalteromonas,Pseudomonas和Dietzia。此外,Illumina高通量测序结果还表明14个降解菌群在结构组成上,可分为海盆区和陆架区两种类群;同时降解菌群中也存在一些低丰度的海洋专属PAHs降解菌,如Cycloclasticus,Alteromonas和Neptunomonas等。
[1]Baird C.Environmental Chemistry[M].New York:W H.Freeman and Company,1995:276—278.
[2]Bezalel L,Hadar Y,Fu P P,et al.Cerniglia CE:Initial Oxidation Products in the Metabolism of Pyrene,Ant hracene,Fluorene,and Dibenzothiophene by t he White Rot Fungus Pleurotus ostreatus[J].Applied and environ mental microbiology,1996,62(7):2554—2559.
[3]Head I M,Jones D M,Roling W F M.Marine microorganisms make a meal of oil[J].Nature Reviews Microbiology,2006,4(3):173—182.
[4]Dong C,Chen L,Liao Y.Phylogenetic and degrading genes analysis of a PAHdegrading bacterium TVG9-Ⅶfrom deep-sea hydryther mal environment[J].Acta Microbiologica Sinica,2011,51(11):1548—1554.
[5]Goldberg E D.Synthetic organohalides in the sea[J].Proc R Soc Lond B Biol Sci,1975,189(1096):277—289.
[6]Fried man C L,Selin N E.Long-range at mospheric transport of polycyclic aromatic hydrocar bons:a global 3-D model analysis including evaluation of Arctic sources[J].Environmental science &technology,2012,46(17):9501—9510.
[7]Ding X,Wang X M,Xie Z Q,et al.At mospheric polycyclic aromatic hydrocarbons observed over the North Pacific Ocean and the Arctic area:Spatial distribution and source identification[J].At mospheric Environment,2007,41:2061—2072.
[8]Halsall C,Barrie L,Jones K,et al.Modelling the behaviour of PAHs during at mospheric transport from the UK to the Arctic[J].At mospheric Environ ment,2001,35(2):255—267.
[9]Wania F,Mackay D.Peer reviewed:tracking the distribution of persistent organic pollutants[J].Environmental science &technology,1996,30(9):390 A—396 A.
[10]Wang Z,Ma X,Na G,et al.Correlations bet ween physicochemical properties of PAHs and their distribution in soil,moss and reindeer dung at Ny-Alesund of the Arctic[J].Environ Pollut,2009,157(11):3132—3136.
[11]Hung H,Blanchard P,Halsall C J,et al.Temporal and spatial variabilities of at mospheric polychlorinated biphenyls(PCBs),organochlorine(OC)pesticides and polycyclic aromatic hydrocarbons(PAHs)in the Canadian Arctic:results from a decade of monitoring[J].The Science of t he total environ ment,2005,342(1-3):119—144.
[12]Whyte L G,Bourbonniere L,Greer C W.Biodegradation of petroleu m hydrocarbons by psychrotrophicPseudomonasstrains possessing both alkane(alk)and naphthalene(nah)catabolic pathways[J].Applied and environmental microbiology,1997,63(9):3719—3723.
[13]Sorensen S R,Johnsen A R,Jensen A,et al.Presence of psychrotolerant phenanthrene-mineralizing bacterial populations in contaminated soils from the Greenland High Arctic[J].FEMS microbiology letters,2010,305(2):148—154.
[14]Eriksson M,Sodersten E,Yu Z,et al.Degradation of Polycyclic Aromatic Hydrocarbons at Low Temperature under Aerobic and Nitrate-Reducing Conditions in Enrichment Cultures from Northern Soils[J].Applied and environmental microbiology,2003,69(1):275—284.
[15]Cui Z,Lai Q,Dong C,et al.Biodiversity of polycyclic aromatic hydrocarbon-degrading bacteria from deep sea sediments of the Middle Atlantic Ridge[J].Environ mental Microbiology,2008,10(8):2138—2149.
[16]Zhou H W,Li D F,Tam N F,et al.BIPES,a cost-effective high-t hroughput method for assessing microbial diversity[J].ISME J,2011,5(4):741—749.
[17]Jiang X T,Zhang H,Sheng H F,et al.Two-stage clustering(TSC):a pipeline for selecting operational taxonomic units for the high-throughput sequencing of PCR amplicons[J].PloS one,2012,7(1):e30230.
[18]Huse S M,Dethlefsen L,Huber J A,et al.Exploring microbial diversity and taxonomy using SSU r RNA hypervariable tag sequencing[J].PLoS genetics,2008,4(11):e1000255.
[19]Sogin M L,Morrison H G,Huber J A,et al.Microbial diversity in t he deep sea and t he underexplored“rare biosphere”[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(32):12115—12120.
[20]Baumard P,Budzinski H,Garrigues P.Polycyclic aromatic hydrocarbons in sediments and mussels of the western Mediterranean Sea[J].Environ Toxicol Chem,1998,17(5):765—776.
[21]Pereira W E,Hostettler F D,Rapp J B.Distribution and fate of chlorinated insecticides,biomarkers and polycyclic aromatic hydrocarbons in sediments along a contamination gradient from a point-source in San Francisco Bay,California[J].Mar Environ Res,1996,41:299—314.
[22]Witt G.Polycyclic aromatic hydrocarbons in water and sediment of the Baltic Sea[J].Marine pollution bulletin,1995,31:237—248.
[23]Wang B,Lai Q,Cui Z,et al.A pyrene-degrading consortiu m from deep-sea sediment of t he West Pacific and its key memberCycloclasticussp.P1[J].Environ Microbiol,2008,10(8):1948—1963.
[24]Cui Z,Shao Z.Predominant strains of polycyclic aromatic hydrocarbon-degrading consortia from deep sea of the Middle Atlantic Ridge[J].Actamicrobiologica Sinica,2009,49(7):902—909.
[25]Hilyard E J,Jones-Meehan J M,Spargo B J,et al.Enrichment,isolation,and phylogenetic identification of polycyclic aromatic hydrocar bon-degrading bacteria from Elizabeth River sedi ments[J].Appl Environ Microbiol,2008,74(4):1176—1182.
[26]Giudice A L,Bruni V,Domenico M D,et al.Psychrophiles-cold-adapted hydrocarbon-degrading microorganisms[M].Berlin:Springer,2010:1897—1921.
[27]林学政,沈继红,杜宁,等.北极海洋沉积物石油降解菌的筛选及系统发育分析[J].环境科学学报,2009,29(3):536—541.
[28]Lin X,Yang B,Shen J,et al.Biodegradation of crude oil by an arctic psychrotrophic bacteriumPseudoalteromomassp.P29[J].Current microbiology,2009,59(3):341—345.
[29]张月梅,祖国仁,那广水,等.北极耐冷石油降解菌的筛选、鉴定及其碳源利用广谱性[J].海洋环境科学,2010,29(2):216—220.
[30]Yaki mov M M,Timmis K N,Golyshin P N.Obligate oil-degrading marine bacteria[J].Curr Opin Biotechnol,2007,18(3):257—266.
[31]Deppe U,Richnow H H,Michaelis W,et al.Degradation of cr ude oil by an arctic microbial consortiu m[M].Extremophiles:life under extreme conditions,2005,9(6):461—470.
[32]Gao W,Cui Z,Li Q,et al.Marinobacternanhaiticussp.nov.,polycyclic aromatic hydrocarbon-degrading bacteriu m isolated from t he sedi ment of the Sout h China Sea[J].Antonie van Leeuwenhoek,2012.
[33]Muyzer G,de Waal E C,Uitterlinden A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S RNA[J].Appl Environ Microbiol,1993,59(3):695—700.
