EGFR、HER2、Ki-67、P53在进展期胃癌新辅助化疗疗效预测中的应用
2014-10-17崔海滨葛怀娥白希永张媛媛
崔海滨 葛怀娥 白希永 张 维 张媛媛
河北省沧州市中心医院肿瘤外一科,河北沧州 061001
胃癌手术切除是目前唯一可能根治胃癌的治疗方法,但仅限于病变较早的Ⅰ期胃癌。在我国,临床上大多数患者均为进展期胃癌,国内外大量研究证实胃癌的新辅助化疗安全、有效,可降低胃癌患者的分期,提高局部进展期胃癌患者的R0切除率,延长无病生存时间及总生存期[1-2]。但目前,尚无对进展期胃癌统一的新辅助化疗方案[3],并且患者对不同化疗方案的敏感性不同,术前对新辅助化疗的疗效预测非常重要,如能筛选出新辅助化疗应答不敏感患者,可以避免盲目用药,避免患者遭受不必要的新化疗带来的痛苦,并有助于提高治疗的效率。本研究对行新辅助化疗方案新辅助化疗的Ⅲ期胃癌病例进行回顾性分析,为进展期胃癌新辅助化疗提供个体化治疗的临床依据。
1 资料与方法
1.1 一般资料
选取沧州市中心医院(以下简称“我院”)肿瘤外科2009年8月~2012年8月收治的进展期胃癌行新辅助化疗方案(紫杉醇、顺铂加替加氟)的Ⅲ期胃癌患者104例,入组标准:①入组前经胃镜咬检病理学证实为胃癌患者;按美国癌症联合委员会(AJCC)胃癌TNM分期(2010年第7版)为标准,均属于ⅢA期或ⅢB期,无肝脏、肺、脑、骨等远处转移;②年龄18~75岁;③KPS评分≥60分;④患者未经抗肿瘤化疗,化疗前、术前检查均无手术、化疗禁忌证。排除标准:残胃癌、上腹部曾行开腹手术治疗的患者等。选取病例中,男 45例,女 59例;年龄 39~71岁,平均 54岁,ⅢA期61例,ⅢB期43例;高、中分化腺癌 35例,低、未分化腺癌53例,黏液腺癌、黏液细胞癌16例。
1.2 治疗方法
新辅助化疗的具体方法:紫杉醇135 mg/m2静脉滴注第 1天;顺铂 20 mg/m2静脉滴注第 1~5天;替加氟0.8~1.0 g静脉滴注第1~5天;每3周重复。新辅助化疗组术前行新辅助化疗4个周期,化疗2个周期后评价疗效,按照Recist 1.1标准[4]收集临床症状改善情况和超声内径(EUS)、CT等检查资料进行评估,如评估为有效或稳定,则继续应用此方案化疗至4个周期,末次化疗结束后3周左右行手术治疗,术后继续行原方案化疗3个疗程。如出现肿瘤进展,则终止新辅助化疗,立即进行手术治疗,术后给予患者更换ECF方案化疗4个疗程。
1.3 疗效评价
化疗前后以螺旋CT胃镜及术后病理切片相结合的方法作为疗效判断的证据。新辅助化疗后原发病灶的疗效判定根据,按照Recist 1.1标准分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)和进展(progress disease,PD)。有效:CR+PR;无效:SD+PD。病理完全缓解(pCR):手术标本中无癌细胞残留。病理部分缓解(pPR):有单个或小癌灶残留;疗效小:残留癌灶伴纤维增生;疗效差:疗效微小或无疗效,广泛残余癌细胞。
1.4 相关因子阳性结果判定
采用免疫组织化学(免疫组化)SP法,所用试剂购自北京中杉金桥生物有限公司。新辅助化疗前胃镜活检获取肿瘤组织,术后切除标本均予以检测,检测方法按试剂盒说明书进行。表皮生长因子受体(EGFR)、人类表皮生长因子受体 2(HER2)蛋白定位于细胞膜,呈棕褐色,细胞膜未着色或阳性细胞数小于10%为(-),大于或等于10%且细胞膜不完整染色为(+),两者均定为阴性。大于或等于10%且细胞膜完整轻至中度染色为(++),大于或等于 10%且细胞膜完整的强染色为(+++)。 EGFR 表达(++~+++)定为阳性。HER2表达(+++)为阳性,本研究为回顾性研究,未能对 HER2(++)的患者,进行荧光原位杂交技术(FISH)检测进一步对该类患者明确HER2情况,并定义该类患者为阴性。P53和Ki67阳性染色呈棕黄色颗粒.均定位于细胞核。P53和Ki67均以肿瘤细胞不着色或小于10%的肿瘤细胞着色为阴性。大于或等于10%的肿瘤细胞着色为阳性。
1.5 统计学方法
采用统计软件SPSS 17.0对数据进行分析,计数资料以率表示,采用χ2检验。采用Logistic多因素回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 新辅助化疗及疗效情况
104例患者全部完成新辅助化疗,无中途退组者。无 CR患者,其中 PR为 54.8%(57/104),SD为 42.3%(44/104),PD 为 2.8%(3/104),总有效率为 54.8%(57/104)。不良反应均能够通过药物治疗,使化疗能够顺利完成,所有患者均行手术治疗,其中86例患者获得R0切除(82.7%)。
2.2 各基因蛋白的表达与新辅助化疗疗效的关系
新辅助化疗前后,EGFR、HER2、Ki-67 和 P53 各因子在组织中的阳性表达差异无统计学意义(P>0.05),见表1。新辅助化疗前,HER2阳性表达者化疗有效率为85.7%(12/14),阴性表达者化疗有效率为 50.0%(45/90),阳性表达有效率显著高于阴性表达(P=0.01);P53阳性表达者化疗有效率为33.9%(19/56),显著低于阴性表达者的化疗有效率79.2%(38/48),差异有高度统计学意义(P<0.01);EGFR、Ki-67的组织表达与疗效之间不具有相关性(P>0.05)。见表2。经Logistic多因素回归分析显示,HER2和P53是化疗敏感性的独立影响因素。HER2阳性表达者化疗有效率是阴性表达者的 7.2 倍(95%CI:1.44~36.07);而 P53 阳性表达者化疗有效是阴性表达者的0.09倍 (95%CI:0.04~0.25),见表3。
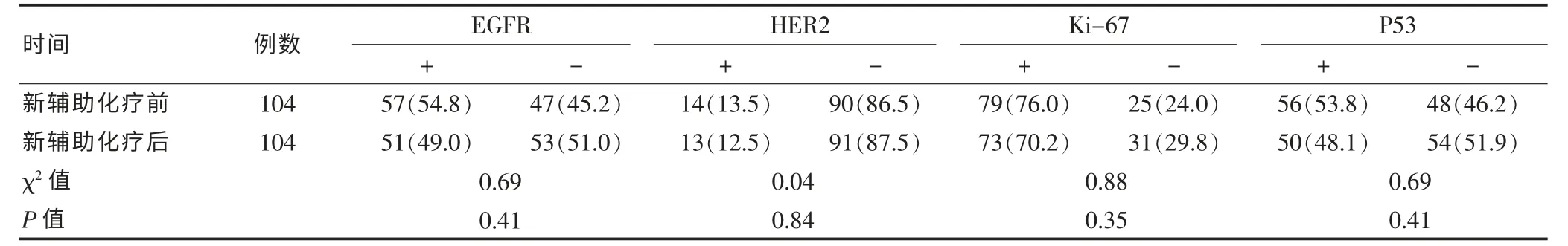
表1 104例胃癌患者新辅助化疗前后各基因蛋白表达的情况[n(%)]
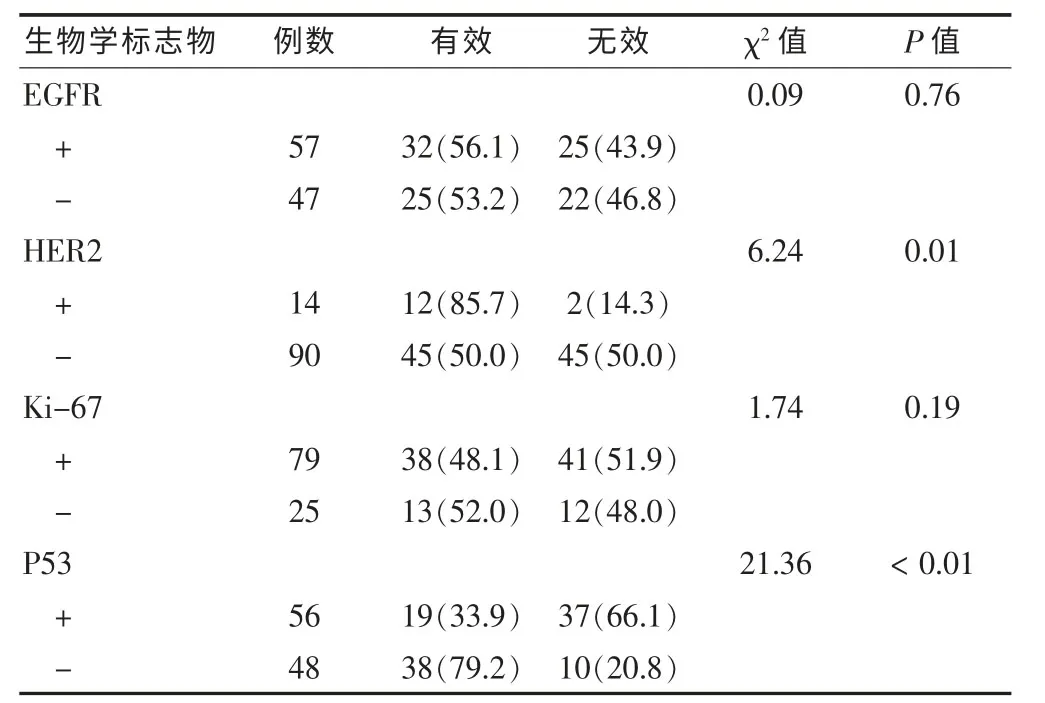
表2 各基因蛋白表达的情况与新辅助化疗疗效关系[n(%)]
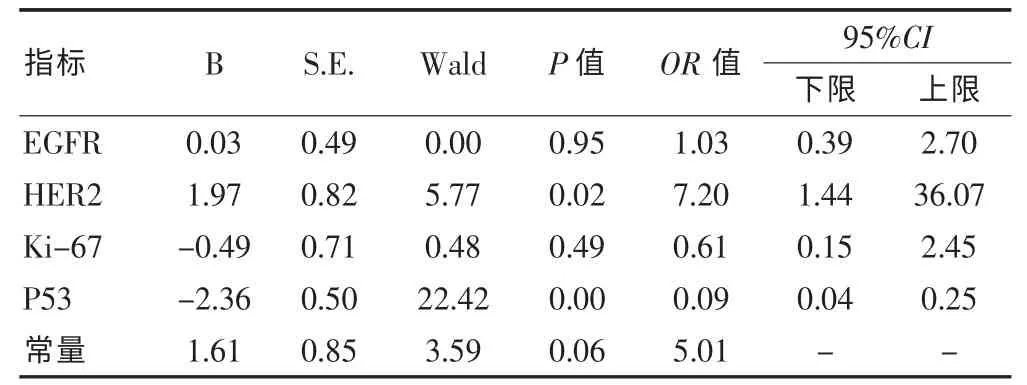
表3 各基因蛋白表达的情况与新辅助化疗疗效的Logistic回归分析
2.3 HER2、P53联合表达情况与新辅助化疗疗效的关系
将HER2与P53的组织表达情况进行亚组分析,各亚组新辅助化疗疗效见表4。其中,6例患者HER2阳性,同时P53阴性表达,5例新辅助化疗疗效为有效,有效率明显高于其他亚组患者,且差异有高度统计学意义(χ2=34.08,P < 0.01)。
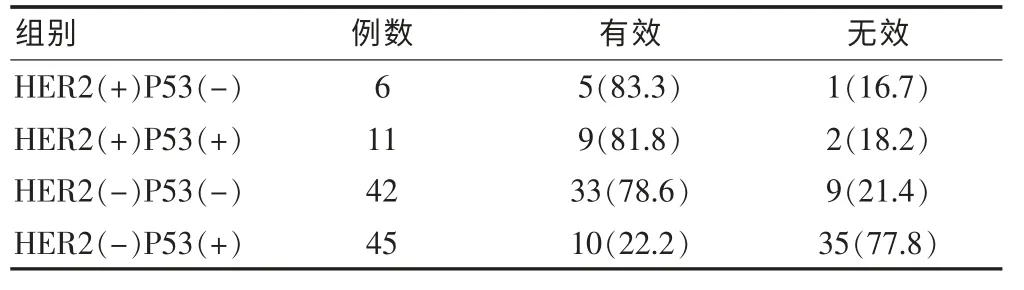
表4 HER2、P53联合表达状况与新辅助化疗疗效关系[n(%)]
3 讨论
现在我国胃癌的主要治疗手段是以手术为主的综合治疗,但在进展期胃癌的手术R0切除率较低。新辅助化疗在国内外众多研究证实可以降低肿瘤分期,提高患者的手术R0切除率,日益引起重视。2006年英国的MAGIC实验研究及法国的FFCD研究结果显示,进一步证实了术前新辅助化疗有助于提高患者的无病生存期及总生存期[5-6]。
但是有些患者对新辅助化疗无效,甚至病情进展,失去对局部病灶的控制,延误患者的手术的时机,因此如何预测胃癌化疗敏感性的问题日渐突出,如果能找到较为准确预测胃癌新辅助化疗敏感性的肿瘤标志物,临床医生就可以更好的判断对该类患者是否进行新辅助化疗,选择更有效的个体化治疗方案。Li等[7]报道 FOLFOX方案及刘林等[8]报道 DOX方案(多西他赛+奥沙利铂+替吉奥)新辅助化疗对进展期胃癌的临床有效率均为64%左右。本研究中,新辅助化疗的临床有效率为54.8%,低于前两者研究。
近年来,肿瘤分子标志物在新辅助化疗中的预测价值成为研究热点,但少见有关胃癌术前新辅助化疗的分子指标的国内报道。临床上常用的胃癌肿瘤标志物包括 EGFR、HER2、Ki-67及 P53等。研究证实,外周血中的癌胚抗原(CEA)、CA199的阳性表达率低,并且对新辅助化疗的预测价值不大。
Ki67是一种存在于细胞周期中除G0期以外所有阶段细胞核增殖标志物,它是细胞周期的G期开始表达的一种核抗原,在S期及G2期表达开始增加,在M期达到高峰,有丝分裂结束后迅速分解、消失,是近年来能有效评估肿瘤细胞增殖活性的重要指标之一[9],可反映肿瘤细胞活性,与恶性肿瘤的发展、转移和预后高度相关。很多研究证实Ki67可作为一种判断乳腺癌新辅助化疗疗效的分子生物学指标[10-11],但在本研究中显示,Ki67阳性患者新辅助化疗有效率与阴性患者相比差异无统计学意义,不能作为一种判断胃癌新辅助化疗疗效的分子生物学指标。
EGFR通过下游的信号传导途径参与肿瘤细胞的增殖、血管生成、侵袭、转移及凋亡抑制等基因控制,与胃癌的发生、发展及生物学行为密切相关[12],EGFR是反映胃癌细胞活性的可靠指标,本研究同样未能显示出EGFR阳性患者新辅助化疗有效率与阴性患者相比差异有统计学意义,不能作为一种判断胃癌新辅助化疗疗效的分子生物学指标。
HER2是表皮生长因子受体家族的一个成员,其胞质区具有酪氨酸蛋白激酶活性。HER2在正常情况下处于非激活状态,当受到体内外某些因素作用后,其结构或表达调控失常从而被激活,具有肿瘤转化活性,可从多个途径影响肿瘤细胞的生物活动,如细胞增殖、黏附、转移和分化等,导致肿瘤的复发和转移。HER2过表达在胃癌中的阳性率为16.0%~27.1%,在胃与食管连接部的胃癌中表达更高,HER2过表达,提示肿瘤细胞增生活跃。本研究中,本研究显示HER2阳性患者新辅助化疗有效率高于阴性患者,并且其差异具有统计学意义,HER2是新辅助化疗敏感性的独立因素。
P53是一种抑癌基因,可分为野生型和突变型两种亚型,为细胞凋亡过程重要的调控因子,其阳性多提示预后不良。P53基因为人类肿瘤细胞中最易出现突变的基,P53表达蛋自可通过阻滞细胞周期及启动凋亡参与细胞凋亡过程。本研究显示P53阴性患者新辅助化疗有效率高于阳性患者,并且其差异具有统计学意义,P53也是是新辅助化疗敏感性的独立因素。
本研究同时发现HER2和P53具有协同作用,HER2阳性同时P53阴性表达的胃癌患者新辅助化疗有效率更高,明显优于其他亚组患者(P<0.05)。但HER2阳性同时P53阴性共同表达的病例不多,尚需大样本进一步研究。HER2作为新辅助化疗敏感性的独立因素,可能与HER过表达的肿瘤细胞对抗化疗药物诱导的细胞凋亡作用通过中间某种机制而被抑制有关,但尚待进一步明确[13]。野生型P53具有抑制MDR基因转录作用,而突变型P53基因能加强多药耐药(MDR)基因表达,并通过抗细胞凋亡使肿瘤细胞产生耐药性。推测突变型P53可能通过抑制细胞凋亡和促进MDR基因的激活介入了化疗耐药的发生[14-16]。
综上所述,HER2和P53的表达情况对进展期胃癌的新辅助化疗疗效的预测有一定临床价值,提供了初步的临床证据,但由于本研究为回顾性研究,并且病例数有限,明确的临床预测价值需要进一步的大样本、随机和多中心的临床研究证据证实。
[1]Aoyama T,Yoshikawa T,Miyagi Y,et al.Human epidermal growth factor receptor 2(Her-2)and S-1 adjuvant chemotherapy in stage 2/3 gastric cancer patients who underwent D2 gastrectomy[J].Surg Today,2013,43(12):1390-1397.
[2]Fujitani K.Overview of adjuvant and neoadjuvant therapy for resectable gastric cancer in the East[J].Dig Surg,2013,30(2):119-129.
[3]沈琳,鲁智豪.胃癌药物治疗新视角[J].中华胃肠外科,2012,15(2):103-108.
[4]Eisenhauer EA,Therasse P,Bognerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1) [J].Eur J Cancer,2009,45(2):228-247.
[5]Chua YJ,Cunningham D.The UK NCRI MAGIC trial of perioperative chemotherapy in resectable gastric cancer:implications for clinical practice[J].Ann Surg Oncol,2007,14(10):2687-2690.
[6]Ychou M,Boige V,Pignon JP,et al.Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma:an FNCLCC and FFCD multicenter phase Ⅲ trial[J].J Clin Oncol,2011,29(13):1715-1721.
[7]Li ZY,Koh CE,Bu ZD.Neoadjuvant chemotherapy with FOLFOX:improved outcomes in Chinese patients with locally advanced gastric cancer[J].J Surg Oncol,2012,105(8):793,799.
[8]刘林,杨新辉,王海江,等.多西他赛联合奥沙利铂及替吉奥治疗进展期胃癌的疗效及对围手术期影响[J].中国肿瘤临床,2013,13:788-791.
[9]Penault-Llorca F,Andre F,Sagan C,et al.Ki67 expression and docetaxel efficacy in patients with estrogen receptor-positive breast cancer[J].J Clin Oncol,2009,27(17):2809-15.
[10]赵辉,逢凌云.Ki67检测在乳腺癌新辅助化疗疗效判断中的作用[J].中国医药,2012,7(2):184-185.
[11]张好云,陈天文,王开昕.Ki67表达在乳腺癌新辅助化疗中的临床意义[J].实用医院临床杂志,2012,9(4):60-62.
[12]Liakakos T,Xeropotamos N,Ziogas D,et al.EGFR as a prognostic marker for gastric cancer[J].World J Surg,2008,32(6):1225-1226.
[13]曲建军,石毅然,郝风云.进展期胃癌新辅助化疗疗效预测因子的临床研究[J].中华胃肠外科杂志,2013,16(3):276-280.
[14]刘赞伟,缪锦超,施珊格.奥沙利铂联合亚叶酸钙、5-氟尿嘧啶在胃癌新辅助化疗中的应用[J].现代医院,2013,13(2):46-47.
[15]李晓东,潘良喜,陈廷锋.奥沙利铂与顺铂联合卡培他滨同步放疗治疗局部晚期胃癌的疗效比较[J].成都医学院学报,2013,8(3):285-288.
[16]Zhang J,He XH,Xie XY,et al.The potential for serum p53 to predict the response to chemotherapy of patients with gastric cancer[J].J Int Med Res,2010,38(2):423-431.
