乳酸片球菌PA003抑菌作用及体外耐受性的研究
2014-05-10董婷周志江韩烨
董婷,周志江,韩烨
(天津大学化工学院,天津 300072)
乳酸菌是一类能利用碳水化合物产生乳酸的非病原性、革兰氏染色阳性菌的通称,包括乳杆菌、乳球菌和双歧杆菌等至少23个属。乳酸菌具有改善、调节人体肠道微生物菌群的平衡,增强机体免疫力,降低胆固醇水平,缓解乳糖不耐症等功能。一些乳酸菌是人和动物的胃肠道和雌性生殖道的共生菌,可以促进人和动物的健康[1]。此外,乳酸菌作为重要的益生菌已广泛地用于医药、食品和饲料等行业中,被公认为是安全的食品级微生物[2]。目前,已从人的粪便、酸马奶、发酵香肠、羊的瘤胃、牛粪、牛初乳、酸白菜、真空包装的发酵肉等分离到乳酸片球菌[3]。Gonzalez等[4]对来源于Pediococcus acidilactici PAC1.0片球菌素PA-1的研究发现,乳酸片球菌素能抑制多种革兰氏染色阳性菌,尤其是对单核细胞增多症李氏杆菌的抑制较为明显[5]。Bhunia等[6]对来源于Pediococcus acidilactici strain H的片球菌素AcH具有耐热性,对蛋白酶敏感及在较宽的pH范围有活性进行了研究。对乳酸片球菌素的研究主要包括:基因结构、抑菌机理、培养条件的优化、纯化及理化性质等[3]。Garmyn等[7-8]在转录水平上对乳酸片球菌的乳酸脱氢酶IdhD和IdhL进行了研究。1992年,Fitzsimons等[9]对18株乳酸片球菌进行了研究,并筛选到一株适合作为青贮接种菌的乳酸片球菌,此菌株表现较短的停滞期、产酸速度快、在较宽的pH和能温度范围生长等优点。然而,目前对乳酸片球菌益生方面的研究还比较少,仅在细角滨对虾[10]、断奶仔猪[11]、蛋鸡[12]、火鸡[13]、罗非鱼[14]等中有少量报道[3]。
乳酸片球菌 PA003是从东北发酵酸白菜中分离出的一株细菌素产生菌,对多数革兰氏染色阳性菌和少数不耐酸的革兰氏染色阴性菌有抑制作用[15]。其片球菌素产量为0.1760mg/mL,片球菌素的产量与很多因素有关,碳源和氮源是影响细菌素产生的主要因素,葡萄糖作为乳酸片球菌生长的主要碳源,其调节作用是乳酸片球菌素产量和活性的主要控制机制;而有机氮源的存在,可以满足菌体生长,同时也能中和代谢抑制物乳酸,促进片球菌素的产生,增强其抑菌活性。Mg2+可增加片球菌素的产量,K2HPO4是产乳酸片球菌素很好的磷源,将其浓度提高到5%时,既可维持发酵液的pH在合适的范围内,又可以刺激细菌素的产生。乳酸片球菌素的产量和抑菌活性在对数后期达到最大值,继续延长时间,产量有不同程度的下降,其抑菌活性也会降低[16]。本试验对其从抑菌、耐酸、耐胆盐、耐高温、耐抗生素等益生方面进行研究,以获得抗逆性强、益生性能优良,具有安全性的益生菌。
1 材料与方法
1.1 主要试剂和仪器
乳酸片球菌(Pediococcus acidilactici)PA003,从东北发酵酸菜中分离获得;单核细胞增多症李氏杆菌(Listeria mononucleosis)CVCC1595,购于中国兽医药品监察所;金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)DH5α、产气肠杆菌(Enterobacter aerogenes),天津大学化工学院食品系保存; MRS培养基,用于乳酸片球菌的增殖培养; TYESB培养基,单核细胞增多症李氏杆菌的增殖培养基;LB培养基,大肠杆菌的增殖培养基;NB培养基,金黄色葡萄球菌和产气肠杆菌的增殖培养基。
Oxoid抗微生物药敏实验纸片,购于OXOID公司。牛胆盐,购于奥博星生物公司;
台式恒温振荡器QE-1,购于天津市欧诺仪器仪表有限公司。
1.2 试验方法
1.2.1 菌种的活化 将30%甘油(-80℃)保存的乳酸片球菌、单核细胞增多症李氏杆菌、大肠杆菌、分别接种于MRS、TYSEB、LB液体培养基中,37℃下分别以120、200、120 r/min摇床培养14、7、10h[17]。将甘油保存的金黄色葡萄球菌、产气肠杆菌分别接种于NB液体培养基中,37℃下以120 r/min、摇床培养10h。接种环分别蘸取少量乳酸片球菌、单核细胞增多症李氏杆菌、大肠杆菌、金黄色葡萄球菌、产气肠杆菌培养液于MRS、TYSEB、LB、NB培养基斜面上划线培养,37℃下培养24h。
1.2.2 乳酸片球菌生长曲线的测定 取1.2.1中活化好的乳酸片球菌种子液,以2%的接种量接种于液体MRS液体培养基中,37℃下分别以120r/min摇床培养,每隔2h取样,稀释后,利用可见分光光度计测OD值,所用波长为600nm。
1.2.3 抑菌试验 将已灭菌的MRS培养基加热至完全融化,取4个无菌培养皿,将培养基倒在其中,每皿15mL,待其凝固。以无菌操作分别在每个培养基表面各放3个牛津杯(内径6mm、外径8mm、高 10mm),轻轻加压,使其与培养基接触无空隙。分别将单核细胞增多症李氏杆菌、金黄色葡萄球菌、大肠杆菌、产气肠杆菌的菌液按接种量5%接种于降至40℃左右的TYESB、NB、LB、NB半固体培养基中,混匀后分别倒在四个平板内,待半固体凝固后取出牛津杯,在牛津杯所形成的小孔内各加入200μL乳酸片球菌的发酵液。37℃过夜培养,观察小孔周围抑菌圈,并用游标卡尺测量其直径,从而分析乳酸片球菌对常见致病菌的抑菌效果[17]。
1.2.4 耐高温试验 在MRS液体培养基中接种2%已活化的乳酸片球菌,37℃过夜培养,菌液进行以下热处理:50℃、80℃、100℃ 各5、10、15min[18]。以未经热处理的菌液作为对照,对菌液进行梯度稀释,然后平板计数,并记录该菌在不同热处理下的存活率。做3个平行求平均值。
1.2.5 耐酸试验 将活化的乳酸片球菌以接种量10%分别接种于pH1.5、2.5、3.5、4.5的MRS液体培养基中,37℃摇床培养,在0、2、4、6h后取样,以未经酸处理的菌液作为对照,对菌液进行梯度稀释,然后平板计数,并记录该菌在不同酸度下的存活率。做3个平行求平均值。
1.2.6 耐胆盐试验 将活化的乳酸片球菌以接种量10%分别接种于胆盐含量0.1%、0.2%、0.3%、0.4%、0.5%的MRS液体培养基中,37℃摇床培养,在0、2、4、6h后取样,以未经胆盐处理的菌液作为对照,对菌液进行梯度稀释,然后平板计数,并记录该菌在不同浓度胆盐处理下的存活率。做3个平行求平均值。
1.2.6 药敏性试验 采用K-B法[19],将浸有抗生素的试纸片贴在涂布有乳酸片球菌的MRS平板上,在贴上药敏纸片的15min内翻转平板,37℃培养24h,观察并用游标卡尺测量抑菌圈直径,做3个平行求平均值。
1.3 数据处理
数据采用SPSS20.0软件进行误差计算和统计分析。
2 结果与分析
2.1 乳酸片球菌的生长曲线
将种子液接种于MRS液体培养基,37℃摇床培养,每隔2h取样,测菌体OD值,以OD值为纵坐标,以培养时间为横坐标,可以得到乳酸片球菌的生长曲线如图1:

由图1可知,在0-2h之间,乳酸片球菌PA003经过一个短暂的延滞期后,很快进入对数生长期,大约在14h时,菌体密度和乳酸片球菌素的产量及抑菌活性均达到最大值。随着营养物质的消耗,有害代谢产物的积累,细菌繁殖速度逐渐下降,细菌的增殖数与死亡数渐趋平衡,此时进入稳定期。稳定期后细菌繁殖越来越慢,死亡菌数增加,有的细菌甚至出现自溶现象,生理代谢活动也趋于停滞,此时细菌进入衰亡期。由于OD值表示的是培养液中的总菌数,包括活菌与死菌,因此所测定的生长曲线的衰亡期不明显。
2.2 抑菌试验
本试验分别检验了乳酸片球菌PA003对单核细胞增多症李氏杆菌、金黄色葡萄球菌、大肠杆菌、产气肠杆菌的抑菌效果,抑菌效果如图2、结果如表1所示,乳酸片球菌PA003对上述四种菌均有不同程度的抑制作用,其中对单核细胞增多症李氏杆菌和产气肠杆菌具有明显的抑制作用,抑菌圈直径大于17mm。乳酸片球菌对李氏杆菌和金黄色葡萄球菌的抑制作用主要是由于片球菌素对革兰氏染色阳性菌细胞壁的形成有抑制作用[15],而对大肠杆菌和产气肠杆菌等革兰氏染色阴性菌主要是由于乳酸片球菌产生的乳酸等有机酸及竞争性抑制作用。一方面,氢离子浓度能够引起微生物细胞膜电荷性质发生变化,进而影响微生物机体对某些营养物质的吸收;另一方面,氢离子浓度能够影响微生物代谢过程中某些酶的活性,还能影响微生物生长环境中营养物质的供给态,以及菌体蛋白质变性或菌体表面或核酸的水解[20]。

图2 乳酸片球菌的抑菌效果

表1 PA003对不同细菌的抑菌圈大小
2.3 耐高温试验
将乳酸片球菌进行不同时间、不同温度的热处理,观察该菌对不同温度的耐受性,其结果如表2和表3所示,由表2和表3可知,与对照(未经热处理的菌液)相比,乳酸片球菌经100℃加热5min处理后活菌数为(3.20±0.20)×103CFU/mL,存活率小于0.01%,10min后存活率为0。80℃5min、10min处理后其活菌数分别为(4.60±0.30)×103CFU/mL、(6.00±0.50)×10CFU/mL,存活率均小于0.01%,50℃5、10、15min 热处理后其活菌数分别为(1.20±0.20)×109CFU/mL、(1.00±0.40)×109CFU/mL、(1.00±0.40)×109CFU/mL,存活率为100%、83.3%、83.3%,可见该菌对50℃热处理有很好的耐受性。

表2 PA003在不同温度条件下的活菌数(CFU/mL)

表3 PA003在不同温度条件下的存活率(%)

15 100 83.3 -- --
2.4 耐酸试验
将乳酸片球菌进行不同时间、不同pH的酸处理,观察该菌对不同酸度的耐受性,结果见表4和表5。在pH 1.5时,2h后大部分菌死亡,说明该菌株对pH1.5耐受性差;在pH 2.5时,随时间延长,活菌数有所下降,但在6h时存活数仍较高,可达(4.00±0.30)×106CFU/mL;在pH3.5、4.5和6.5时,其活菌数随时间延长先减少后增加,说明pH 3.5、4.5和6.5对该菌株存活无抑制,开始的减少可能是由于该菌本身的迟滞期。可见pH 2.5、3.5、4.5对该菌株的存活无太大影响。

表4 PA003在不同pH条件下的活菌数(CFU/mL)
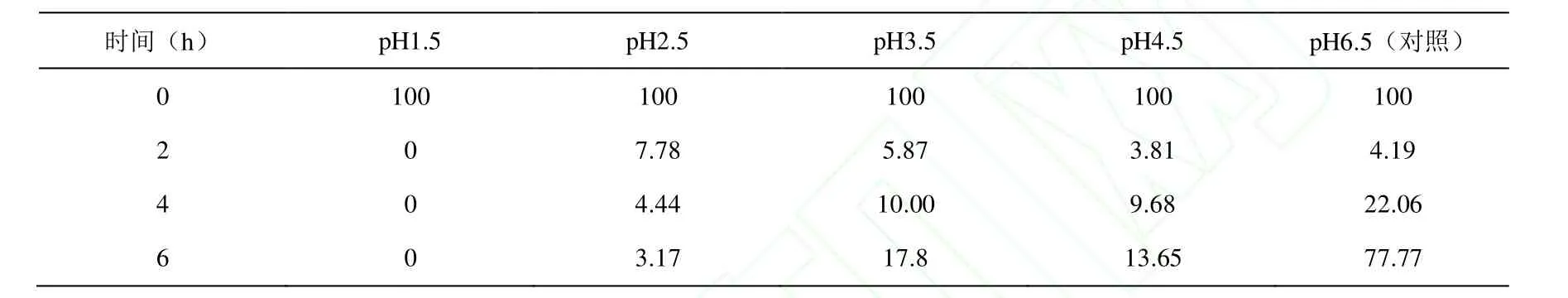
表5 PA003在不同pH条件下的存活率(%)
2.4 耐胆盐试验
将乳酸片球菌进行不同时间、不同胆盐浓度的培养,观察该菌对胆盐的耐受性,结果见表6和表7。由表可知,在胆盐浓度大于等于0.5%时,该菌在2h后存活率就低于0.01%。在胆盐浓度0.1%~0.2%时,该菌的存活率均大于0.01%。该菌在0.1%~0.4%胆盐的条件下生长6h,活菌数先减少后增加,这个一方面是由于胆盐对该菌的生长有一定的抑制作用,另一方面也是由于该菌迟滞期的存在。说明在0.1%~0.4%胆盐的条件乳酸片球菌对胆盐具有较好的耐受性。

表6 PA003在不同浓度胆盐中的活菌数(CFU/mL)

表7 PA003在不同浓度胆盐中的存活率(%)
2.5 药敏试验
将乳酸片球菌接种于MRS平板上,分别取浸有诺氟沙星、庆大霉素、四环素、青霉素和利福平5种抗生素的药敏纸片用无菌镊子贴在该平板上,37℃培养 24h,观察并测量抑菌圈的大小。下图3依次显示了乳酸片球菌对5种抗生素的抗性,抑菌圈直径如表8,分别为0、0、9.00、13.04、13.03mm,都处于革兰氏染色阳性菌标准菌株对5种抗生素表现为耐药性的抑菌圈直径范围。因此,乳酸片球菌对以上5种抗生素都具有耐药性。

图3 PA003对不同抗生素的耐药性
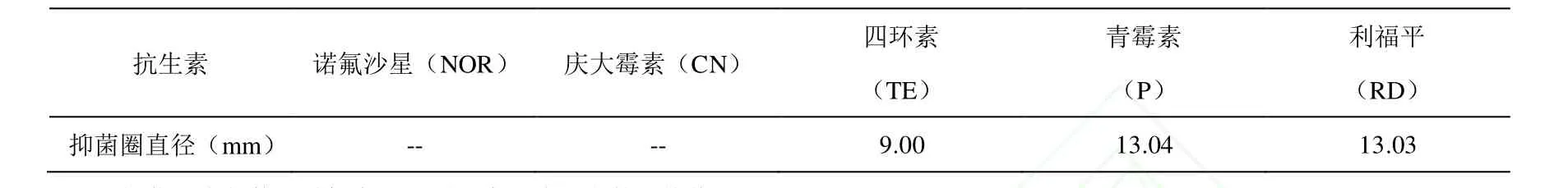
表8 PA003对不同抗生素的耐药性
3 讨论
目前具有一定生理功能(如降血脂、降血压、调节胃肠道功能和其他各种益生功能)的益生菌正受到越来越多的关注[21-23]。而对于益生菌而言,必须进入人体的胃肠道才能发挥其疗效和功能,因此就要求益生菌能够耐受机体的防御机制,其中也包括生产中可能产生的高温环境、口腔中的酶、胃液的低pH和小肠中的胆盐等[24]。
单核细胞增多症李氏杆菌、金黄色葡萄球菌、致病性大肠杆菌、产气肠杆菌是人体肠道内最常见的几种致病菌,乳酸片球菌对这几种菌均有明显抑制作用,抑菌圈直径都大于17mm。其产生的乳酸片球菌素和有机酸等,对这些致病菌起到了抑制作用。
益生菌株在菌液浓缩或制作颗粒料时,加热处理是比较常用的方法,因此我们对耐酸、耐胆盐能力较强的乳酸片球菌进行了热耐受性试验。结果显示,50℃热处理对该菌的存活几乎无影响。在以后的生产加工过程中,可能会使用喷雾干燥技术对该菌进行浓缩。而喷雾干燥的高温可能破坏菌体结构,从而影响其活性。正常人的胃液在pH1.5~4.5之间,其pH值的大小因食物结构不同而波动,通常在pH3.0左右,且食物(尤其是流体)通过胃的时间相对较短,一般1~2h[25]。在pH1.5时,该菌的存活率为0;在pH2.5~4.5时乳酸片球菌均表现出耐受性。这种对酸的耐受反应包括对新的pH的动态平衡和新的系列蛋白质,如抗性蛋白质的合成的感应。抗性蛋白质有助于提高菌体细胞对酸的耐受性的反应,进行全部或部分地保护细胞,以抵抗其他的压力反应[26]。由此可见,乳酸片球菌具有较强的耐酸能力,能够保证一定数量的活菌体顺利通过胃酸环境到达肠道内。益生菌对于胆盐的抗性是其能够在肠道存活、生长并发挥功效的先决条件之一。胆盐对菌株的抑制作用取决于胆盐浓度和菌株本身的特性,人体小肠中胆盐质量分数在0.03%~0.3%之间波动,能够在正常生理胆盐浓度中生长和代谢的菌株才可能在肠道消化过程中存活[27]。本研究中当胆盐浓度0.1%~0.4%时,该菌均表现出一定的耐受力,且在6h时有增长的趋势。由此可见,乳酸片球菌具有一定的抗胆盐能力。
诺氟沙星、庆大霉素、四环素、青霉素、利福平是目前临床上常用的几种抗生素。药敏试验证明乳酸片球菌对以上5种抗生素具有耐药性。表明应用上述抗生素进行治疗不会杀死小肠中的乳酸片球菌,推测这可能与该菌的细胞壁结构有关,有待于进一步研究。
综合本试验结果,PA003对单核细胞增多症李氏杆菌等有明显的抑制作用;50℃下可存活,80℃及以上耐热能力显著降低;在pH2.5、6h后活菌数从108CFU/mL降低到106CFU/mL,在pH3.5和4.5条件下,4h后表现出增长的趋势;对胆盐浓度0.1%-0.4%表现为较好的耐受性,高于0.4%生长较差;对诺氟沙星、庆大霉素、四环素、青霉素、利福平有耐药性。我们初步认为乳酸片球菌PA003是一株对肠道致病菌有抑制作用,耐酸、耐胆盐、耐热能力较强,对常用抗生素有一定耐药性的优良菌株,有作为人或动物益生菌的潜在应用前景。
[1]任大勇, 李昌, 秦艳青, 等. 乳酸菌益生功能及作用机制研究进展[J]. 中国兽药杂志, 2011, 45(2): 47-50.
[2]W assenaar T M, Klein G. Safety Aspects and Implications of Regulation of Probiotic Bacteria in Food Supplements[J]. J Food Prot,2008, 71(8): 1734-1741.
[3]王建设, 赵海燕, 王凡, 等. 乳酸片球菌的分离鉴定与益生功能的初步研究[J]. 中国农学通报, 2012, 28(24): 201-206.
[4]Gonzalez C F, Kunka B S. Plasmid-Associated bacterocin production and sucrose fermentation in Pediococcus acidilactici[J]. Appl Environ Microbiol, 1987, 53(10): 2534-2538.
[5]Pucci M J, Vedamuthu E R, Kunka B S, et al. Inhibition of Listera monocytogenes by using bacteriocin PA-1 produced by Pediococcus acidilactici PAC 1.0[J]. Appl Bacteriol, 1988, 65(4): 261-268.
[6]Bhunia A K, Johnson M C, Ray B. Purification, characterization and antimicrobial spectrum of a bacteriocin produced by Pediococcus acidilactici[J]. J Appl Bacteriol, 1988, 65(4): 261-268.
[7]Garmyn D, Ferain T, Bernard N, et al. Pediococcus acidilactici ID gene: cloning, nucleotide sequence, and transcriptional analysis[J].J Bacteriol, 1995, 177(12): 3427-3437.
[8]Garmyn D, Ferain T, Bernard N, et al. Cloning, nucleotide sequence, and transcriptional analysis of the Pediococcus acidilactici L-(+ )-lactate dehydrogenase gene[J]. Appl Environ Microbiol, 1995, 61(1): 266-272.
[9]Fitzsimons A, Duffner F, Curtin D, et al. Assessment of Pediococcus acidilactici as a Potential Silage Inoculant[J]. Appl Environ Microbiol, 1992, 58(9): 3047-3052.
[10]Castex M, Chim L, Pham D, et al. Probiotic P. acidilactici application in shrimp Litopenaeus stylirostris culture subject to vibriosis in New Caledonia[J]. Aquaculture,2008, 275(1-4): 182-193.
[11]Giancamillo A D, Vitari F, Savoini G, et al. Effects of orally administered probiotic Pediococcus acidilactici on the small and large intestine of weaning piglets. A qualitative and quantitative micro-anatomical study[J]. Histol Histopathol,2008,23(6): 651-664.
[12]Quarantelli A, Righi F, Agazzi A, et al. Effects of the administration of Pediococcus Acidilactici to laying hens on productive performance[J]. Vet Res Commun, 2008,3 2(1): 359-361.
[13]Wajda S, Smiecinska K, Jankowski J, et al. The efficacy of lactic acid bacteria Pediococcus acidilactici, lactose and formic acid as dietary supplements for turkeys[J]. Pol J Vet Sci, 2010, 13(1): 45-51.
[14]Ferguson R M, Merrifield D L, Harper G M, et al. The effect of Pediococcus acidilactici on the gut microbiota and immune status of on-growing red tilapia (Oreochromis niloticus)[J]. J Appl Microbiol, 2010,109(3):851-862.
[15]周志江, 韩烨, 韩雪. 从酸白菜中分离出一株产细菌素的乳酸片球菌[J]. 食品科学, 2006, 27(4): 89-91.
[16]丁成为, 周志江, 韩烨等. 产片球菌素的乳酸片球菌培养条件的优化[J]. 食品工业科技, 2007, 10: 66-69.
[17]丁成为. 乳酸片球菌抑菌谱及应用性研究[D]. 天津: 天津大学, 2007.
[18]吴惠芬, 毛胜勇, 姚文, 等. 2株猪源乳酸菌对低 pH 值和胆盐耐受性及热稳定性研究[J]. 华中农业大学学报, 2005, 6(24):265-268.
[19]凌代文, 东秀珠. 乳酸细菌分离鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999.
[20]白艳红. 低温熏煮香肠腐败机理及生物抑菌研究[D]. 杨凌: 西北农林科技大学, 2005.
[21]Mann GB, A Spoerry. Studies of a surfactant and cholesteremia in the Maasai[J]. Am J Clin Nutr, 1974, 27: 464-469.
[22]SE Gilliland, CRNelson, C Maxwell. Assimilation of Cholesterol by Lactobacillus acidophilus[J]. Appl Environ Microbiol, 1985,49:377-381.
[23]韩俊华, 盛晓甘. 乳酸菌降胆固醇作用研究现状[J]. 中国乳品工业, 2002, 30(3): 16-20.
[24]张德珍, 潘道东, 戴传超. 一株降胆固醇乳酸菌的鉴定及其在模拟胃肠环境中抗性的研究[J]. 食品科学, 2004, 25(11):281-284.
[25]赵瑞香, 李元瑞, 等. 嗜酸乳杆菌在模拟胃肠环境中抗性的研究[J]. 微生物学通报, 2002, 29(2): 35-38.
[26]成妮妮, 吕嘉枥. 益生菌的生理功能及提高其存活力的方法[J]. 食品工业科技, 2004, 25(2): 35-38.
[27]杨颖, 田丰伟, 陈卫, 等. 两株乳杆菌益生特性的体外研究[J]. 中国乳品工业, 2006, 34(6): 16-19.
