抚顺西露天油页岩可培养微生物的分离与鉴定
2014-05-09蒋绍妍王文星薛向欣
蒋绍妍,王文星,薛向欣*
(1.东北大学冶金资源与生态环境研究所,辽宁 沈阳110819;2.辽宁省冶金资源循环科学重点实验室,辽宁 沈阳110819;3.东北大学生命科学与健康学院,辽宁 沈阳110819)
抚顺西露天油页岩可培养微生物的分离与鉴定
蒋绍妍1,2,王文星3,薛向欣1,2*
(1.东北大学冶金资源与生态环境研究所,辽宁 沈阳110819;2.辽宁省冶金资源循环科学重点实验室,辽宁 沈阳110819;3.东北大学生命科学与健康学院,辽宁 沈阳110819)
为了解油页岩中可培养微生物的多样性,利用稀释平板培养法对我国抚顺盆地西露天组油页岩中可培养微生物进行分离纯化,并对所获菌株进行16S rDNA(细菌)和rDNA ITS(真菌)序列测定和系统发育树分析.以营养琼脂培养基分离到8株细菌,以马铃薯葡萄糖琼脂培养基分离到4株真菌.16S rDNA 序列测定结果表明细菌菌株属于芽孢杆菌属(Bacillus),赖氨酸芽孢杆菌属(Lysinibacillus),短杆菌属(Brevibacillus),类芽胞杆菌属(Paenibacillus)和红球菌属(Rhodococcus); rDNA ITS序列测定结果显示真菌菌株分别属于芽枝霉属(Cladosporium),曲霉属(Aspergillus),犁头霉属(Absidia)和正青霉属(Eupenicillium).2株细菌(ZK4和ZK5)能够在以油页岩为唯一碳源和氮源的固体培养基上连续生长5代以上,且长势良好, 可作为油页岩生物转化的潜力菌株进行深入研究.
油页岩;微生物多样性;16S rDNA;rDNA ITS;系统发育分析
油页岩是一种富含有机质、具有微细层理、可以燃烧的细粒沉积岩[1].我国已探明油页岩所含的页岩油地质储量达289.9亿t (按平均含油率6%计算),已超过到目前为止累计探明的天然气和石油储量的总和,被称为21世纪的接替能源[2].微生物是重要的生物资源和基因资源[3].微生物转化技术在油页岩领域的研究尚属起步阶段,相关报道不多,主要是利用生物催化作用浸提油页岩中的矿物组分[4-6],或利用生物表面活性剂驱提页岩油[7],为了加快这一技术的应用步伐,对油页岩中可培养本源微生物的全面分离与鉴定是一个基础性的前提,因为一般用于转化矿物的微生物都是先从矿物表面或周围环境中分离出来,再进行驯化、培育和遗传学方面的改造,提高其环境耐受力和转化率.Matlakowska等[8]曾利用黑页岩作为唯一碳能源,成功培养了8株从波兰Lubin铜矿中分离得到的细菌,并利用16S rDNA同源性对比,鉴定其中4株属于假单胞菌属(Pseudomonas)、1株属于不动菌属(Acinetobacter)、1株属于芽孢杆菌属(Bacillus)、2株属于微杆菌属(Microbacterium),并且认为这些本源微生物具有降解黑页岩中芳香烃以及长链脂肪烃的能力[9].此外,有报道称 Dechloromonas、Comamonas和Clostridium同样能够以黑页岩中干酪根作为唯一的碳能源,并且它们在新陈代谢过程中表现出了多种不同的呼吸和发酵模式:好氧和厌氧类型异养微生物,如硫酸盐还原菌和发酵细菌;化能类型自养微生物,如氧化硫或氧化铁细菌;以及产甲烷类型的古细菌等[10-12].虽然黑页岩与油页岩有机质均主要由复杂三维网状结构的干酪根构成,但二者在有机物组成结构、生烃和排烃等方面仍有一定差别[13],至今对油页岩本源微生物的全面调查研究尚缺乏报道.利用纯培养方法可以直接获得菌体细胞及菌落形态、营养及培养条件等指标,分离的单克隆菌株也可直接用来进行诱变等基因改造,在微生物功能特性的认识方面有独特的优势,因此本研究选择稀释平板培养法对抚顺盆地西露天组油页岩本源微生物进行分离纯化及分子鉴定,为后续从中分离功能菌株、改造功能基因提供清晰的生态背景信息.
1 材料与方法
1.1 材料

表1 含水量, 酸碱度, 总DNA含量和菌落总数(均值±标准差, n =3)Table1 Moisture content, pH, total DNA content and colony lump-sum(values were means ± S.D., n =3)
油页岩于2011年6月采自抚顺西露天矿(123°57′E,41°50′N,海拔75.9m).含矿区为温带大陆性季风气候,年平均气温5~7℃,年降水量750~850mm.抚顺盆地为半咸水浅湖拗陷沉积形成,有机质来源以水生生物为主、陆源供给少,基底为下白垩统砂砾岩,油页岩赋存于古城子组、计军屯组和西露天组.样品采自西露天组,采样深度约30m.西露天组由较厚的绿色泥岩夹泥灰岩层组成,互层频繁,颜色为杂色及绿色.取样时铲去表面页岩以防空气及页岩表面微生物混入样品,并且佩戴无菌手套,采样用铁锤、小铲子、筛子、报纸及离心管等工具均经高压蒸汽灭菌后烘干.按五点法采集褐色油页岩细粒,避开聚集在局部的黑色页岩,锤子就地粉碎并充分混匀后过4mm无菌筛,四分法取适量放于50mL无菌离心管,与冰袋一起装入保温盒带回实验室4℃保存.3个重复取样地间隔约500m.样品经测定灰分80.95%,挥发份16.57%,烧失量19.05%,水不溶物97.46%,含油率11.47%;X射线衍射分析主要为高岭石、菱铁矿和石英;X射线荧光定量元素分析 SiO2为43.90%,CO2为28.41%,Al2O3为17.08%,Fe2O3为5.36%,K2O为1.26%.样品含水量、酸碱度、总DNA含量和活菌数量列于表1.
1.2 细菌的纯培养与分子鉴定
样品于无菌PBS(pH7.3)中180r/min振荡后涂布于营养琼脂培养基,37℃培养48h,每稀释度(10-1~10-4)各3次重复且每次5个平行.挑取形态有差异的各菌落纯化5代以上,直至平板内菌体经镜检完全一致.采用北京百泰克(BioTeke)的细菌基因组DNA提取试剂盒(离心柱型)提取菌落DNA,并以27f:5′-AGAGTTTGATCCTGGCTC AG-3′和1492r:5′-GGTTACCTTGTTACGACT T-3′扩增1500bp左右的16S rDNA[14].PCR体系50μL:Mix(BioTeke)25μL,上下游引物(10μmol/L)各2μL,DNA40~50ng,灭菌高纯水补足:PCR程序:94℃5min,并以94℃1min,55℃1min,72℃1min循环30次,72℃10min.培养基均购自杭州天和微生物试剂有限公司.引物合成和PCR产物测序均由上海生工生物工程有限公司完成.目的序列与数据库 Genbank和 EzTaxon比对,用Clustal X 和 MEGA4软件以邻位连接(Neighbour-Joining)算法和 Kimura2-parameter模型构建系统发育树.
1.3 真菌的纯培养与分子鉴定
样品加入PBS(pH5.9)后100r/min振荡;马铃薯葡萄糖琼脂培养基(PDA)28℃培养96h;采用上海生工生物工程有限公司的Ezup柱式真菌基因组 DNA抽提试剂盒提取菌落 DNA,并以ITS1:5′-TCCGTAGGTGAACCTGCGG-3′ 和ITS4:5′-TCCTCCGCTTATTGATATGC-3′扩增550bp左右的rDNA ITS区.PCR程序:94℃5min,并以94℃30s,55℃30s,72℃45s循环35次,72℃10min,4℃保存.其他同1.2节.
1.4 分离菌株在油页岩固体培养基上的生长
为了考察分离菌株在以油页岩作为唯一碳氮源营养条件下的生长情况,将其培养于以油页岩为底物、仅辅以少量无机盐的油页岩固体培养基中,该培养基成分:25g/L油页岩(粒径0.075~0.5mm),0.1g/L MgSO4·7H2O,0.01g/L MnSO4·4H2O,0.01g/L FeSO4·7H2O,琼脂粉16g/L,pH7.3(细菌)或5.9(真菌).分离菌株划线接种至上述油页岩培养基继代培养5代.
2 结果与分析
2.1 细菌的纯培养与分子鉴定
虽然分子生物学方法使微生物多样性研究得到了极大的拓展,但是要了解微生物在生物圈行使的生态功能,对它们进行分离纯化仍是一个必要手段.由平板分离法共获得8株细菌单克隆,编号为菌株ZK2、ZK3、ZK4、ZK5、ZK8、ZK10、ZK12和ZK14(图1),ZK4菌落较大,培养初期为淡粉色、后颜色逐渐加深转为黄色;其他菌落直径约1~3mm,ZK3、ZK5和ZK10为乳白色,其余为黄色或淡黄色,且ZK12和ZK14菌落中央颜色较深;ZK5、ZK10和ZK14菌落较干燥、粗糙、无光泽;ZK10与ZK2表面有凹突;ZK3菌落较透明.图2(a)显示各菌基因组长度约23kb;图2(b)显示各菌 PCR条带明亮单一,与目的基因长度吻合.

图1 细菌分离菌株的菌落形态和革兰氏染色Fig.1 Colonial morphologies and Gram staining of bacterial isolates
图2 琼脂糖凝胶电泳Fig.2 Agarose gel electrophoreses
分离菌株与数据库中近似菌株的序列相似度均在99%以上,通常认为97%以上即为同属同种微生物:ZK2为Lysinibacillus sp.,ZK3为Brevibacillus sp.,ZK5、ZK8、ZK10和ZK14为Bacillus spp.,ZK12为Paenibacillus sp.,ZK4为Rhodococcus sp.;将菌株ZK2、ZK3、ZK4、ZK5、ZK8、ZK10、ZK12和ZK14的16S rDNA序列提交至Genbank(NCBI),它们的登录号为KJ191429~KJ191436,各菌株与模式菌株的遗传进化关系如图3.
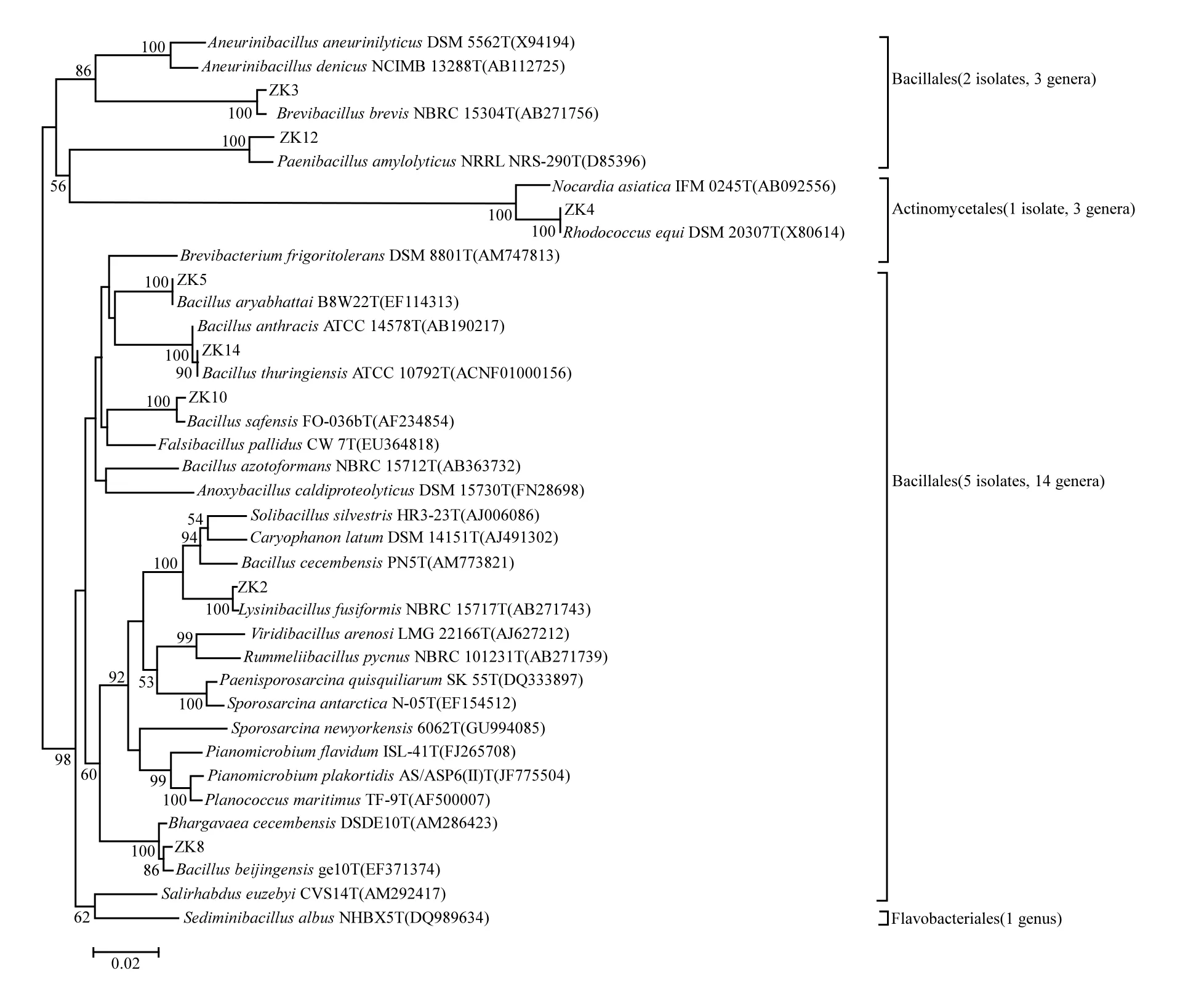
图3 根据16S rDNA构建的系统发育树Fig.3 The phylogenetic tree based on16S rDNA
同一分支代表亲缘关系较近,不同分支则同源性相对较低.分离菌株中除ZK4为放线菌门外,其余均属于厚壁菌门芽孢杆菌目细菌.芽孢类细菌对油页岩的生物转化机理尚不清楚,但在许多油藏环境中被发现其存在[15].油页岩与石油和煤等在结构组成上具有一定的同源性,即它们的形成有着相同的原始动植物有机物质,油页岩低温干馏时有机质热分解转化为页岩油,包括液态碳和氢,以及少量含氧、氮和硫的化合物,它与天然石油的不同之处在于其不饱和烃及非烃化合物含量较高,而油页岩与煤的主要区别在于油页岩的灰分在40%以上.有研究指出芽孢杆菌属可以通过自身代谢产生生物表面活性剂,帮助细胞粘附于烃类物质表面进行解烃代谢,生物表面活性剂还能够降低表面张力促进微生物吸收和代谢疏水烃性物质[16-18],以利于微生物在水不溶性物质中生存,并且这种生物表面活性剂在极端条件下仍能够保持活性[19].也有研究在硅酸盐矿石环境中筛选出较多有特定功能的芽孢杆菌属细菌,例如 Bacillus eχlorgllen,Bacillus circulans和Bacillus mucilaginous等[20],它们在生长过程中产生许多代谢产物能够使矿石中的硅酸盐矿物微粒分散到浸出液中,同时能释放出硅酸盐组成成分中的磷、钾和硅等元素,达到降解硅酸盐的目的.而短芽孢杆菌属和类芽孢杆菌属在海湾表层沉积物中曾被发现.放线菌是抗生素等生物活性物质的生产者,在深海和石油环境也广泛存在[21],被认为在有机质分解和矿化过程中起着重要作用.Rhodococcus以及Nocardioides, Arthrobacter, Nocardia, Micrococcus等放线菌类[22-25]均具有降解芳香烃等石油烃的能力.
2.2 真菌的纯培养与分子鉴定
本研究共获得4株真菌单克隆,编号为菌株K1,K2,K3和K4(图4),它们均有毛绒状菌丝;K1菌落为灰绿色,形状不规则,其他菌落近似圆形,白色,且K4菌落中央呈淡黄色;K3及K4菌落中央较湿润,其他均较干燥,粗糙,无光泽;K4有十字花裂纹.各菌靶序列PCR产物如图5,可以看出片段长度位于 DL2000DNA Marker的750bp与500bp之间,与目的基因长度吻合.

图4 真菌分离菌株的菌落形态Fig.4 Colonial morphologies of fungal isolates
分离菌株与数据库中近似菌株的序列相似度均在99%以上:K1~K4依次为 Cladosporium sp.,Aspergillus sp.,Absidia sp.和Eupenicillium sp.;将菌株 K1~K4的 rDNA ITS序列提交至Genbank(NCBI),它们的登录号为 KJ191437 ~KJ191440,各分离菌株与模式菌株所构建的系统发育树如图6.除了 K3为接合菌门外,其他菌株均属于子囊菌门.接合菌的主要特征是产生厚壁休眠体(接合孢子),该门有许多菌属可以转化甾族化合物.子囊菌门共1950属15000余种,大部分营养体菌丝中有隔膜.接合菌和子囊菌的许多菌属具有降解纤维素的能力.2.3 分离菌株在油页岩固体培养基上的生长
图5 PCR扩增rDNA ITSFig.5 PCR amplied products of rDNA ITS
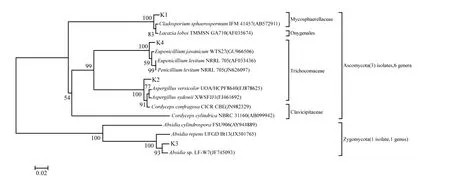
图6 根据rDNA ITS构建的系统发育树Fig.6 The phylogenetic tree based on rDNA ITS
将上述分离菌株接种在仅以油页岩作为唯一碳氮源的简单无机盐培养基上继代培养,筛选出可良好利用油页岩成分的菌株.将分离的真菌菌株培养于油页岩固体培养基上,首代即没有菌株成活;而细菌的油页岩固体培养基实验表明,ZK4-J和ZK5-J长势较旺(继代培养5代后的菌株编号为原菌株后加"-J",下同),如图7,每代均有清晰而密集的菌落生长,但与利用营养琼脂培养相比,菌落明显较小而稀疏;ZK10-J和ZK12-J长势居中,每代均有肉眼可见的稀疏菌落;ZK3-J和 ZK14-J长势较差,每代仅有沿划线位置两侧生长的菌落;而ZK2-J和ZK8-J于继代培养过程中逐渐衰亡,不能在该培养基上连续生长.

图7 继代培养的菌落形态Fig.7 Colonial morphologies of the isolates with continuous transfers cultured
3 结论
3.1 利用营养琼脂培养基从抚顺西露天组油页岩中共分离出8株可培养细菌,属于 Lysinibacillus, Brevibacillus, Paenibacillus, Rhodococcus和Bacillus;利用马铃薯葡萄糖琼脂培养基从该样品中共分离出4株真菌,属于Cladosporium, Aspergillus,Absidia和Eupenicillium.
3.2 分离菌株中的6株细菌能够在以油页岩为唯一碳氮源的固体培养基上生长5代以上,其中ZK4(Rhodococcus sp.)和ZK5(Bacillus sp.)长势明显好于其他各菌,具有基因改造的潜力,而ZK2(Lysinibacillus sp.)和 ZK8(Bacillus sp.)以及所有分离的真菌菌株均不能够在该培养基上连续生长.
[1] 王飞宇.中国湖相生油岩和油页岩无定形有机质中的超细纹层[J]. 科学通报,1994,39(17):1587-1587.
[2] James W B, Peter M C, Harry R J. Is oil shale America's answer to peak-oil challenge? [J]. Oil Gas J.,2004,8:16-24.
[3] 郑艳玲,侯立军,陆 敏,等.崇明东滩夏冬季表层沉积物细菌多样性研究 [J]. 中国环境科学,2012,32(2):300-310.
[4] Djordjeviĉa V, Vrviĉ M M, Cvetkoviĉ O. Bacterial depyritization of oil shale by thiobacillus ferrooxidans: the effect of initial pH value [J]. Org. Geochem.,1997,62(4):343-348.
[5] Beškoski V P, Miliĉ J, Mandiĉ B, et al. Removal of organically bound sulfur from oil shale by iron (III)-ion generatedregenerated from pyrite by the action of Acidithiobacillus ferrooxidans-Research on a model system [J]. Hydrometallurgy,2008,94(1/2/3/4):8-13.
[6] Cvetkoviĉ O, Curiale J A, Djordjeviĉa V, et al. Evidence of stability of sedimentary organic matter during bacterial desilicification of an oil shale [J]. Org. Geochem.,2001,66(2):95-99.
[7] Haddadin M S Y, Arqoub A A A, Reesh I A, et al. Kinetics of hydrocarbon extraction from oil shale using biosurfactant producing bacteria [J]. Energ. Convers. Manage.,2009,50(4):983-990.
[8] Matlakowska R, Sklodowska A. The culturable bacteria isolated from organic-rich black shale potentially useful in biometallurgical procedures [J]. J. Appl. Microbiol.,2009,107(3):858-866.
[9] Matlakowska R, Narkiewicz W, Sklodowska A. Biotransformation of organic-rich copper-bearing black shale by indigenous microorganisms isolated from Lubin copper mine (Poland) [J]. Environ. Sci. Technol.,2010,44:2433-2440.
[10] Petsch S T, Edwards K J, Eglinton T I. Microbial transformations of organic matter in black shales and implications for global biogeochemical cycles [J]. Palaeogeogr. Palaeocl.,2005,219(1/2):157-170.
[11] Martini A M, Budai J M, Walter L M, et al. Microbial generation of economic accumulations of methane within a shallow organic-rich shale [J]. Nature,1996,383:155-158.
[12] Martini A M, Walter L M, Budai J M, et al. Genetic and temporalrelations between formation waters and biogenic methane: upper Devonian antrim shale, Michigan Basin, USA [J]. Geochimica et Cosmochimica Acta,1998,62(10):1699-1720.
[13] 曾庆辉,钱 玲,刘德汉,等.富有机质的黑色页岩和油页岩的有机岩石学特征与生、排烃意义 [J]. 沉积学报,2006,24(1):113-122.
[14] Piterina A V, Bartlett J, Pembroke J T. Molecular analysis of bacterial community DNA in sludge undergoing autothermal thermophilic aerobic digestion (ATAD): pitfalls and improved methodology to enhance diversity recovery [J]. Diversity,2010,2(4):505-526.
[15] 佘跃惠,夏晶晶,黄金凤,等.大庆油田聚驱后油藏驱油本源菌研究 [J]. 油田化学,2009,26(1):98-101.
[16] Barathi S, Vasudevan N. Utilization of petroleum hydrocarbons by Pseudomonas fluorescens isolated from a petroleumcontaminated soil [J]. Environ. Int.,2001,26(5/6):413-416.
[17] Maletić S, Dalmacija B, Rončević S,et al. Degradation kinetics of an aged hydrocarbon-contaminated soil [J]. Water Air Soil Poll.,2009,202(1/2/3/4):149-159.
[18] Sklodowska A, Matlakowska R. Influence of exopolymers produced by bacterial cells on hydrophobicity of substrate surface [J]. Biotechnol. Tech.,1997,11(11):837-841.
[19] Batista S B, Mounteer A H, Amorim F R, et al. Isolation and characterization of biosurfactant/bioemulsifier-producing bacteria from petroleum contaminated sites [J]. Bioresource Technol.,2006,97(6):868-875.
[20] 张兰英,张学庆,任何军,等.微生物浸矿驱提页岩油的技术进展[J]. 吉林大学学报,2011,41(5):1562-1572.
[21] Bull A T, Stach J E M, Ward A C, et al. Marine actinobacteria: perspectives, challenges, future directions [J]. Anton. Leeuw. Int. J. G.,2005,87:259-276.
[22] Sorkhoh N A, Ghannoum M A, Ibrahim A S, et al. Crude oil and hydrocarbon degrading strains of Rhodococcus rhodochrous isolated from soil and marine environments in Kuwait [J]. Envieon. Pollut.,1990,65(1):1-17.
[23] Milekhina E I, Borzenkov I A, Zvyagintseva I S. Characterization of a hydrocarbon-oxidizing Rhodococcus erythropolis strain isolated from an oil field [J]. Microbiology,1998,67(3):271-274.
[24] Yu B, Xu P, Shi Q, et al. Deep desulfurization of diesel oil and crude oils by a newly isolated Rhodococcus erythropolis strain [J]. Appl. Environ. Microb.,2006,72(1):54-58.
[25] Ohhata N, Yoshida N, Egami H, et al. An extremely oligotrophic bacterium, Rhodococcus erythropolis N9T-4, isolated from crude oil [J]. J. Bacteriol.,2007,189(19):6824-6831.
Isolation and identification of cultivable microorganisms in oil shale from Fushun western open group, China.
JIANG Shao-yan1,2, WANG Wen-xing3, XUE Xiang-xin1,2*
(1.Institute of Metallurgical Resources and Environmental Engineering, Northeastern University, Shenyang110819, China;2.Liaoning Key Laboratory of Metallurgical Resources Recycling Science, Shenyang110819, China;3.College of Life and Health Sciences, Northeastern University, Shenyang110819, China). China Environmental Science,2014,34(8):2126~2132
To study the diversity of cultured microorganisms from oil shale samples in Fushun west open pit mine, cultured microorganisms were isolated and purified by dilution-plate method, and then were identified and phylogenetically analyzed by16S rDNA sequences (bacteria) and ITS-rDNA sequences (fungi). The results showed that the8 bacterial isolates from nutrient agar medium belonged to5 genera (Bacillus, Lysinibacillus, Brevibacillus, Paenibacillus and Rhodococcus), and the4 fungal isolates from potato dextrose agar medium belonged to4 genera (Cladosporium, Aspergillus, Absidia and Eupenicillium).2 bacterial strains (ZK4 and ZK5) could grow well on the agar medium with oil shale as the sole carbon and nitrogen source for more than5 generations, and were further considered as potential strains for the biotransformation of oil shale.
t:oil shale;microbial diversity;16S rDNA;rDNA ITS;phylogenetic analysis
X172
:A
:1000-6923(2014)08-2126-07
蒋绍妍(1985-),女,辽宁沈阳人,博士研究生,主要从事油页岩微生物多样性及油页岩微生物转化研究.发表论文7篇.
《中国环境科学》获评“RCCSE中国权威学术期刊(A+)”
2013-11-05
国家自然科学基金资助项目(51204055);中国博士后科学基金资助项目(20100481205);中央高校基本科研业务费专项资金资助项目(N130420002)
* 责任作者, 教授, xuexx@mail.neu.edu.cn
《中国环境科学》在武汉大学中国科学评价研究中心发布的第三届中国学术期刊评价中被评为“RCCSE中国权威学术期刊(A+)”.中国学术期刊评价按照各期刊的各指标综合得分排名,将排序期刊分为A+、A、A-、B+、B、C6个等级,评价的6448种中文学术期刊中有1939种学术期刊进入核心期刊区,其中权威期刊(A+)327种,核心期刊(A)964种,扩展核心期刊(A-)648种.此次获得“RCCSE中国权威学术期刊(A+)”称号的环境类期刊有3种.
