抗肿瘤药卡培他滨原料药的质量控制及稳定性考察
2014-05-05赵灿培
赵灿培
江南大学,江苏无锡 214000
抗肿瘤药卡培他滨原料药的质量控制及稳定性考察
赵灿培
江南大学,江苏无锡 214000
目的 建立抗肿瘤药卡培他滨原料药的质量控制方法,并考察其稳定性。 方法 采用高效液相色谱法测定卡培他滨原料药含量和有关物质,并考察其在加速试验和长期试验条件下的稳定性。 结果 建立了卡培他滨原料药的质量控制方法,包括性状、鉴别、比旋度(+96.0°~+100.0°)、有关物质(≤1.0%)、水分(≤0.3%)、炽灼残渣(≤0.1%)、重金属(≤20 mg/kg)和含量测定(98.0%~102.0%),样品检测检测结果在规定的限度内,并分别在加速试验[(40±2)℃,相对湿度75%±5%]和长期试验[(30±2)℃,相对湿度60%±5%]条件下进行了3个月的稳定性试验,稳定性考察期内各项指标未见明显变化。 结论 所建立的卡培他滨原料药质量控制方法重复性好、专属性强,结果准确可靠,稳定性检测结果在规定的限度内,卡培他滨原料药稳定性良好。
抗肿瘤药;卡培他滨;质量控制;稳定性考察
卡培他滨是第一个口服氟代嘧啶氨基甲酸酯类抗肿瘤药物,由瑞士罗氏(Roche)制药公司开发[1],临床适用于多种肿瘤的治疗,包括乳腺癌、结肠直肠癌、胃癌、宫颈癌以及氟尿嘧啶耐药的肿瘤等[2]。卡培他滨具有靶向性杀伤肿瘤细胞的功效[3],能选择性地作用于肿瘤细胞,使药物在肿瘤部位有更高活性[4],增强疗效的同时也减轻了不良反应,易于耐受[5],并能显著提高患者的生存质量,缩短平均住院时间,节约住院费用[6]。
1 材料与试剂
1.1 产品信息
产品名称:卡培他滨。
英文名称:Capecitabine。
中文化学名:1-(5-脱氧-β-D-呋喃核糖基)-5-氟-1,2-二氢-2-氧代-4-嘧啶氨基甲酸戊酯[7]。
英文化学名:1-(5-deoxy-β-D-ribofuranosyl)-5-fluoro-1,2-dihydro-2-oxo-4-pyrimidinecarbamate。
化学结构式:

分子式:C15H22FN3O6。
分子量:359.35。
CAS号:154361-50-9。
1.2 仪器与试药
Shimadzu LC-10A液相色谱仪;SF-3型微量水分测定仪;WZZ-2A型自动旋光仪。卡培他滨原料药(自制),卡培他滨对照品(美国食品药品监督管理局,批号:G0J205,含量:99.7%);乙腈为色谱纯,其余试剂为分析纯。
1.3 质量标准
1.3.1 性状 本品为白色或类白色粉末。
1.3.2 峰形鉴别 在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间与对照品溶液主峰的保留时间一致。
1.3.3 比旋度 取样品,加甲醇溶解并定量稀释成每毫升中约含10 mg的溶液,按无水物计算,在20℃下,按《中华人民共和国药典》(简称 “中国药典”)(二部)2010年版相关内容依法测定[8],比旋度应为+96.0°~+ 100.0°。
1.3.4 有关物质 按“2.8”项下方法,精密量取含量测定项下的对照溶液10 μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%~25%[9]。再精密量取含量测定项下的对照品溶液和供试品溶液各10 μl分别注入液相色谱仪,记录色谱至主峰保留时间的2倍,供试品溶液如显杂质峰,各杂质峰面积之和不得大于对照溶液主峰的峰面积(1.0%)。
1.3.5 水分 取本品适量,按《中国药典》2010年版(二部)相关内容依法测定[8],含水分不得>0.3%。
1.3.6 炽灼残渣 取样品适量,置铂坩埚中,按《中国药典》2010年版(二部)相关内容依法测定[8],炽灼残渣不得>0.1%。
1.3.7 重金属 取炽灼残渣项下遗留的残渣,按《中国药典》2010年版(二部)相关内容依法测定[8],含重金属不得>20 mg/kg。
1.3.8 含量测定 按无水物计算,含C15H22FN3O6应为98.0%~102.0%。
2 方法与结果
2.1 溶液的配制
稀释剂:乙腈∶甲醇∶水=7∶1∶12。
对照品溶液:精密称取适量卡培他滨对照品,溶解于稀释剂中,制成每毫升中含0.6 mg的溶液,作为对照品溶液。
对照溶液:精密量取卡培他滨对照品溶液1 ml,置于100 ml的量瓶中,加稀释剂定容摇匀,作为对照溶液。
供试品溶液:精密称取适量卡培他滨样品,溶解于稀释剂中,制成每毫升中含0.6 mg的溶液,作为供试品溶液。
2.2 色谱条件
色谱柱为Kromasil C18柱 (以十八烷基键合硅胶为填充剂,4.6 mm×250 mm,5 μm),检测波长为250 nm,流速为1 ml/min,柱温为40℃,进样量为10 μl。流动相:A为甲醇∶乙腈∶0.1%醋酸=7∶1∶12,B为甲醇∶乙腈∶0.1%醋酸=16∶1∶3;梯度洗脱:0→5 min,B在流动相中的比例 (f)保持在0%;5→20 min,f由0%上升至51%;20→30 min,f保持在 51%,30→31 min,f由51%下降至0%;31→40 min,f保持在0%。在此色谱条件下,卡培他滨的理论塔板数≥6000。色谱图见图1。

图1 高效液相色谱图
2.3 含量测定
精密量取上述对照品溶液和供试品溶液10 μl注入高效液相色谱仪,记录色谱图,按外标法以峰面积进行计算,即得含量。
2.4 标准曲线
取卡培他滨对照品约50 mg,精密称定,置于25 ml的量瓶中,用少量稀释剂溶解,定容摇匀,精密量取上述溶液0.5、1、2、3、4、5 ml,分别置10 ml量瓶中,用稀释剂稀释至刻度,摇匀。精密量取上述各溶液10 μl注入高效液相色谱仪,记录色谱图。以峰面积值(A)对浓度(C)进行线性回归[12]。回归方程为A=14 542 891C+184 919,r=0.9999(n=6)。结果表明,在0.0992~0.992 mg/ml浓度范围内,呈现良好的线性关系。
2.5 精密度试验
精密称取卡培他滨对照品适量,用稀释剂溶解并稀释成每毫升约含卡培他滨0.6 mg的溶液,连续进样6次,计算主峰面积的RSD为0.2%,表明含量测定的进样精密度良好,满足测定要求。
2.6 重复性试验
精密称取卡培他滨样品适量,用稀释剂溶解并稀释成每毫升约含卡培他滨0.6 mg的溶液,同法配制6份,分别测定含量,计算含量的RSD为0.1%,表明含量测定方法重复性好(表1)。

表1 重复性试验结果(%)
2.7 稳定性试验
取“重复性试验”项下的供试品溶液,分别于0、2、4、6、8、10 h各进样10 μl,记录峰面积,考察样品溶液的稳定性。计算含量的RSD为0.1%,表明供试品溶液在10 h内比较稳定(表2)。

表2 溶液稳定性试验结果(%)
2.8 样品检测
三批样品(批号分别为Batch.01、Batch.02、Batch. 03)质量控制项目(性状、鉴别、比旋度、有关物质、水分、炽灼残渣、重金属和含量测定)的检测结果见表3,提示各项指标均符合相关质量标准。
2.9 稳定性考察
2.9.1 加速稳定性试验 取三批样品(批号分别为Batch. 01、Batch.02、Batch.03)置于加速稳定性试验条件下[(40±2)℃、相对湿度75%±5%],定期于0、l、2、3个月时分别取样并检测,结果提示,l、2、3个月后各项检测指标与0月数据相比均无明显变化,表明本品在加速试验条件下放置3个月时质量较为稳定(表4)。

表3 样品检测结果
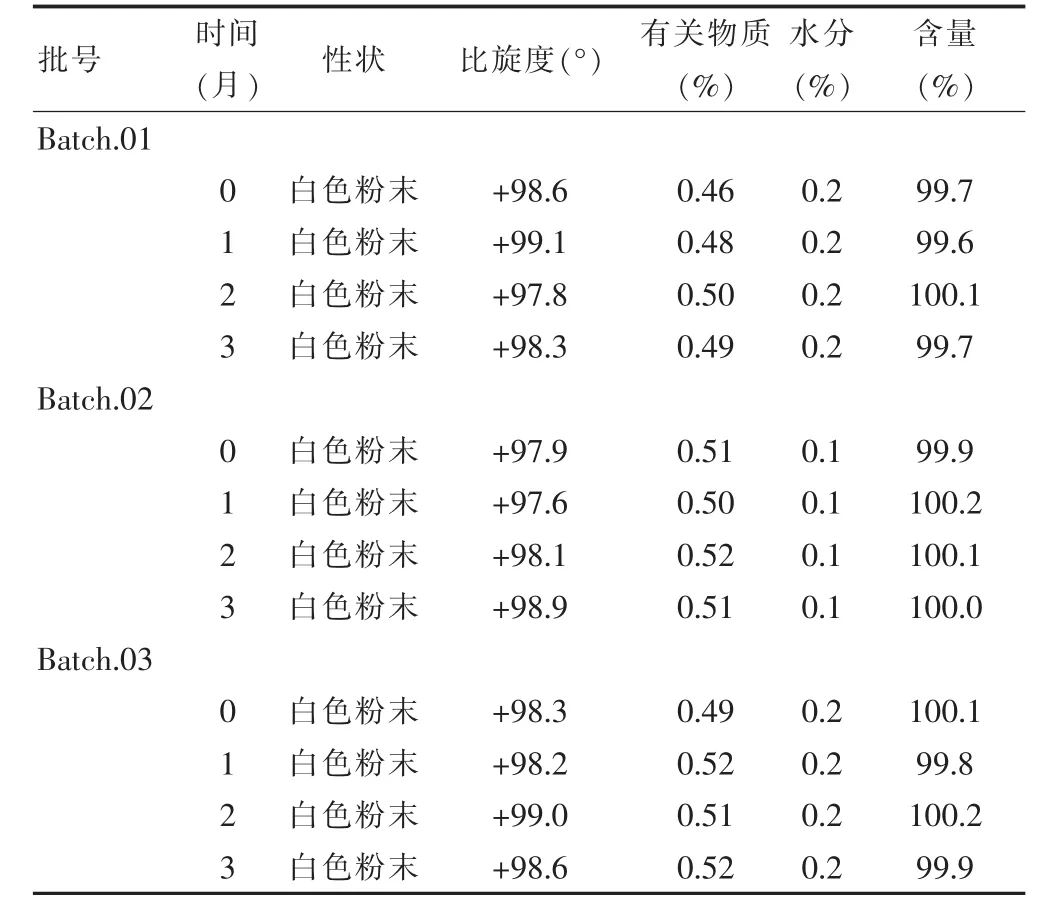
表4 加速稳定性试验结果
2.9.2 长期稳定性试验 取三批样品 (批号分别为Batch.01、Batch.02、Batch.03)置于长期稳定性试验[(30±2)℃、相对湿度65%±5%]条件下,定期于0、3个月时分别取样并检测产品质量,结果提示,3个后月各项检测指标与0月数据相比均无明显变化,表明本品在长期试验条件下放置3月后质量较为稳定(表5)。
3 讨论
本次研究根据《中国药典》2010年版(二部)对原料药的要求,研究了卡培他滨原料药的各项质量指标,建立了质量控制方法,包括性状、峰形鉴别、比旋度、有关物质、水分、炽灼残渣、重金属和含量测定,可以很好地控制卡培他滨原料药产品质量,样品检测结果均在规定的限度内,表明卡培他滨原料药质量可控。
本次研究同时对卡培他滨原料药的稳定性情况进行了初步考察,在加速稳定性试验和长期稳定性试验条件下检测产品质量,包括外观、比旋度、有关物质、水分、含量等,结果提示,l、2、3个月后各项检测指标与0月数据相比均无明显变化,表明产品稳定性良好。
采用高效液相色谱法测定卡培他滨原料药含量和有关物质,方法简便、准确,可作为该原料药的质量控制方法[10-16]。并对线性试验、精密度试验、重复性试验、溶液稳定性试验进行方法验证,表明该控制方法重复性好、专属性强、检测结果准确可靠,可以有效控制该产品的质量。

表5 长期稳定性试验结果
[1]样建楠,杜有国,宗在伟,等.卡培他滨的合成工艺研究[J].中国药师,2011,14(6):796-798.
[2]贾宝辉.新型选择性肿瘤化疗药物——卡培他滨[J].国外医学药学分册,2002,29(5):282-286.
[3]高昕,刘亚民.卡培他滨临床应用研究进展[J].山东医药工业,2003,22(2):36-37.
[4]刘云海,王虹,吕正松.抗肿瘤前体药物——卡培他滨[J].医药导报,2004,23(3):192-193.
[5]陈越磊,岑均达.卡培他滨类似物的合成及体内抗肿瘤活性[J].中国药物化学杂志,2004,14(5):277-282.
[6]包兴才,何声秀.口服抗肿瘤新药卡培他滨[J].国外医药合成药生化药制剂分册,2001,22(5):290-291.
[7]李菊平,张博琛.卡培他滨合成工艺的研究[J].齐鲁药事,2012,31(8):442-443.
[8]国家药典委员会.中华人民共和国药典[M].二部.北京:中国医药科技出版社,2010:附录ⅥE、ⅧM、ⅧN、ⅧH.
[9]国家食品药品监督管理局.化学药物质量标准建立的规范化过程技术指导原则[Z].2005.
[10]USP34-NF29(2010).The United States Pharmacopeial Convention[S].
[11]李菊平,张博琛.HPLC法测定卡培他滨的含量及有关物质[J].海峡药学,2013,25(1):48-51.
[12]国家食品药品监督管理局.化学药物质量控制分析方法验证技术指导原则[Z].2005.
[13]国家食品药品监督管理局.化学药物稳定性研究技术指导原则[Z].2005.
[14]陈海峰.药物使用期间稳定性试验的技术要求探讨[J].中国新药杂志,2010,19(3):184-189.
[15]宁黎丽,李雪梅.化学药物稳定性研究的试验方法和设计[J].中国新药杂志,2010,19(12):1013-1016.
[16]霍秀敏.稳定性试验与药品的有效期[J].药品评价,2007,4 (1):56-58.
Quality control and stability study of anticancer drug capecitabine
ZHAO Can-pei
Jiangnan University in Jiangsu Province,Wuxi 214000,China
ObjectiveTo establish the method of the quality control of anticancer drug capecitabine and observe its stability.MethodsCapecitabine bulk drug content and related substances were determined by high performance liquid chromatography,and the stability under the condition of the accelerated test and long-term test was investigated.ResultsThe method of the quality control of capecitabine was established,which included character,identification,optical rotation(+96.0°to+100.0°),related substance(≤1.0%),water determination(≤0.3%),residue on ignition(≤0.1%),heavy metals(≤20 mg/kg)and content determination(98.0%-102.0%),the test results were all within defined margin.Meanwhile,the stability was observed in accelerated testing[(40±2)℃,RH 75%±5%]and long-term testing[(30±2)℃,RH 60%± 5%]for 3 months,no obvious changes were observed in each index of stability test.ConclusionThe established quality control method of capecitabine is recurrent and specific,the results are accurate and reliable,the test results of stability are within defined margin,capecitabine has good stability.
Anticancer drug;Capecitabine;Quality control;Stability study
R927.11
A
1674-4721(2014)04(a)-0012-04
2014-02-20本文编辑:袁 成)
赵灿培(1983-),男,硕士,工程师,主要从事化学药物的研究
