HPLC法测定阿扎胞苷原料药中的有关物质
2014-04-30邹泓李迩娜武婷婷杨义芳狄斌
邹泓,李迩娜,武婷婷,杨义芳,狄斌
1中国药科大学药物分析教研室,南京 210009;2南京圣和药业股份有限公司,南京 210038
HPLC法测定阿扎胞苷原料药中的有关物质
邹泓1,2,李迩娜2,武婷婷2,杨义芳2,狄斌1*
1中国药科大学药物分析教研室,南京 210009;2南京圣和药业股份有限公司,南京 210038
目的:建立阿扎胞苷有关物质的HPLC测定方法。方法:采用Waters Atlantis T3柱(150 mm×4.6 mm,3 μm)对降解杂质和工艺杂质进行定量分析。以磷酸二氢钾缓冲液(pH=6.5)-60%乙腈为流动相,梯度洗脱;检测波长为214 nm。结果:主峰与各杂质峰间能达到基线分离。阿扎胞苷浓度在0.271~16.242 μg·mL-1范围内与峰面积呈良好的线性关系(r=0.9999),最低检测限为150 ng·mL-1。结论:应用高效液相色谱法选择性高、重现性好,可作为阿扎胞苷质量控制的方法。
HPLC法;阿扎胞苷;有关物质
阿扎胞苷,化学名:4-氨基-1-((2R,3R,4S,5R)-3,4-二羟基-5-(羟甲基)四氢呋喃-2-基)-1,3,5-三嗪-2(1H)-酮(结构见图1),分子式为C8H12N4O5,分子量为244.20。由Pharmion制药公司研制开发,于2004年5月在美国批准上市,是第一个骨髓增生异常综合征的治疗药物[1]。
目前,阿扎胞苷原料及其制剂未在国内上市。有关该药的测定方法,美国药典标准草案结合反相液相色谱法和亲水色谱法两种方法测定其有关物质[2],方法中仅对单个降解杂质与起始原料进行控制。该方法存在控制的降解杂质个数少,也未对工艺杂质进行定量分析等问题。
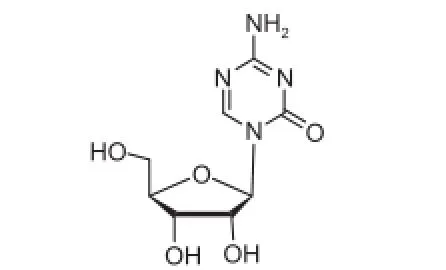
图1 阿扎胞苷结构式
本研究根据合成工艺,采用反相液相色谱法,可以更好地检测及控制阿扎胞苷原料药的有关物质,所测4批样品的有关物质中含N-甲酰脒基核糖基脲异构体之和不超过1.0%,含脒基核糖基脲异构体之和不超过0.5%,其他单个杂质不超过0.1%,总杂不超过2.0%。该方法简便准确,专属性好,能满足质量控制和稳定性考察要求。
1 材料
1.1 仪器
Agilent1260液相色谱仪(真空脱气机,二元泵,自动进样器,G4212B DAD检测器和ChemStation色谱工作站);Mettler toledo电子天平(XS105)。
1.2 试剂
阿扎胞苷原料(南京圣和药业有限公司,批号:S201302281、S201304201、S201304301、S201305121);阿扎胞苷对照品(由原料药精制而得,经紫外、红外、质谱和核磁共振分析确证,批号:20130305,纯度:99.57%)及各杂质对照品(降解杂质:N-甲酰脒基核糖基脲,A杂,纯度94.46%;脒基核糖基脲,B杂,纯度90%;阿扎胞苷异构体,C杂,纯度97.77%。工艺杂质:6-氨基-5-氮杂胞嘧啶,D杂,纯度96.02%;单乙酰阿扎胞苷,E杂,纯度98.72%。合成中间体,F杂,纯度99.50%),除B杂为USP标准品外,其余均为自制,且经过质谱与核磁共振分析确证。甲醇、乙腈为色谱纯;其余试剂均为分析纯;试验用水为超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:Waters Atlantis T3(4.6 mm×150 mm,3 μm);流动相:以0.02 mol·L-1磷酸二氢钾缓冲液(pH值6.5)为流动相A、以流动相A-乙腈(40∶60)为流动相B,进行梯度洗脱(见表1);检测波长:214nm;柱温:25℃;自动进样器温度:5℃;流速:1.0 mL·min-1;进样量:5 μL。
稀释溶剂:称取磷酸二氢钾6.8 g,亚硫酸氢钠5 g,加水溶解成1000mL,用磷酸调节pH值至3.0。

表1 洗脱梯度
2.2 有关物质测定方法
取本品4批原料,精密称定,加稀释溶剂溶解并稀释成每1 mL中含阿扎胞苷0.5 mg的溶液,作为供试品溶液;精密量取供试品溶液适量,用稀释溶剂制成每1 mL中含阿扎胞苷0.5 μg的溶液,作为主成分自身对照溶液。
照“2.1”项下色谱条件,取对照溶液5 μL注入液相色谱仪,调节仪器灵敏度,使主成分色谱峰的峰高约为满量程的10%,再精密量取供试品溶液和对照溶液各5 μL,分别注入色谱仪,记录色谱图。供试品溶液色谱图中如有杂质峰,按加校正因子的主成分自身对照法以峰面积计算,即得。
2.3 专属性试验
取阿扎胞苷对照品及A杂、B杂、C杂、D杂、E杂、F杂各适量,精密称定,加稀释溶剂制成每1 mL中含阿扎胞苷500 μg、各杂质5 μg的混合溶液,进样分析,见图2。结果表明,在上述色谱条件下阿扎胞苷主峰与各杂质峰能达到良好分离,杂质间的分离度均不小于1.5。

图2 阿扎胞苷分离度色谱图
另取阿扎胞苷原料(批号:S201302281)约10 mg,称取7份,分别置20 mL量瓶中,进行不同条件下的降解试验,试验条件依次为(A)未经破坏样品;(B)加0.1 mol·mL-1盐酸2 mL、室温放置15 min后中和;(C)加0.01 mol·mL-1氢氧化钠溶液2 mL后立即中和;(D)加10%过氧化氢溶液0.5 mL、室温放置3 h;(E)加稀释溶剂20 mL,60℃加热10 min;(F)60℃加热24 h;(G)2400 Lx光照24 h。6种条件下的样品均用稀释溶剂稀释至刻度。按“2.1”项下色谱条件测定上述溶液。色谱图见图3。

图3 阿扎胞苷降解色谱图
从图3表明,本品在溶液状态下,对酸、碱、氧化、高温均有不同程度的降解,降解产物均在14 min前出峰,A杂、B杂显著增加,在氧化及高温溶液条件下,还伴有少量C杂的产生,其他未知杂质增加不明显。在酸破坏条件下,本品主要降解为A杂,有关物质按面积归一化法计算为7.59%;在碱破坏条件下,有关物质为18.67%,说明阿扎胞苷在碱性条件下更不稳定;在氧化破坏条件下,本品主要降解产生B杂,有关物质为11.04%;在高温溶液条件下,本品产生的杂质峰较多,在保留时间为5.021、7.262、8.460、12.757 min均产生未知杂质峰,有关物质为19.35%。本品在固体状态下,对高温、光照较稳定,杂质个数、总量无明显变化。在60℃加热条件下,有关物质为0.26%;在光照条件下,有关物质为0.30%。
上述条件下,各杂质峰与主峰均能良好分离,主峰纯度高,物料保持平衡,说明此方法专属性好,能够有效检测样品中的降解产物。
2.4 线性关系考察
精密称取阿扎胞苷对照品和各杂质对照品适量,分别用稀释溶剂溶解并逐步稀释制成系列浓度的溶液。按“2.1”项下色谱条件测定,由溶液浓度(C)对峰面积(A)做线性回归,所得方程及其校正因子见表2。
2.5 检测限和定量限
取阿扎胞苷对照品和各杂质对照品适量,分别配成每1 mL中含0.5 mg的溶液,分别吸取溶液适量,用稀释溶剂逐级稀释,进样分析,按信噪比S/N= 3计算检测限;按信噪比S/N=10计算定量限。结果见表2。
2.6 精密度试验
取“2.4”项下阿扎胞苷及各杂质的限度浓度溶液,按“2.1”项下色谱条件测定,连续进样6次,记录色谱图,按主峰峰面积计算,RSD值均小于2%。

表2 线性关系和检测限、定量限结果
2.7 稳定性试验
取阿扎胞苷对照品适量,按“2.2”项下方法制成供试品溶液,分别在室温及5℃条件下放置,于0、1、2、3、4、5 h测定,照“2.1”项下色谱条件进样分析。结果表明:待测溶液在室温下放置,主峰面积显著下降,降解杂质的个数和含量均有所增加;在5℃下放置,溶液较为稳定,杂质的量增加较少,主峰面积RSD为0.42%,提示待测溶液应在5℃下现配进样。
2.8 有关物质样品测定
取阿扎胞苷4批原料适量,依法测定其有关物质,结果见表3。
3 讨论
3.1 流动相与色谱柱的选择
阿扎胞苷及其降解杂质为亲水性化合物,流动相起始有机相比例对阿扎胞苷的保留时间影响较大,以纯水相为起始比例的流动相组成,主峰阿扎胞苷保留时间适宜,杂质间分离度均不小于1.5。比较Agilent Zorbax RX-C8等色谱柱,B杂与D杂分离效果差,且峰形易拖尾,故选用耐水系列Waters Atlantis T3色谱柱,使用寿命长。
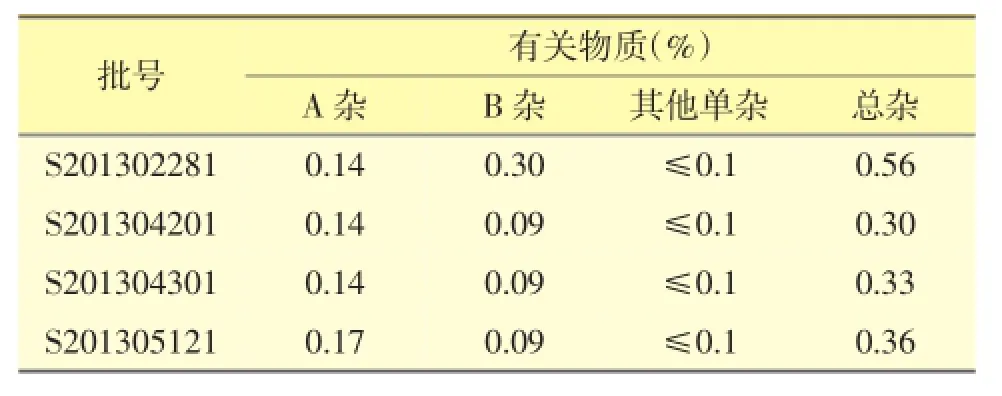
表3 有关物质测定结果
3.2 稀释溶剂、添加剂与pH的选择
由于阿扎胞苷易水解[3],故在溶剂中添加亚硫酸氢钠,以防止其过快分解;又考察了不同pH下的溶液稳定性,综合色谱柱pH的耐受范围,采用pH= 3.0的稀释溶剂时,阿扎胞苷分解较慢。
[1] CelgeneCorporation.Vida zaprescribinginformation [EB/OL].(2012-04-09).http://www.vidaza.com/pdf/PI_FINAL.pdf
[2] The United States Pharmacopeia.C98278,USP Pending Monograph Draft 1-For Public Comment[S].2012.
[3] Kissinger LD,Stemm NL.Determination of the antilekemia agents cytarabine and azacitidine and their respectivedegradationproductsbyhigh-performance liquid chromatography[J].J Chromatogr,1986,353: 309-18.
Determination of the Related Substances of Azacitidine by HPLC
ZOU Hong1,2,LI Er-na2,WU Ting-ting2,YANG Yi-fang2,Di Bin1*
1Department of Pharmaceutical Analysis,China Pharmaceutical University,Nanjing 210009;2Nanjing Sanhome Pharmaceutical Co.,Ltd.,Nanjing 210038,China
Objective:To establish a HPLC method for the determination of the related substances of azacitidine.Methods:The separation for degradation and process impurities was based on a Waters Atlantis T3(150 mm×4.6 mm,3 μm)column;the Mobile phase contisted of potassium dihydrogen phosphate solution(adjust to pH 6.5)-60%acetonitrile with gradient elution;the detective wavelength was 214 nm.Results:The chief peak and every impurity peak were separated well.A good linearity for azacitidine was obtained over the range of 0.2707~16.2420 μg·mL-1(r=0.9999),the LOD was 150 ng·mL-1.Conclusion:This highly selective and reproducible HPLC method offers an option in the quality control of azacitidine.
HPLC;Azacitidine;Related substances
R927.11
A
1673-7806(2014)06-516-03
邹泓,男,硕士生,研究方向:药物分析 E-mail:zouhong199107@126.com
*通讯作者 狄斌,男,教授,研究方向:药物分析 E-mail:dibin@cpu.edu.cn
2014-06-06
2014-06-17
