靶器官保护策略对全身炎症反应综合征患者肾功能保护作用的临床研究
2014-03-28张志坚
全 瑶,张志坚,曹 平※
(1.重庆市璧山县人民医院急救部ICU,重庆 402760; 2.重庆市巴南区人民医院重症医学科,重庆 401320)
全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)是感染或非感染因素作用于机体并刺激宿主免疫系统,激活效应细胞释放炎性介质,形成级联瀑布效应,不但引起局部组织细胞损害,还能打击远隔器官,而肾脏即为SIRS的靶器官之一。大量研究表明,肾功能损害是危重症患者预后不良的重要因素,减少肾功能损害的发生及减轻肾功能损害的程度仍是医学工作者们面临的严峻挑战。本研究通过采取综合措施保护炎症靶器官(肺脏、肠道及肝脏),同时检测SIRS患者肾功能变化情况,探讨炎症靶器官保护策略对SIRS患者肾功能的影响。
1 对象与方法
1.1研究对象 纳入2011年1月至2013年1月璧山县人民医院ICU收治的SIRS患者91例,诊断标准符合1991年美国芝加哥美国胸科医师学会/危重病医学会(ACCP/SCCM)联席会议标准。排除标准:合并高血压、糖尿病、慢性肝病及慢性肾脏疾病者。所有纳入患者及家属均签署知情同意书,并获本院医学伦理委员会批准。入选患者随机分为观察组和对照组。观察组47例,男28例、女19例,年龄32~56(40±8.1)岁,急性生理学及慢性健康状况评分Ⅱ(acute physiology and chronic health evaluation score,APACHEⅡ)为(11±3.1)分;对照组44例,男24例、女20例,年龄33~59(42±6.8)岁,APACHEⅡ评分为(12±3.9)分。两组患者在性别、年龄、APACHEⅡ评分方面具有均衡性(P>0.05)。
1.2治疗措施 对照组在积极处理原发病的同时,均给予呼吸、循环、营养支持等常规对症治疗。观察组在对照组治疗的基础上进行靶器官保护治疗:盐酸氨溴索60 mg,静脉滴注,每日2次+生大黄20 g,水煎成100 mL溶液,分2次口服或胃管鼻饲+还原谷胱甘肽1.2 g,静脉滴注,每日2次。两组疗程均为7 d。
1.3监测指标 动态监测氧合指数(PaO2/FiO2)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)和血清半胱氨酸蛋白酶抑制剂C(cystatin C,Cys-C)的变化,分别评估肺脏、肠道、肝脏及肾脏功能。
1.4检测方法 动脉血气分析采用瑞士AVL血气分析仪及配套血气卡检测。ALT、AST测定采用GS400全自动生化分析仪测定。血清Cys-C采用颗粒增强速率散射免疫比浊法测定,所有检测均严格按照试剂盒产品说明书严格操作。
1.5肾功能不全的界定标准 血清Cys-C≥1.02 mg/L为肾小球滤过功能下降,表示肾功能受损。急性肾衰竭(acute renal failure,ARF)诊断标准:血清肌酐≥176.8 μmol/L或每日上升≥44.2 μmol/L,尿量<400 mL/d。

2 结 果
2.1疗效观察 观察组肾功能障碍和ARF的发生率显著低于对照组,两组比较差异均有统计学意义(P<0.05),需要肾脏替代的治疗率,观察组少于对照组,但两组比较差异无统计学意义(P>0.05(表1)。
直线相关分析结果显示,观察组血清Cys-C的变化趋势与PaO2/FiO2的变化呈负相关(r=-0.396,P<0.05);与血清ALT、AST的变化呈正相关(r=0.725,0.617,P<0.05)。
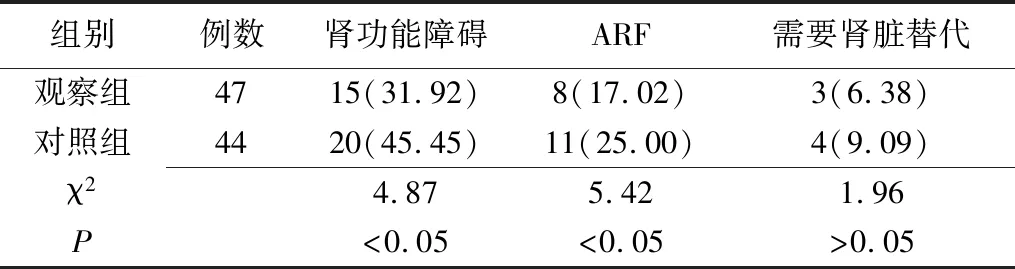
表1 两组SIRS患者肾功能障碍、ARF及需要肾脏替代发生率的比较 [例(%)]
观察组:常规对症治疗+靶器官保护治疗;对照组:常规对症治疗;SIRS:全身炎症反应综合征;ARF:急性肾衰竭
2.2两组治疗前后各项监测指标变化 治疗后第7日,两组PaO2/FiO2、AST、ALT均较治疗前有明显改善,但观察组改善状况更佳;治疗后第5、7日观察组明显高于对照组(P<0.05或0.01)。血清Cys-C水平均较治疗前明显下降,但同时间点与对照组比较,观察组下降更显著(P<0.05)(表2)。
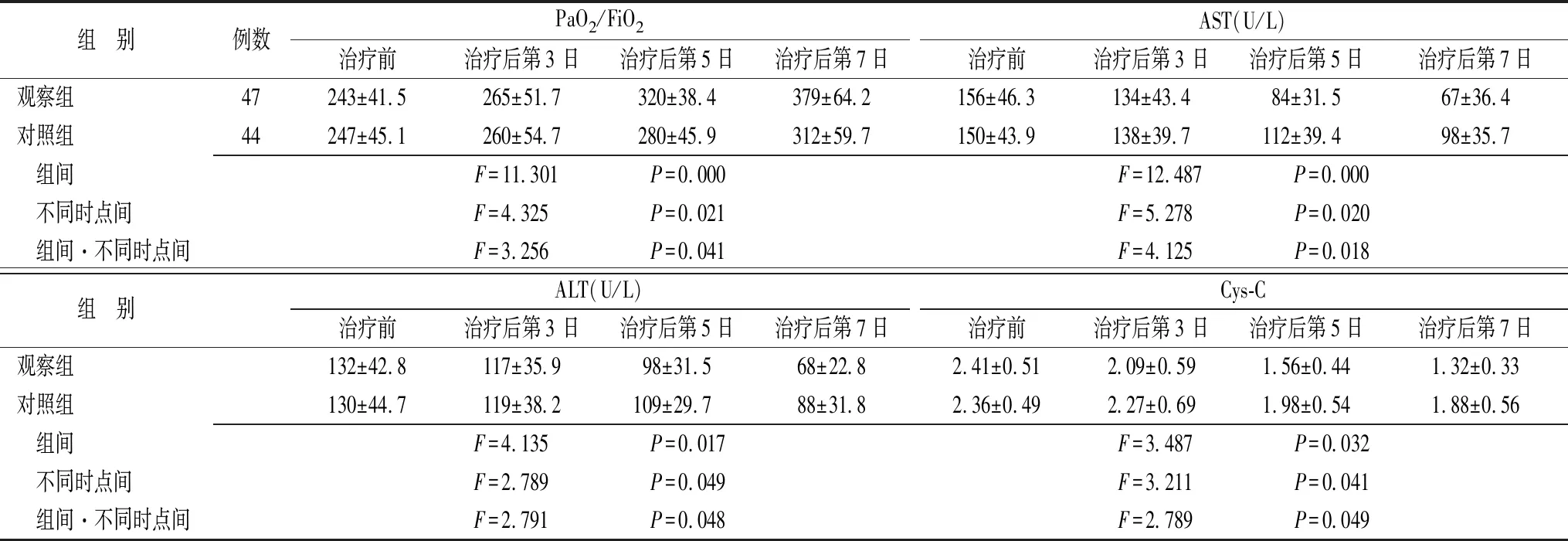
表2 两组SIRS患者各项监测指标治疗前后变化的比较
3 讨 论
SIRS是当前急诊和ICU中相当常见的综合征,机体在各种严重感染、创伤、烧伤、缺血缺氧及再灌注损伤等因素刺激下产生失控的全身性炎症反应统称为SIRS。一旦SIRS未改善,将会序贯出现2个或2个以上的系统或器官功能障碍,即多器官功能障碍综合征(multipl organ disfunction sydrom,MODS)。因此,损伤-应激反应-SIRS-MODS是一个循序渐进、逐渐发展、动态变化的过程,如何在疾病初起阶段有效控制其发展,是所有临床医师面临的共同课题[1]。
肠道屏障功能障碍在临床危重症患者中相当常见,在危重病的发生、发展及转归中占据重要地位,临床上由肠源性内毒素血症是导致患者死亡的重要原因之一。肠道作为机体中最大的细菌库及内毒素池,既是机体MODS发生的起源器官,又是在各种感染、创伤、休克、烧伤、手术打击、病理产科及各种炎性/应激反应中的靶器官[2-4]。肺脏为各种应激因素作用于机体后最易受损害的靶器官,一旦损伤性因素作用于机体最容易出现呼吸衰竭,缺氧打击又进一步引起其他脏器的损害,形成恶性循环,最终导致MODS的发生[5-6]。肝脏是炎性反应中最为剧烈和最易受损的器官之一,肝脏是人体最大的网状内皮细胞吞噬系统,它可以吞噬清除入侵机体的各种致病微生物及其代谢产物,激活并释放大量的细胞因子、急时相蛋白等,是脓毒症的另一个靶器官,其功能完善与否对于避免或阻断重症患者MODS发生、发展有重要作用[7-8]。
通腑中药在脓毒症动物模型中肠道屏障保护作用已得到证实。大黄可以改善脓毒症导致的炎性反应,减少炎性介质释放;可以改善缺血/再灌注损伤犬小肠黏膜的血液灌流,促进肠蠕动,减轻细菌移位及内毒素血症;可以减轻肠黏膜病理损伤[9-11]。盐酸氨溴索可以清除体内氧自由基,减轻组织脂质过氧化;恢复呼吸道纤毛自净功能及改善痰液流变学起到药物引流作用,利于感染灶清除;可以协同抗生素作用,使其在肺组织浓度提高利于控制感染;可以刺激肺泡表面活性物质合成及分泌,有助于保护肺功能、减轻机械通气相关肺损伤[12-16]。谷胱甘肽是广泛存在于机体内的自由基清除剂,参与体内多种生化代谢。既往研究表明,脓毒性休克伴急性肝损害患者血浆中谷氨酸盐减少是否能存活的独立预测因子[17]。谷胱甘肽还能通过抑制肿瘤坏死因子α、白细胞介素6、超氧化物歧化酶的释放,对脓毒症大鼠肺损伤起保护作用[18]。本研究结果显示,联合保护炎症靶器官治疗方案可以明显改善患者氧合情况,减轻肝损伤程度。
急性肾损害是危重患者常见关发症,是死亡的独立危险因素[19]。Cys-C是近年来研究较多的肾损伤标志物,是早期识别肾脏损害最有效且简单的评价指标[20]。当急性损伤因素侵袭机体时,肾脏多处于低灌注状态,由于缺血、缺氧、感染、创伤、脓毒症等因素而产生大量的炎性介质导致肾脏受损。本研究结果显示,观察组反映肠道、肺脏及肝脏等炎症靶器官功能的评价指标较对照组明显改善(P<0.05);直线相关分析显示,血清Cys-C变化趋势与PaO2/FiO2变化呈负相关(r=-0.396,P<0.05);与血清ALT、AST的变化呈正相关(r=0.725,r=0.617,P<0.05)。观察组肾功能障碍发生率明显下降(25% vs 45.45%,P<0.05)。这表明注重炎症靶器官保护措施除了直接保护作用外,还减轻了过度炎性反应而间接保护其他器官。
[1] Bone LB,Giannoudis P.Femoral shaft fracture fixation and chest injury after polytrauma[J].Bone Joint Surg Am,2011,93(3):311-317.
[2] Deitch EA,Xu D,Kaise VL.Role of the gut in the development of injury and shock induced SIRS and MODS:the gut-lymph hypothesis,a review[J].Front Biosci,2006,1(11):520.
[3] Gatt M,Reddy BS,MacFie J.Review article:bacterial translocation in the critically ill-evidence and methods of prevention[J].Aliment Pharmacol Ther,2007,25(7):741.
[4] 乔治,黎沾良,李基业,等.严重多发伤后肠道细菌移位的临床研究[J].中国危重病急救医学, 2006,18(1):13.
[5] Martin GS,Mannino DM,Eaton S,etal.The epidemiology of sepsis in the United States from 1979 through 2000[J].N Engl J Med,2003,348(16):1546-1554.
[6] Rubenfeld GD,Caldwell E,Peabody E,etal.Incidence and outcomes of acute lung injury[J].N Engl J Med,2005,353(16):1685-1693.
[7] 赵伟,何新飙.脓毒症诱发急性肝功能障碍患者的危险因素和临床特征分析[J].中华急诊医学杂志,2012,21(1):61-64.
[8] 杜施霖,姚晨玲,栾骁,等.抑制枯否细胞对脓毒症大鼠肝脏微循环的影响[J].中国急救医学,2011,31(6):518-520.
[9] 韩磊,任爱民,王红,等.中药复方通腑颗粒及其组分对脓毒症大鼠肠黏膜机械屏障的影响[J].中国危重病急救医学,2011,23(2):91-94.
[10] 幸泽茂,卢君强,刘岩松,等.大黄对脓毒症大鼠血浆高迁移率族蛋白B1表达的影响[J].中国急救医学,2009,29(4):338-340.
[11] 张朝晖,周刚,龚勋,等.衡炎方对严重脓毒症免疫调控的前瞻性研究[J].中国危重病急救医学,2011,23(2):77-80.
[12] Beeh KM,Beier J,Esperester A,etal.Antiinflammatory properties of ambroxol[J].Eur J Med Res,2008,13(12):557-562.
[13] Seifart C,Colstermann U,Seifart U,etal.Cell-specific modulation of surfactant proteins by ambroxol treatment[J].Toxicol Appl Pharmaco,2005,203(1):27-35.
[14] Hafez MM,Aboulwafa MM,Yassien MA,etal.Activity of some mucolytics against bacterial adherence to mammalian cells[J].Appl Biochem Biotechnol,2009,158(1):97-112.
[15] 郜向娜,余加林,吴玉华,等.氨溴索对成熟表皮葡萄球菌生物被膜结构的破坏作用和膜内菌的杀灭作用[J].中国抗生素杂志,2011,36(8):635-639.
[16] Hama AT,Plum AW,Sagen J.Antinociceptive effect of ambroxol in rats with neuropathic spinal cord injury pain[J].Pharmacol Biochem Behav,2010,97(2):249-255.
[17] Poeze M,Luiking YC,Breedveld P,etal.Decreased plasma glutamate in early phases of septic shock with acute liver dysfunction is an independent predictor of survival[J].Clin Nutr,2008,27(4):523-530.
[18] 廖秀玉,林建东,倪秀雄,等.还原型谷胱甘肽对脓毒症大鼠肺部超微结构及血中细胞因子水平的影响[J].中国危重病急救医学,2010,22(5):282-284.
[19] Bagshaw SM,George C,Bellomo R.Early acute kidney injury and sepsis:a multicentre evaluation[J].Crit Care,2008,12(2):R47.
[20] Jovanovic D,Krstivojevic P,Obradovic,etal.Serum cystatin C cmd beta 2-microglobulin as markers of glomerular filtration rate[J].Ren Fail,2003,25(1):123-133.
