温度、光照和盐度对2株曼氏骨条藻生长及脂肪酸组成的影响
2014-03-26高秀芝蒋霞敏
高秀芝, 蒋霞敏, 叶 丽
(宁波大学 海洋学院, 浙江 宁波 315211)
微藻中所含的高不饱和脂肪酸(HUFA),特别是二十碳五烯酸(EPA)对鱼虾等幼体的生长发育具有重要的作用,并且EPA在营养强化、预防和治疗多种疾病方面也发挥着非常重要的作用。而温度、光照、盐度等基础生态因子是影响微藻生长、油脂积累和脂肪酸组成的重要因素。因此,研究微藻的生长、总脂及脂肪酸组成与基础生态因子的关系,是一项必须的基础性研究工作。
国内外关于骨条藻属中的中肋骨条藻(Skeletonemacostatum)研究的较多,主要集中在中肋骨条藻的脂肪酸组成[1-2],温度、光照[3]、氮磷营养盐[4-6]等对其生长的影响方面,对影响总脂含量、脂肪酸组成的重要环境因素鲜有报道。本文在分析了5株海洋微藻的总脂及脂肪酸组成,筛选出3株总脂、EPA含量较高藻株的基础上,研究了温度、光照和盐度对分离筛选藻株曼氏骨条藻(Skeletonemamunzelii)SM-1、曼氏骨条藻SM-2的生长、总脂含量及脂肪酸组成的影响,旨在了解重要理化因子对2株曼氏骨条藻油脂积累和脂肪酸组成影响的规律,为优化培养条件、增加生物量、促进油脂积累和提高EPA提供理论依据。
1 材料与方法
1.1 藻种
曼氏骨条藻SM-1和曼氏骨条藻SM-2是作者分别从浙江渔山列岛海域(122°13′00″~122°18′50″E,28°52′00″~28°57′00″N),朱家尖近海海域(29°52′ N, 122°25′ E)采用水滴分离法和稀释法分离获得的藻株,经特殊处理扫描电镜拍摄专家鉴定。采用MAV培养基[7]进行单种培养。培养条件为温度25℃,光照强度60 μ mol/m2·s,自然海水盐度25,pH值8.05,不充气培养。
1.2 温度试验
设置温度梯度为10、15、20、25和30℃。培养容器为3 L三角烧瓶,培养水体为2.5 L,各三平行。采用MAV培养基进行单种培养,各组放在GXZ-260C型智能型光照培养箱中,培养条件为不充气培养,光照强度为60 μ mol/m2·s,光暗周期12 h∶12 h,盐度25,培养时间7 d,
1.3 光照试验
设置光照强度梯度为20、40、60、80、100和120 μmol/m2·s,光暗周期12 h∶12 h。培养温度为25℃,其他条件同1.2。
1.4 盐度试验
设置盐度梯度为10、15、20、25、30、35和40。用消毒自然海水、消毒的淡水和饱和氯化钠溶液调节盐度。培养温度为25℃,其他条件同1.2。
1.5 测定指标和测定方法
生长速率的测定:达到指数生长末期后,采用血球计数板测定藻细胞密度,生长速率按K=(lnN2-lnN1)/t计算。
式中:t为培养天数;N1为培养开始时的藻细胞数;N2为培养t天后的藻细胞数。
总脂含量的测定:在藻细胞达到指数生长末期后将藻液离心收集(4000 r/min, 4℃),冷冻干燥,藻粉于-20℃冷冻保存。称取100 mg左右的藻粉,参照改进后的Bligh-Dyer法[8]进行总脂含量的测定。
总脂含量(%)=(总脂质量/藻粉质量)×100
脂肪酸组成的测定:总脂移入4 mL样品瓶,加入5%~6%KOH甲醇溶液(V/V 4∶1), 充N21 min。皂化甲酯化过程参照文献[9],然后用日本SHIMADZU公司QP2010气象色谱-质谱分析仪进行分析, 参考脂肪酸标准和参考文献[10-13],用面积归一法计算出各脂肪酸的百分含量(以占脂肪酸含量的百分比表示)。
1.6 数据处理与统计
绘图采用Excel,数据统计分析利用SPSS 13.0进行单因素方差分析(One-way ANOVA), 并采用LSD进行多重比较。
2 结果
2.1 温度试验
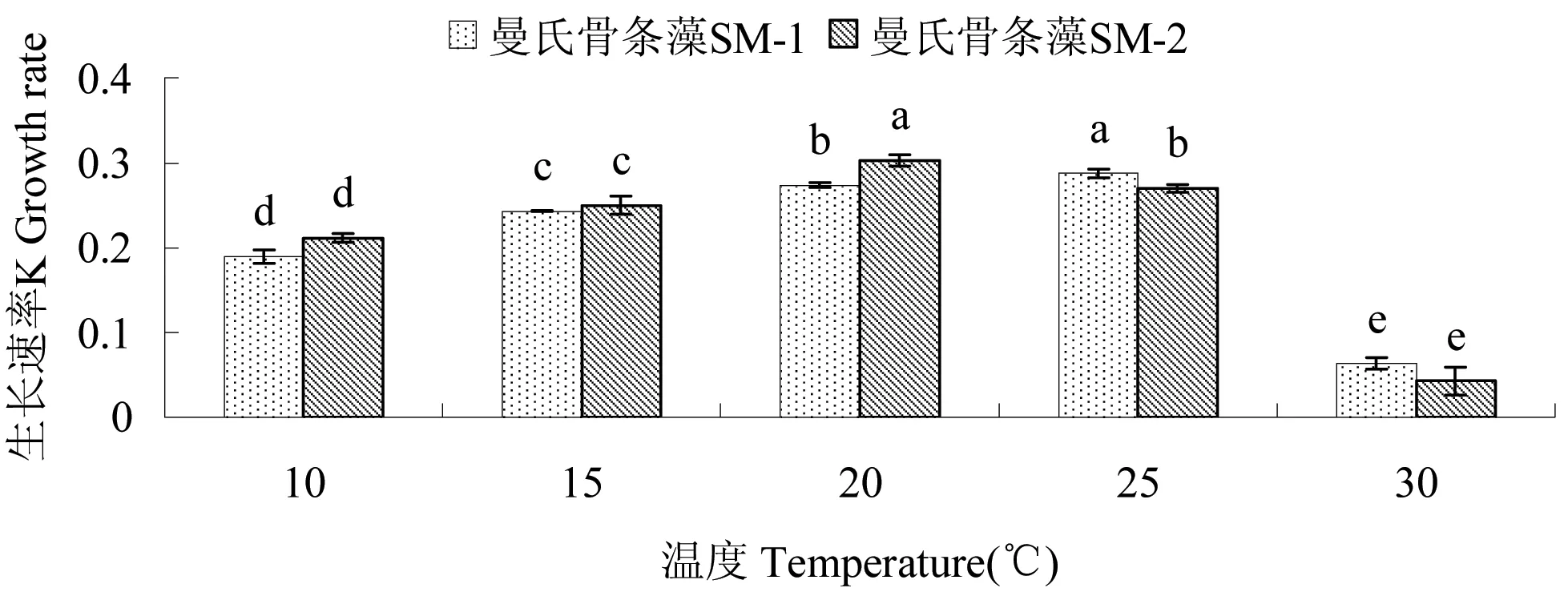
图1 温度对2株曼氏骨条藻生长速率的影响
2.1.1 温度对藻生长速率的影响 不同温度对2株藻生长速率影响显著(P<0.05),见图1。SM-1和SM-2的生长速率均随温度的上升先增加后降低, SM-1在25℃时生长速率达到最大(0.288),显著高于其它组(P<0.05);30℃时生长速率最小(0.063),显著低于其它组(P<0.05)。SM-2在20℃时生长速率达到最大(0.303),显著高于其它组(P<0.05);30℃时生长速率最小(0.042),显著低于其它组(P<0.05)。
2.1.2 温度对藻总脂含量的影响 不同温度对2株藻总脂含量影响显著(P<0.05,见图2。10~25℃下,SM-1总脂含量随温度的升高而降低,10℃时总脂含量达到最高(16.40%),与其它组差异显著(P<0.05),20℃与25℃无显著差异(P>0.05)。SM-2总脂含量在10~25℃下随温度的升高,有下降趋势。与SM-1相比,SM-2在25℃时的总脂含量(11.48%)要高于20℃时的总脂含量(9.98%),且差异显著(P<0.05),而20℃与30℃无显著差异(P>0.05);10℃时,SM-2总脂含量也达到最高(18.06%),与其它组差异显著(P<0.05)。
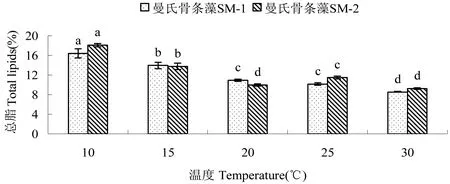
图2 温度对2株曼氏骨条藻总脂含量的影响
2.1.3 温度对藻脂肪酸组成的影响 不同培养温度对2株藻脂肪酸组成的影响差异极显著(P<0.01),见表1。2株微藻的主要脂肪酸为C16:1 n-7、C16:0、C20:5 n-3、C14:0、C16:3。SM-1的EPA、PUFA含量随温度的升高呈先上升后下降的趋势,15℃时EPA、PUFA含量均达到最高,分别为18.87%和40.98%,与其它组差异均极显著(P<0.01),30℃时均最低,均显著低于其它组(P<0.01)。SM-2的EPA、PUFA含量变化趋势同SM-1,15℃时EPA、PUFA含量最高(19.97%、42.59%),与其它组均差异极显著(P<0.01),30℃时EPA、PUFA含量均最低(13.89%和29.20%),显著低于其它组(P<0.01)。
2.2.2 光照强度试验
2.2.1 光照强度对藻生长速率的影响 不同光照强度对2株藻生长速率影响显著(P<0.05),见图3。在光照强度为120 μ mol/m2·s时2株藻均出现藻细胞死亡现象,说明这2株藻不适合在120 μ mol/m2·s及以上的强光照下培养。20~120 μ mol/m2·s下,2株藻的生长速率均随光照强度的增强呈现先增高后降低的趋势,2株藻的的生长速率从高到低依次为60 μmol/m2·s>40 μmol/m2·s>80 μmol/m2·s>20 μmol/m2·s>100 μmol/m2·s。60 μmol/m2·s时,2株藻的生长速率均达到最大值(SM-1 0.262、SM-20.275),与其它组相比均差异显著(P<0.05)。
2.2.2 光照强度对藻总脂含量的影响 不同光照强度对2株藻总脂含量影响显著(P<0.05),见图4。在光照强度 20 μ mol/m2·s~100 μ mol/m2·s下,2株藻的总脂含量均随温度的升高而降低。SM-1藻株在20 μ mol/m2·s时SM-1总脂含量达到最高(13.9%),显著高于其它组(P<0.05),100 μ mol/m2·s时最低(9.67%),而 80 μ mol/m2·s与100 μ mol/m2·s无显著差异(P>0.05)。SM-2藻株在20 μ mol/m2·s时总脂含量也达到最高(13.21%),与其它组差异显著(P<0.05),100 μ mol/m2·s时最低(9.74%),显著低于其它组(P<0.05)。
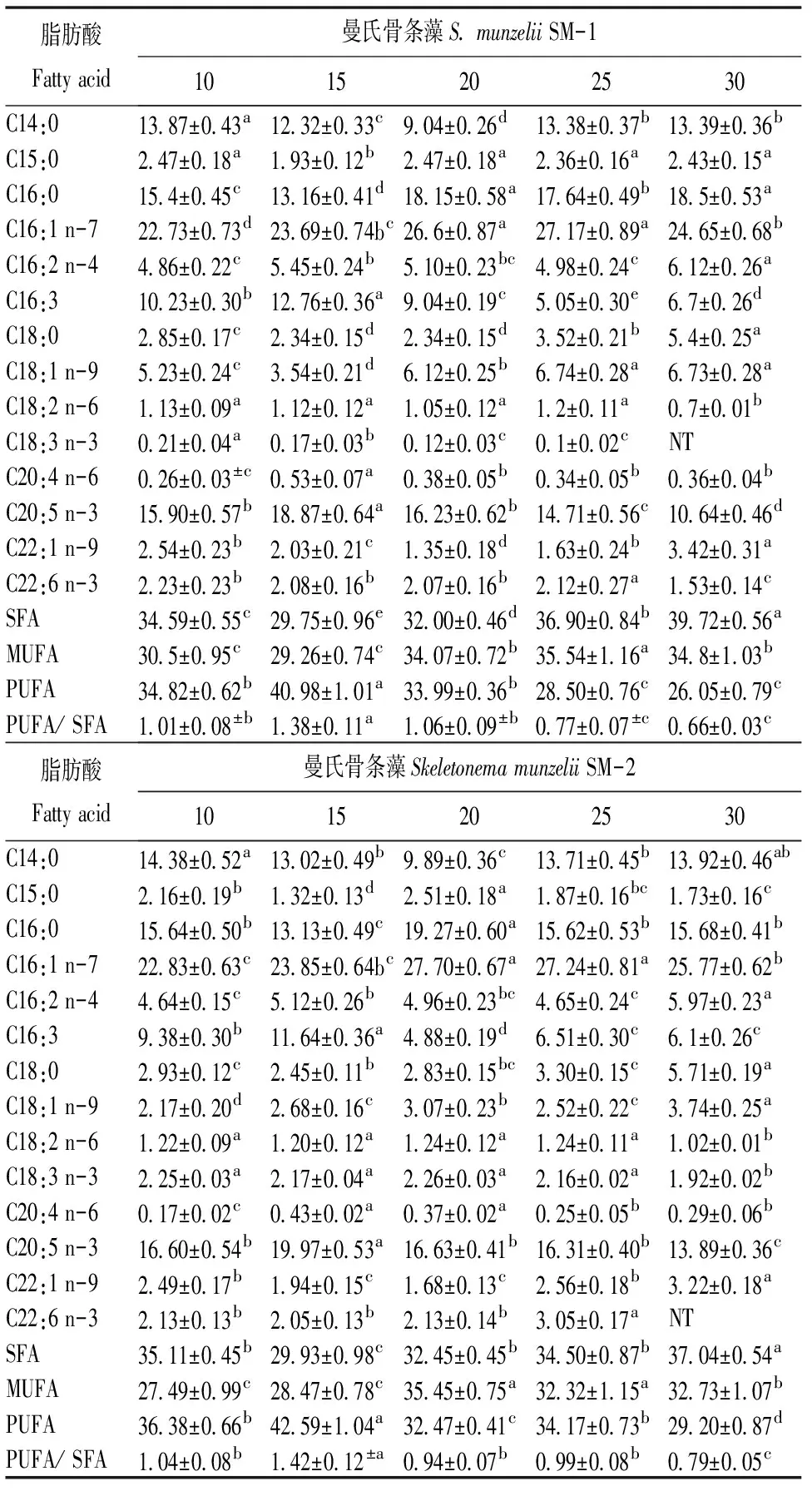
表1 不同温度下微藻的脂肪酸组成(占脂肪酸含量的百分比)
同行数据肩标无字母或相同字母表示差异不显著(P>0.05);不同字母表示差异显著(P<0.05). NT: no detected. SFA: saturated fatty acid. MUFA: monounsaturated fatty acid. PUFA: polyunsaturated fatty acid. 下表同。
2.2.3 光照强度对藻脂肪酸组成的影响 不同光照强度对藻脂肪酸组成的影响显著(P<0.05),见表2。共检出14种脂肪酸,主要脂肪酸为C16:1 n-7、C16:0、C20:5 n-3、C14:0、C16:3。SM-1的EPA、PUFA含量均随光照强度的增强呈下降的趋势,40 μ mol/m2·s时,EPA含量达到最高(19.39%),40 μ mol/m2·s与20 μ mol/m2·s的EPA含量无显著差异(P>0.05);而PUFA含量在20 μ mol/m2·s时达到最高,为41.88%;20 μ mol/m2·s时的PUFA含量与其它组差异显著(P<0.05),在60 μ mol/m2·s时,EPA、PUFA含量均为最低,分别仅为14.43%、29.35%,均与其它组差异显著(P<0.05)。SM-2的EPA含量随着光照强度的增强呈先减后增的趋势,40 μ mol/m2·s时最高(21.21%),但与20 μ mol/m2·s(20.74%)无显著差异(P>0.05),60 μ mol/m2·s时最低(16.75%),与其它组显著差异(P<0.05);PUFA 含量随光照强度的增强呈先减后增的趋势,20 μ mol/m2·s时最高(43.49%),与其它组差异显著(P<0.05),60 μ mol/m2·s时最低(34.80%),与其它组差异显著(P<0.05),80 μ mol/m2·s与100 μ mol/m2·s的PUFA无显著差异(P>0.05)。
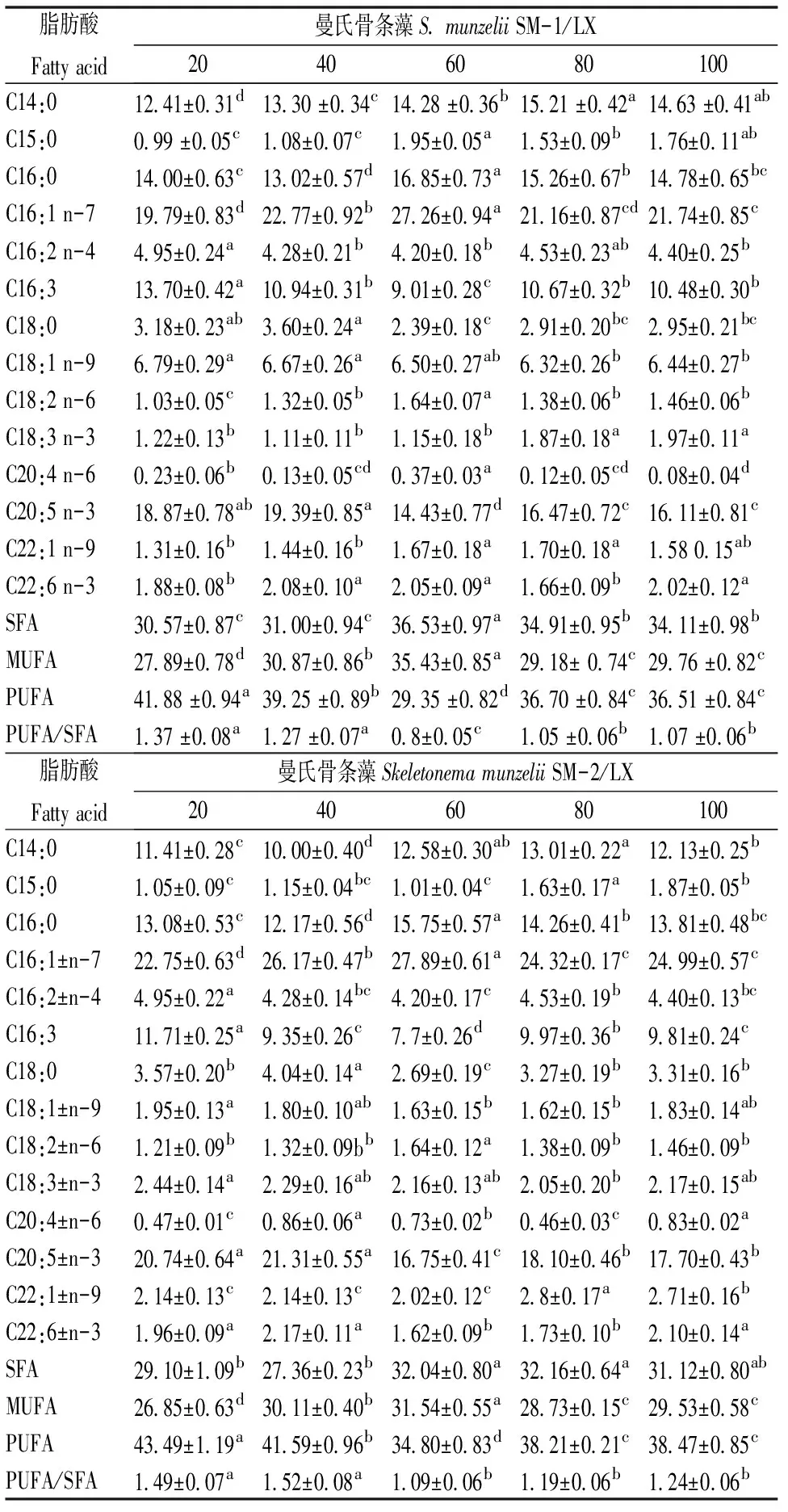
表2不同光照下微藻的脂肪酸组成
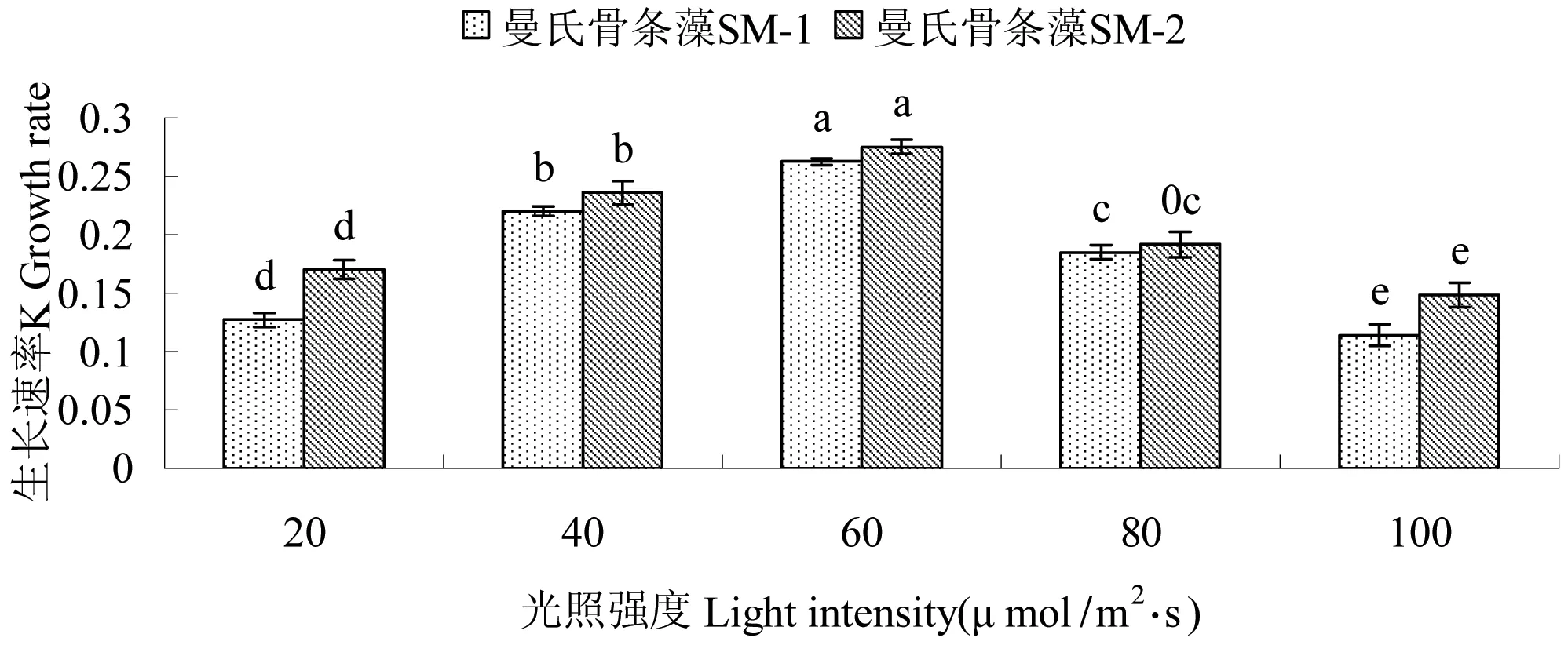
图3光照强度对2株曼氏骨条藻生长速率的影响
Fig 3 Effect of light intensity on growth rate ofS.munzeliiSM-1and SM-2
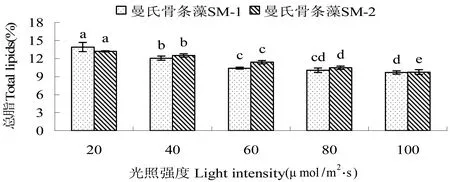
图4 光照强度对2株曼氏骨条藻总脂含量的影响
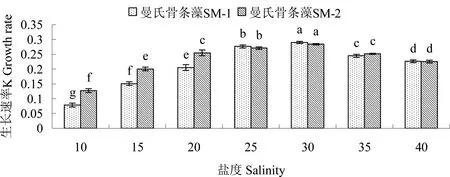
图5 盐度对2株曼氏骨条藻生长速率的影响
2.3 盐度试验
2.3.1 盐度对藻生长速率的影响 不同盐度对2株藻生长速率影响显著(P<0.05),见图5。在盐度10~40下,随着盐度的增加,2株藻的生长速率均呈先升高后降低的趋势。2株藻均在盐度30时生长速率最大,分别为0.290和0.284,与其它组差异显著(P<0.05);盐度10时小,显著低于其它组(P<0.05)。
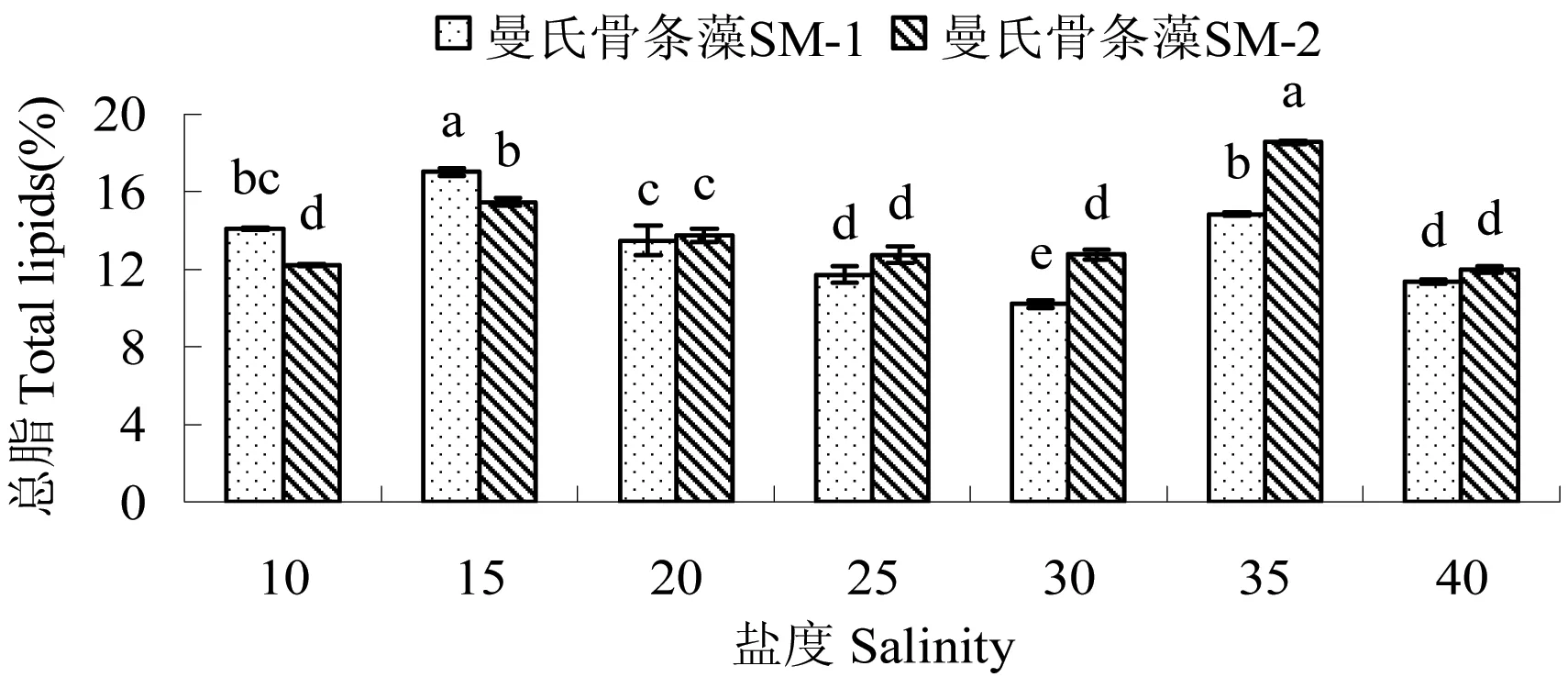
图6 盐度对2株曼氏骨条藻总脂含量的影响
2.3.2 盐度对藻总脂含量的影响 不同盐度对2株藻总脂含量影响显著(P<0.05),见图6。SM-1在盐度15时总脂含量最高,显著高于其它组(P<0.05);盐度30时最低,显著低于其它组(P<0.05)。各盐度下的总脂含量从高到低依次为为盐度15(17.01%)>35(14.85%)>20(13.49%)>25(11.73%)>30(10.21%),其中盐度35与10无显著差异(P>0.05),盐度10和盐度20无显著差异(P>0.05),盐度25和盐度40差异不显著(P>0.05)。SM-2在盐度35时总脂含量最高,盐度40最低,各盐度下的总脂含量从高到低依次为盐度35(18.56%)>15(15.46%)>20(13.76%)>40(11.97%),盐度40与盐度10、盐度25、盐度30无显著差异(P>0.05)。
2.3.3 盐度对藻脂肪酸组成的影响 不同盐度对藻脂肪酸组成的影响显著(P<0.05),见表3、表4。共检出14种脂肪酸,主要脂肪酸为C16:1 n-7、C16:0、C20:5 n-3、C14:0、C16:3。SM-1的EPA含量随盐度的增加呈先增后降的趋势,盐度15的EPA含量达到最高,显著高于其它组(P<0.05);盐度35时最低。SM-1的PUFA含量随盐度的增加呈先增后减的趋势,盐度15时PUFA含量达到最高,显著高于其它组(P<0.05);盐度25时最低(34.72%)。SM-2的EPA含量也随盐度的增加呈先增后减的趋势,盐度15时EPA含量达到最高,显著高于其它组(P<0.05);盐度35时最低,显著低于其它组(P<0.05)。SM-2的PUFA含量随盐度的增加亦呈先增后减的趋势,盐度15时达到最大,显著高于其它组(P<0.05);盐度25时最低,显著低于其它组(P<0.05)。
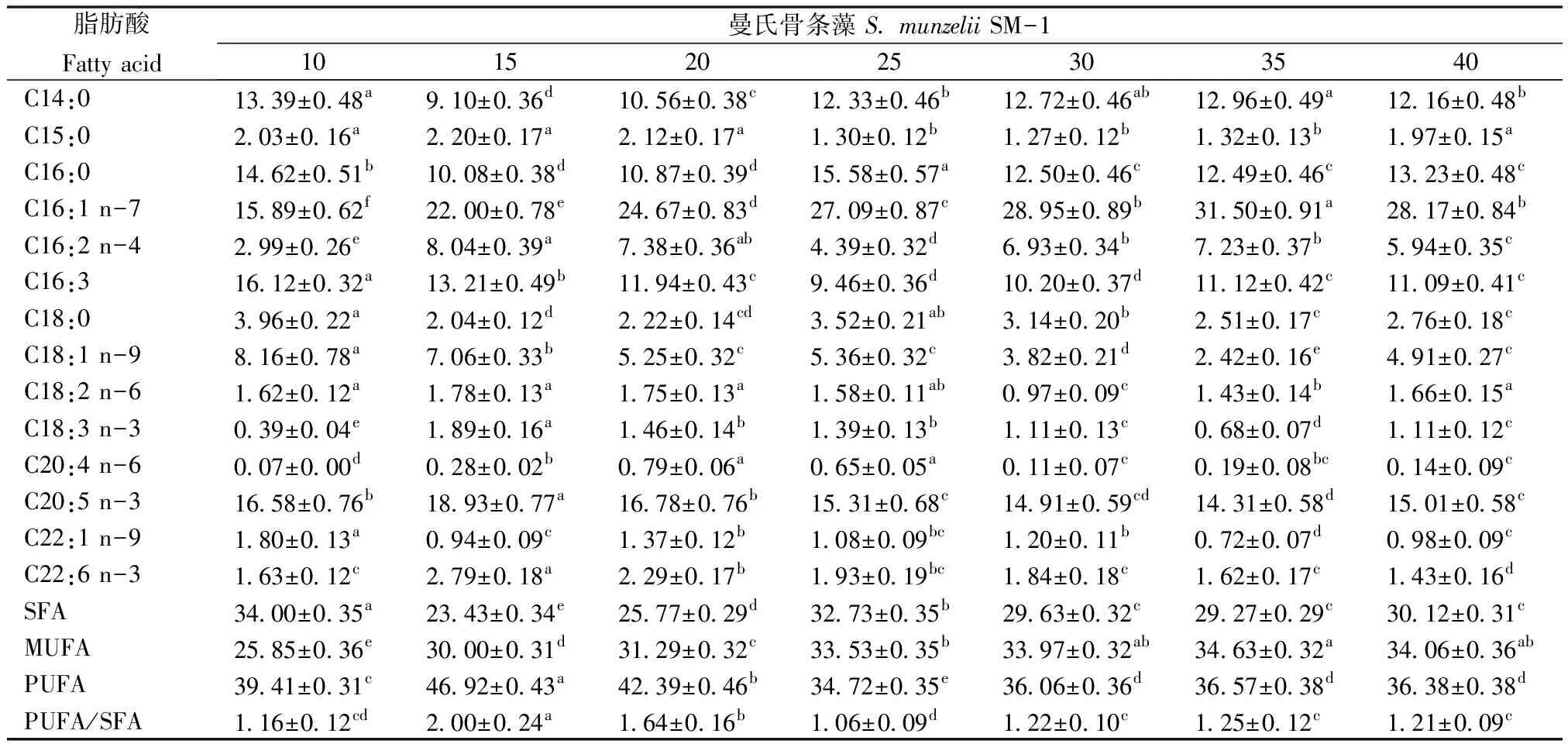
表3 盐度对曼氏骨条藻SM-1脂肪酸组成的影响
3 讨论
3.1 温度对藻生长、总脂及脂肪酸组成的影响
温度是影响微藻生长、脂肪含量及脂肪酸组成的重要因子之一。本试验中2株曼氏骨条藻在不同温度下的生长速率差异显著,这2株藻均能在10~25℃下正常生长,最适生长温度分别为20~25℃,与于萍等[3]报道的中肋骨条藻的最适温度为25℃,在30℃下培养几天后大量死亡的结果较为一致。对于光自养型生物来说温度主要通过控制酶动力学来影响它们的生长[14]。超出适温范围温度时,可能由于微藻细胞出现不同程度的质壁分离[15]进而影响了其正常生活。
本试验中2株藻的总脂含量随着温度的升高而减少,10℃总脂含量达到最高,30℃时最低,与周洪琪等[16]报道的海洋硅藻铲状菱形藻(Nitzschiapaleacea)脂肪含量在10~30℃下随培养温度的升高而减少,在10℃时脂肪含量最高的结果较为一致。而Somerville[17]研究的微绿球藻(Nannochloropsisoculata)的油脂含量在一定温度范围内随温度的升高而增加,可见温度对脂肪含量的影响因种而异。
硅藻的主要脂肪酸为C14:0、C16:0、C16:1 n-7和EPA,而C18和C22多不饱和脂肪酸含量较低,本试验中2株曼氏骨条藻均为海洋硅藻,其脂肪酸组成符合硅藻的特性。试验表明低温有利于2株藻EPA及PUFA的合成,SM-1和SM-2在15℃时EPA及PUFA含量达到最高,而在生长速率达最大时PUFA含量较低,甚至低于30℃时的PUFA含量,可见并不是温度越高,PUFA、EPA含量越低。魏东等[18]研究表明在一定温度范围内,可通过降低培养温度来提高微藻的脂肪酸的不饱和度,以保持膜的通透性,从而提高细胞对低温的耐受力。
温度试验表明,对于SM-1、SM-2,在25℃生长速率达到最大时总脂含量、EPA和PUFA含量并不是最高。虽然低温可获得较高含量的PUFA,但势必会影响到生长速率或生物量,最终影响EPA及PUFA产量。因此在大规模培养中,可采用二次培养法,即先在最适温度下培养,积累生物量,再转至低温下培养调控,提高PUFA产量。
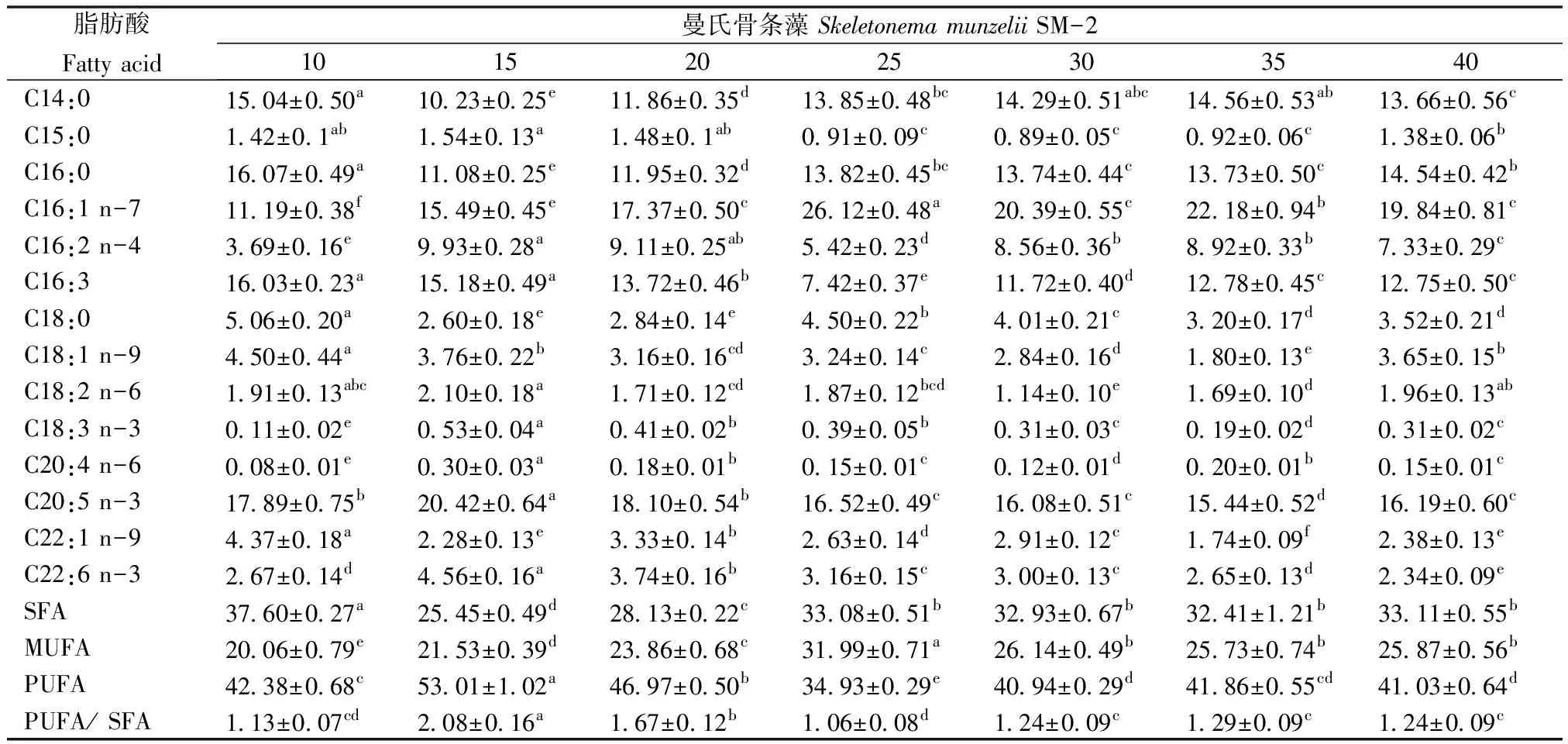
表4 盐度对曼氏骨条藻SM-2脂肪酸组成的影响
3.2 光照对藻生长、总脂及脂肪酸组成的影响
光是单胞藻培养中影响其生长及生化成分的重要因子之一。在适光范围,增加光照强度可使光合作用速度加快,细胞分裂速率加快,细胞分裂速率达到最高时的光强为饱和光强。若超过饱和光强,光合作用就会减弱甚至受到抑制[19]。试验中光照强度对2株曼氏骨条藻SM-1、SM-2的生长速率及生物量的影响是显著的,2株藻的最适光强是60 μ mol/m2·s,在20~100 μ mol/m2·s光强下,两者的生长速率均随着光强的增加而减小;而在高光强120 μ mol/m2·s下,均出现藻体死亡现象,说明SM-1、SM-2不适合在120 μ mol/m2·s及以上的高光强下培养。于萍等[3]研究的中肋骨条藻的最适光照强度已经高于120 μ mol/m2·s,可见即使是同种属的藻其最适光强也因藻株不同而异。
研究发现,在20~100 μ mol/m2·s光强下,SM-1、SM-2的总脂含量随光强的增加而减少,20 μ mol/m2·s光强下,总脂含量达到最高,100 μ mol/m2·s时最低,这与石娟等[19]研究的小新月菱形藻(Nitzschiaclosteriumf.minutissim)(MACC/B228)和等鞭金藻8701(IsochrysisgalbanaParke 8701)(MACC/H060)在较低的光强下,2种藻的脂肪含量增多,较高光强下脂肪含量减少的研究结果相似,而这可能与细胞内光合作用的机制有关,光合作用在叶绿体的类囊体上进行,而类囊体的主要组分是甘油脂,甘油脂的相对数量与细胞的光合活力关系密切。低光强下,为增加光合效率,类囊体的表面积有所增加,膜脂的合成速率维持在较高水平,而高光强下,光合机构受损,光合效率下降,脂膜合成速率降低,甚至受到破坏[20]。
更多研究表明,生长在高光照强度下的微藻其不饱和脂肪酸的比例在下降[20]。孙利芹等[21]研究的紫球藻(Porphyridiumcruentum)在中等光强下有利于EPA的积累。而Lee 等[22]研究的紫球藻的EPA含量则随光照强度的增加而增加。蒋霞敏等[9, 23]对微绿球藻和绿色巴夫藻(Pavlovaviridid)的研究中发现PUFA含量随光强的增强而降低,针对这一现象,Renaud等[24]认为是由于不同的微藻细胞中存在不同类型的去饱和酶,而这些酶的活性受光强的影响不同所致。本研究中SM-1、SM-2的EPA含量均在中等偏低的光强40 μ mol/m2·s时达到最大,而均与光强20 μ mol/m2·s时的EPA含量无显著差异。2株藻的PUFA含量均在低光强20 μ mol/m2·s时达到最大值。
光照试验表明,2株藻最适生长光强为60 μ mol/m2·s,而总脂、EPA、PUFA达到最高含量时的光强为20 μ mol/m2·s,因此在大规模生产当中,可考虑先在最适生长光强60 μ mol/m2·s下培养一段时间,再转移到低光强20 μ mol/m2·s下培养,以便提高EPA和PUFA 产量。
3.3 盐度对藻生长、总脂及脂肪酸组成的影响
盐度是影响微藻生长、脂肪含量及脂肪酸组成的又一重要因子,但也因种而异。海水单胞藻一般都是广盐性藻[25],试验发现在盐度10~40下,2株藻都能正常的生长。2株藻的最适生长盐度均为30。而陈炳章等[26]研究的中肋骨条藻在18~35.7下均适合其生长,盐度对中肋骨条藻影响较小,几乎看不出什么影响。霍文毅等[27]提出中肋骨条藻的最适盐度增值范围20~30,这与本研究结果相似。
研究表明SM-1合成脂肪的最适盐度为15,其次为盐度35,而SM-2合成脂肪的最适盐度为35,其次为15。高于或低于最适盐度则随盐度的升高或下降而减少。韦芳三等[28]研究的盐藻(Dunaliellasalina)在盐度40时脂肪含量达到最高,高于或低于40时,随盐度的升高或下降减少,这与本研究的结果较为相似。盐度对微藻总脂含量的影响机理尚未清楚。
2株藻的EPA、PUFA含量在盐度10~20时较高,而盐度15时EPA、PUFA含量均最高,而最适生长盐度30时,EPA、PUFA含量偏低。这与冯雷等[29]研究的4株小球藻的EPA含量随盐度的增加有所下降的结果一致。Al-Hason 等[30]报道盐度对Naviculaoculara中脂肪酸的影响,结果表明盐度对脂肪酸的影响因种而异。
盐度试验表明盐度显著影响2株曼氏骨条藻的生长、总脂及脂肪酸组成。建议大规模生产时调整盐度为25~30,先提高生物量,后降盐度,提高总脂含量及PUFA产量。
参考文献:
[1]刘梦坛, 李超伦, 孙 松, 等. 两种甲藻和两种硅藻脂肪酸组成的比较研究[J]. 海洋科学, 2010, 34(10): 77-82.
[2]Zhukova N V, Aizdaicher N A. Fatty acid composition of 15 species of marine microalgae[J]. Phytochemistry, 1995, 39(2): 351-356.
[3]于 萍, 张前前, 王修林, 等. 温度和光照对两株赤潮硅藻生长的影响[J]. 海洋环境科学, 2006, 25(1): 38-40.
[4]胡晗华, 石岩峻, 丛 威, 等. 不同氮磷水平下中肋骨条藻对营养盐的吸收及光合特性[J]. 应用与环境生物学报, 2004, 10(6): 735-739.
[5]王金花, 唐洪杰, 杨茹君, 等. 氮磷营养盐对中肋骨条藻生长及硝酸还原酶活性的影响[J]. 海洋科学, 2008, 32(12): 64-68.
[6]刘东艳, 孙 军, 陈宗涛, 等. 不同氮磷比对中肋骨条藻生长特性的影响[J]. 海洋湖沼通报, 2002(2): 39-44.
[7]蒋霞敏. 营养与饵料生物实验教程[M]. 北京: 高等教育出版社, 2010: 80-81.
[8]Bligh E G, Dyer W J. A rapid method lipid extraction and purification[J]. Can J Biochem Physiol, 1959, 37: 911-923.
[9]蒋霞敏, 柳敏海, 邢晨光. 不同生态条件对绿色巴夫藻生长及脂肪酸组成的影响[J]. 水生生物学报, 2007, 31(1): 88-93.
[10]Chen Y C. The biomass and total lipid content and composition of twelve species of marine diatoms cultured under various environments[J]. Food Chemistry, 2012, 131: 211-219.
[11]徐继林, 严小军, 周成旭, 等. 19种(株)海洋微藻脂肪酸组成及充气产生的影响[J]. 宁波大学学报, 2006, 29(2): 180-185.
[12]刘梦坛, 李超伦, 孙 松. 两种甲藻和两种硅藻脂肪酸组成的比较研究[J]. 海洋科学, 2010, 34(10): 77-82.
[13]曹春晖, 孙世春, 麦康森, 等. 30株海洋绿藻的总脂含量和脂肪酸组成[J]. 青岛海洋大学学报, 2000, 30(3): 428-434.
[14]Davison I R. Environmental effects on algal photosynthesis: temperature [J]. Journal of Phycology, 1991, 27(1):2-8.
[15]陈明耀. 生物饵料培养[M]. 北京: 中国农业出版社, 1995:25-92.
[16]周洪琪, Renaud S M, Parry D L, 等. 温度对新月菱形藻、铲状菱形藻和杷夫藻的生长、总脂肪含量以及脂肪酸组成的影响[J]. 水产学报, 1996, 20(3): 235-240.
[17]Somerville C. Direct tests of the role of membrane lipid composition in low-temperature induced photoinhibition and chilling sensitivity in plants and cyanbacteria[J]. Proceedings of the National Academy of Sciences, 1995, 92: 6215-6218.
[18]魏 东, 张学成. 微藻脂肪酸去饱和酶及其基因表达生态调控研究新进展[J]. 海洋科学, 2000, 24(8): 42-46.
[19]石 娟, 潘克厚. 不同光照条件对小新月菱形藻和等鞭金藻8701生长及生化成分的影响[J]. 中国水产科学, 2004, 11(2): 121-128.
[20]曹春晖, 孙世春, 麦康森, 等. 光照强度对四株海洋绿藻总脂含量和脂肪酸组成的影响[J].生态学报, 2010, 30(9): 2347-2353.
[21]孙利芹, 郭尽力, 江 涛, 等. 环境因子对紫球藻细胞脂肪酸组成的影响[J]. 中国油脂, 2004, 29 (9) : 55-58.
[22]Lee Y K, Tan H M. Effect of temperature, light intensity and dilution rate on the cellular composition red algaPorphyridiumcruentumin light-limited chemostat cultures[J]. World Journal of Microbiology and Biotechnology, 1988, 4 (2) : 231-237.
[23]蒋霞敏. 温度、光照、氮含量对微绿球藻生长及脂肪酸组成的影响. 海洋科学, 2002, 26 (8): 9-13.
[24]Renaud S M, Parry D L, Thinh L V, et al. Effect of light intensity on the proximate biochemical and fatty acid composition ofIsochrysissp. andNannochloropsisoculatafor use in tropical aquaculture[J]. Journal of Applied Phycology, 1991, 3 (1): 43-53.
[25]Metechtan I. The effect of salinity on growth and chlorophyhll content in representative classes of utticelfuaf marine algae[J]. Canadian Journal of Chemical Engineering, 1961(7): 399-406.
[26]陈炳章, 王宗灵, 朱明远, 等. 温度、盐度对具齿原甲藻生长的影响及其与中肋骨条藻的比较[J]. 海洋科学进展, 2005, 23(1): 60-64.
[27]霍文毅, 俞志明, 邹景忠, 等. 胶州湾中肋骨条藻赤潮与环境因子的关系[J]. 海洋与湖沼, 2001, 2(3): 312-317.
[28]韦芳三, 李纯厚, 戴 明, 等. 盐度变化对盐藻生物量和总脂含量的影响[J]. 湖南农业科学, 2011(1): 134-136.
[29]冯 雷, 郭永恩. 盐度对四株海洋绿藻总脂含量和脂肪酸组成的影响[J]. 天津科技大学学报, 2009, 24(4): 22-24.
[30]Al-Hason R H, Ali A M, Kawash H H, et al. Effect of salinity on the lipid and fatty acid composition of the halophyteNaviculasp.: potential in mariculture [J]. Journal of Applied Phycology, 1990, 2(3): 215-222.
