鸭疫里默氏菌I型整合子与耐药基因盒检测
2014-03-11蔡秀磊
蔡秀磊,单 虎
(青岛农业大学动物科技学院山东省预防兽医学重点实验室 山东省兽药诊断试剂工程技术研究中心,山东 青岛266109)
目前,对养鸭业影响最大的细菌性传染病之一就是鸭疫里默氏菌(Riemerella anatipestifer,RA)病[1],该病的发病率和病死率都很高,在生产中最主要的防治手段仍然是药物治疗,但由于RA极易产生耐药性,常有治疗失败的现象,造成很大的经济损失,因此开展对该菌的耐药性及耐药基因方面的研究尤为重要。1989年,Stokes和Hall首次提出整合子(integron,In)结构[2],该结构是一个新的可移动的基因元件,可协助耐药基因水平传播。此后,整合子结构作为研究细菌耐药性的重要手段,受到了各国科研人员的关注。目前已经明确发现的整合子种类共有6种,在临床致病菌中出现机率最多的是I型整合子。
鸭疫里默氏菌的耐药性虽然引起了生产和科研工作的重视,但关于该菌的耐药基因方面的研究尚未见任何报道。本研究利用PCR技术,对实验室所保存的所有临床分离的耐药菌株进行了I型整合子及其捕获的耐药基因盒的检测,并将所检测到的I型整合子结构、耐药基因序列与其他细菌做一比较,试图分析、探讨I型整合子在鸭疫里默氏菌耐药性产生、传播中的作用,并根据所检测到的耐药基因序列,初步从分子水平上分析该菌耐药性产生的分子机制。
1 材料与方法
1.1 供试菌株 本试验所用22株菌株分离自1999-2005年浙江省各地区鸭场出现典型浆膜炎病变的病死鸭的肝脏、心脏,经纯化培养、生化鉴定、血清型鉴定、药敏试验之后,用于本研究。
1.2 仪器 MJPCR仪(BIO-RAD),凝胶成像系统(BIO-RAD)。
1.3主要试剂 限制性内切酶SphI、Taq DNA聚合酶、pMD18-T载体、琼脂糖凝胶DNA回收试剂盒,均购自上海生工生物工程技术服务有限公司;1kb DNA Marker、100 bp DNAMarker,购自TaKaRa公司。
1.4 PCR法检测I型整合子及耐药基因盒
1.4.1 引物设计与合成 根据GenBank上发表的I型整合酶基因序列、I型整合子的5′和3′端高度保守区的基因序列,利用软件Oligo 6.0设计特异引物。I型整合酶基因扩增引物为:intI1-F:5′-TGATGGCGA CGCACGAC-3′;intI1-R:5′-TTGGGCAGCAGCGAA GT-3′。耐药基因盒扩增引物为:FP:5′-GGCATCC AAGCAGCAAGCGCGTTACGCCGT-3′;RP:5′-AAG CAGACTTGAC-CTGATAGTTTGGCTGTG-3′。上述引物均由北京赛百盛基因技术有限公司合成。
1.4.2 RA基因组提取 从平板上挑取纯化培养的单菌落接种于LB液体培养基中,置于37℃摇床、180 r/min离心振荡培养过夜。取上述培养液1mL置于1.5 mL离心管中,12 000 r/min(室温)离心1min,弃上清,并加入567 uLTEBuffer(pH值8.0)重悬菌体并加入30μL10%SDS、3 uL蛋白酶K(20mg/mL),于37℃水浴中过夜。加入200 uL 3mol/LNaCl,置于65℃水浴中孵育10min。加入等体积的酚:氯仿并抽提两次。加入1/10体积的3mol/LNaAc、2倍体积的无水乙醇,轻柔颠倒混匀,置于-20℃保持30min。用枪头将上述液体中的絮状沉淀勾出,并用70%乙醇洗涤沉淀1次。加入TERnase,37℃水浴内放置30min,得到的产物即可作为PCR反应的模板。
1.4.3 PCR反应体系与反应程序 建立50μLPCR反应体系:DNA Taq酶1.5 U,10×Buffer 5μL,dNTP Mixture4μL,模板5μL,上下游引物各2μL,加ddH2O至总体积50μL。
I型整合酶基因PCR反应程序为:95℃预变性5min,94℃变性45 s,58℃退火45 s,72℃延伸45 s,35个循环后再72℃延伸10min结束反应。
I型整合子耐药基因盒PCR反应程序为:95℃预变性5min,94℃变性1min,62℃退火1min,72℃延伸3min,35个循环后再72℃延伸10min结束反应。取2μL产物点样于1.5%(1.0%)琼脂糖凝胶电泳,用Bio-RAD成像系统观察结果并记录。
1.4.4 I型整合酶基因PCR扩增产物酶切鉴定 利用DNAStar-MapDraw软件,分析intI1基因的酶切位点,对I型整合酶基因的PCR扩增产物进行酶切鉴定。
1.5 PCR产物纯化、克隆、测序与序列分析 PCR产物用琼脂糖凝胶DNA回收试剂盒进行胶回收,回收产物连接到pMD18-T载体,转化至大肠杆菌DH5α感受态,挑取转化子并经Hind III、EcoRI双酶切鉴定、PCR鉴定,筛选出的阳性转化子送北京六合华大基因科技股份有限公司测序,并采用DNA⁃Star、BLAST对测序结果进行分析、比较。
2结果
2.1 I型整合酶检测结果
2.1.1 PCR扩增 22株RA的I型整合酶检测均呈阳性,检出率为100%,产物大小约为580 bp左右,与预期结果相符。琼脂糖凝胶电泳结果见图1。
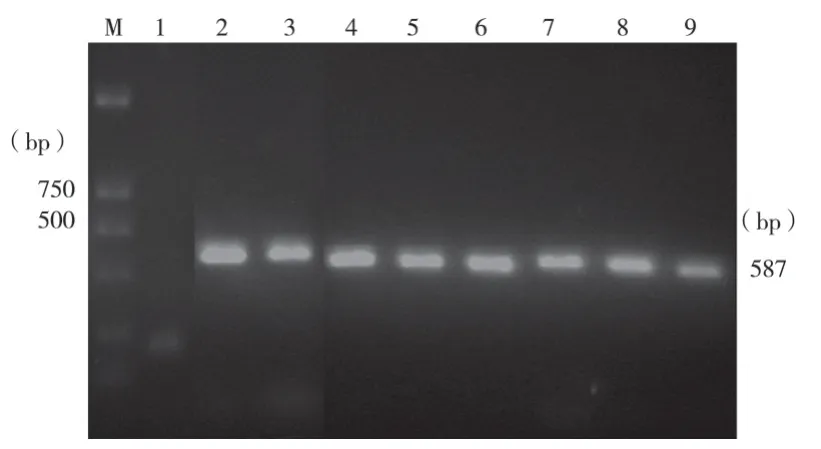
图1 intI1基因PCR扩增产物
2.1.2 酶切鉴定 I型整合酶基因的PCR扩增产物经试剂盒纯化后,以SphI酶切,出现约为320 bp和260 bp左右的两条带,产物大小与预期大小一致。琼脂糖凝胶电泳结果见图2。
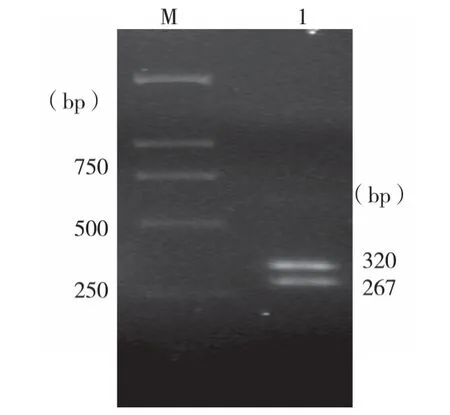
图2 intI1基因PCR产物Sph I酶切鉴定
2.1.3 测序结果 测序结果显示,I型整合酶基因长度为587bp。根据GENBANK中已有的I型整合酶序列,经DNAStar软件、BLAST软件比对,该序列与大肠杆菌(GenBank登陆号AY522431,下同)、肺炎杆菌(AY123253)、摩尔根菌(DQ522239)、沙门菌(AY463797)的同源性均为100%。GenBank登陆号为DQ881442。
2.2 耐药基因盒检测结果
2.2.1 PCR扩增 22株RA的耐药基因盒检测均为阳性。其中,从1株RA中扩增得到大小约为1kb左右的产物,命名为In I-1,检出率为4.5%;从21株RA中扩增得到大小约为2.4 kb左右的产物,命名为In I-2,检出率为95.5%。琼脂糖凝胶电泳结果见图3。
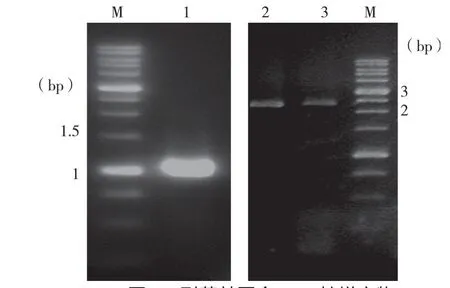
图3 耐药基因盒PCR扩增产物
2.2.2 测序结果与序列分析 产物In I-1和In I-2经纯化、克隆后进行测序,大小分别为1 048 bp和2 352 bp。测序结果通过DNAStar软件与已知序列比较,并登陆GenBank,通过BLAST软件比对。GenBank登陆号分别为EF105289、EF105290。In I-1测序结果:In I-1长度为1 048 bp,与质粒pSp14(GenBank accession no.AY139598)、质 粒pTET3(GenBank accession no.AJ420072)、质粒pLEW279a(GenBank accession no.DQ390458)中检测到的I型整合子结构同源性达到了100%。进一步分析这一整合子序列,发现其中含有一个耐药基因盒aadA5基因。该基因以ATG开头、大小为789 bp,与aa⁃dA5基因(GenBank accession no.DQ838665)99.7%相同,编码核苷转移酶,导致细菌对氨基糖甙类药物产生耐药性。耐药基因aadA5被整合在特异的整合位点aatI和59 be结构之间,是一种整合效率较高的整合,且其aatI、59be以及3′端保守区的序列与沙门菌(GenBank accession no.AY463797)的同源性达到了99%以上。
In I-2测序结果:InI-2长度为2 352 bp,与奇异变形菌(GenBank accession no.AY677093)中检测到的I型整合子结构同源性为99.89%,与沙门菌(GenBank accession no.AJ746361)中检测到的同源性为99.46%。该整合子含有3个开放阅读框(ORF),是3个不同的耐药基因盒。其中,长度为555 bp的ORF与aac 6-II基因(GenBank accession no.DQ402099)有99.5%相同,编码酰基转移酶,引起细菌对氨基糖甙类药物的耐药;长度为633 bp的ORF与cat B3基因(GenBank accession no.DQ343904)有99.7%相同,编码氯霉素乙酰转移酶,介导对氯霉素产生耐药性;长度为792 bp的ORF与aadA1基因(GenBank accession no.AF313472)有99.8%相同,编码核苷转移酶,介导对氨基糖苷类药物的耐药。aac6-II、catB3、aadA1这3个耐药基因之间分别以59 be结构为界,aac6-II基因与整合子的5′端保守区以aatI为界,aadA1基因与整合子的3′端保守区以59be为界。该整合子的5′端保守区、3′端保守区与其他细菌的同源性均达到了100%。
2.2.3 各菌株的耐药表型与所携带耐药基因盒之间的关系 在前期的研究中,我们对本试验中所有供试菌株均开展了相关的耐药表型研究,多重耐药现象十分严重,五耐、六耐菌株所占的比例最大,均占31.8%[3],具体见表1。菌株9携带了能引起对氨基糖苷类药物耐药的aadA5基因盒,在药敏试验中也表现了对丁胺卡那霉素和卡那霉素的耐药性,耐药表型与检测到的耐药基因盒吻合。但是在其他的21株菌中,均检测到携带了aac6-II、catB3、aadA1这3个耐药基因盒,而他们的耐药表型却不尽相同。这些菌株均表现出对氨基糖苷类药物的耐药性,个别菌株对青霉素、四环素、红霉素等也有不同程度的耐受,他们虽都携带了介导氯霉素耐药性的catB3基因盒,却对氯霉素都很敏感,这可能与该基因盒距离启动子较远或启动子较弱不能被正常启动有关。

表1 22株RA的耐药表型与携带耐药基因盒情况
3 讨论与结论
3.1 整合子在细菌多重耐药迅速发展的过程中起到了重要的作用,尤其对革兰阴性菌更为重要[4]。在临床检测中,I型整合子检测阳性频率最高。I型整合子主要由3个部分组成,分别是5′CS、可变区、3′CS,3个主要的功能元件是编码I型整合酶的基因intI1、基因重组位点attI和启动子[5-6],整合子可以捕获耐药基因盒,并利用5′CS端的启动子使耐药基因盒得以表达,导致细菌耐药性的传播[7]。其中I型整合酶是I型整合子的标志性结构,I型整合酶检测为阳性者,内部肯定含有I型整合子的结构,我们的检测结果更加证实了这一理论。
3.2 我们的检测结果显示,I型整合子作为耐药基因传播的重要基因元件,在鸭疫里默氏菌中同样存在,且在本次检测中,阳性率达到了100%。由于I型整合子已经在大肠埃希菌、沙门菌、铜绿假单胞菌、肺炎克雷伯氏菌、不动杆菌等[8]中被检测到并证明是引起这些细菌耐药性产生及广泛传播的重要原因之一,我们可以推测I型整合子与RA的耐药性尤其是多重耐药性的发生与传播有着重要的关系。本次检测的检出率特别高,远高于其他报道中的59%~75%,但是与石磊等[9]自33株临床菌株中的检出率相同,这可能与我们自临床上分离到的菌株的多重耐药性比较严重有关。
3.3 通过对I型整合酶基因的测序结果进行分析,我们发现与其他细菌的该基因同源性达到了100%,可以认为是同一基因,故RA中的I型整合酶基因应该与其他细菌中的功能及作用机理相同或相似。这是首次在该菌中开展对I型整合酶基因的研究并证明其存在。
3.4 通过对耐药基因盒进行扩增并测序,我们发现了aadA5、aac6-II、catB3、aadA1四种不同的耐药基因盒,分别介导对氨基糖苷类药物和氯霉素的耐药,且这4个基因与在其他细菌中所检测到的同源性均在95%以上,属于同一基因。根据这些基因在其他细菌中引起耐药性发生的原理,我们可以推测RA对氨基糖苷类药物、氯霉素产生耐药性的机理与机制与其他细菌相同,这是首次在鸭疫里默氏菌中发现耐药基因的存在,并证明其耐药基因与其他细菌具有很高的同源性。
3.5 分析细菌的耐药谱和所携带的耐药基因盒二者之间的关系,我们发现,细菌的耐药表型与携带的耐药基因盒没有绝对的相关性,携带相同耐药基因盒的菌株所表现出的耐药表型并不完全相同,有的菌株虽然检测到已经捕获了特定的耐药基金盒,但在临床上并未表现对该药的耐受,在其他相关报道中也发现类似结果[10]。这提示我们整合子结构并不是引起细菌多重耐药的惟一原因,还与其他耐药机制有关。而且耐药基因盒的表达强弱也是受多种条件因素控制的,比如启动子的强弱、耐药基因盒与启动子之间的距离等。
通过对鸭疫里默氏菌I型整合子结构的研究,对其中所捕获的耐药基因盒的解析,我们可以根据这些耐药基因序列建立快速的细菌耐药基因盒的检测方法,并为我们研究该菌耐药性的产生机制、传播途径、临床上及时监测该菌的药物敏感性提供一个新途径。整合子结构是细菌耐药性传播的重要机制,耐药基因可以通过该结构在不同的细菌、地区之间进行传播,所以开展细菌整合子的监测工作可以有效的指导临床用药并控制耐药细菌的传播。
[1] Seger P,Mannheim W,VancanneytM,etal.Riemerella anatipest⁃ier gennov,combnov,the causitive agentofsepticemia anserum ex⁃sudativa and itsphylogenetic affiliationwithin the Flavobacterium-Cy top haga rRNA homology group[J].International Journal of Sys⁃tematic Bacteriology,1993,43(4):768-776.
[2]Stokes H W,Hall R M.A novel family of potentially mobile DNA elements encoding site-specific gene-integration functions inte⁃grons[J].MolMicrobiol,1989,3(12):1669-1683.
[3]蔡秀磊,韦强,崔言顺,等.浙江省22株鸭疫里默氏杆菌的血清型鉴定及耐药性研究[J].浙江农业学报,2007,19(1):46-49.
[4]Rowe-Magnus D A,Guerout A M,Mazel D.Bacterial resistance evolution by recmitment of super-integron gene cassettes[J].Mo⁃lecularMicrobiology,2002,43(6):1657-1669.
[5]Hall RM,Stokes H W.Integrons novel DNA elementswhich cap⁃ture genes by site-specific recombination[J].Genetica,1993,90(2-3):115-132.
[6] GoldStein C,Lee M D,SANCHEZ S.Incidence of class 1 and 2 integrases in clinical and commensal bacteria from livestock,com⁃panion animals,and exotics[J].Antimicro Agents Chemother,2001,45(3):723-726.
[7]Brown H J,Stokes H W,Hall R M.The integron In0,In2,and In5 are defective transposon derivatives[J].JBacteriol,1996,178(15):4429-4437.
[8]Flu it A C,Schmitz F J.Resistance integrons and super-integrons[J].Clin Microbiol Infect,2004,10(4):272-288.
[9]石磊,临床致病菌整合子检测及耐药基因盒序列分析[J].中华医学检验杂志,2005,28(11):1204-1210.
[10]Lee M D,Sanchez S,Zimmer M,et al.Class 1 integron associated tobramycin-gentamicin resistance in Campylobaeter jejuni isolated from the broiler chickenhouse environment[J].Antimicrob Agents Chemother,2002,46(11):3660-3664.
