肿瘤坏死因子α增强主动脉环收缩在感染性休克中的机制研究
2014-02-08周莹,刘沛
周 莹,刘 沛
感染性休克是由病原微生物及其毒素或抗原-抗体复合物引起的以急性微循环障碍为主要表现的一组临床综合征。主要血流动力学改变包括低血压、低外周血管阻力、血管对收缩剂反应性下降、血流重新分布等[1],是由肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)、白介素1(IL-1)、血小板活化因子(PAF)、花生四烯酸代谢产物〔前列环素(PG)、白三烯(LT3)、血栓素A2(TXA2)〕、一氧化氮(NO)等多种因子共同作用的结果[2]。多项动物实验证实,TNF-α是引起感染性休克、多器官功能衰竭(MOF)的主要递质[3]。有证据表明TNF-α可通过多种途径间接参与心肌细胞、血管平滑肌细胞(VSMC)和支气管平滑肌细胞的收缩[4]。感染性休克中血流动力学的改变与血管的收缩、舒张能力变化有关,为了探讨TNF-α在感染性休克血管收缩性变化中的作用,本实验试图在器官及细胞水平上应用TNF-α预处理离体去内皮主动脉环,观察其在血管紧张素Ⅱ(AngⅡ)作用下的收缩反应,并分离培养VSMC,经TNF-α预处理后观察细胞内游离钙离子浓度([Ca2+]i)的变化,探讨TNF-α影响VSMC功能的机制。
1 材料与方法
1.1 材料 雄性Wistar大鼠60只(中国医科大学实验动物中心),体质量200~250 g;乙酰甲酯(Fluo-3/AM)、AngⅡ、乙酰胆碱(Sigma公司);TNF-α(R&D公司);2-氨基乙氧基联苯硼酸盐(2-APB,Merck公司);兔抗α-肌动蛋白单克隆抗体、TRITC标记山羊抗兔IgG抗体(北京中山生物技术有限公司);DMEM培养液、标准胎牛血清(Gibco公司);25 cm2培养瓶、3.5 cm薄底平皿(Corning公司);乙二醇二乙醚二胺四乙酸(EGTA)、TritonX-100、氯化钙(CaCl2)等化学试剂(中国医药集团上海化学试剂公司)。
张力传导放大器(TB-611T,Nihon Kohden公司);激光共聚焦显微镜及LSM510软件(德国Carl Zeiss公司)。实验时间为2012年3—6月,地点为中国医科大学中心实验室。
1.2 方法
1.2.1 离体主动脉环制备及反应性测定
1.2.1.1 离体主动脉环制备 选取24只Wistar大鼠,采用45%乌拉坦和5%氯醛糖混合液1 ml腹腔注射使大鼠致死,开胸取胸主动脉置于通有95%氧气(O2)和5%二氧化碳(CO2)的Kreb液中,分离周围的脂肪和结缔组织后剪成数个长3~5 mm的主动脉环,用内皮摩擦法去除内皮。将制备好的主动脉环垂直悬挂于装有Kreb液的浴槽中(pH 7.4,以95%O2和5%CO2的混合气持续通气),基础张力1.2 g平衡45 min(每隔15 min换液),给予40 mmol/L氯化钾(KCl)使主动脉环收缩,收缩幅度>0.6 g。在收缩顶峰时给予10-6mol/L乙酰胆碱(检验有无内皮,如舒张幅度大于30%认为内皮完整,如无舒张则为去内皮),无舒张的标本留用。留用标本冲洗后重复给予40 mmol/L KCl直至前后连续2次得到的收缩幅度之差小于0.1 g的标本进行下一步实验。
1.2.1.2 实验分组和给药 留用的主动脉环在给予KCl后每隔15 min换液1次,平衡30 min后随机分为4组:去内皮对照组(浴槽液为Kreb液)、去内皮TNF-α组(浴槽液为含5 μg/L TNF-α的Kreb液)、去内皮无钙对照组(浴槽液为无钙的Kreb液)和去内皮无钙TNF-α组(浴槽液为含5 μg /L TNF-α的无钙的Kreb液),每组6只。各组主动脉环在孵育1 h后给予10-7mol/L(终浓度)AngⅡ,记录收缩幅度。
1.2.2 原代培养VSMC及其内[Ca2+]i测定
1.2.2.1 改进的原代VSMC培养及鉴定 参照Chamley-Campbell等[5]归纳的VSMC培养方法。无菌取出3只Wistar大鼠胸主动脉,用0.9%氯化钠注射液冲洗5遍。剥去外膜,纵向剖开血管。用0.25%胰蛋白酶室温消化内膜2~3 min,加入2~3 ml含20%胎牛血清的DMEM终止消化。然后刮去内膜,将留下的中膜切成1 mm2大小的组织碎块,间隔0.5 cm置于培养瓶内,置37 ℃ 5%CO2孵箱中2~4 h,加入5 ml含20%胎牛血清的DMEM培养。3~7 d可见组织块边缘出现新生细胞,细胞生长融合后传代。在光镜下进行形态鉴定,用抗α-肌动蛋白抗体荧光染色鉴定细胞及纯度。
1.2.2.2 VSMC的准备及分组 把生长稳定的第4~12代VSMC随机分为对照组(正常细胞30个)、TNF-α组(加入TNF-α后孵育8 h的细胞27个);另设上述2组于加AngⅡ前10 min加入2-APB,即2-APB拮抗对照组和2-APB拮抗TNF-α组,各30个细胞。预实验2-APB浓度为20、40、80、100 μmol/L,本实验采用具有完全阻断效应的最低浓度40 μmol/L。
1.2.2.3 VSMC内[Ca2+]i测定[6]培养液中加入Fluo-3/AM(终浓度为5 μmol/L),37 ℃CO2培养箱中避光负载45 min,Hank′s液洗去细胞外液中残余的Fluo-3/AM,加无钙D-Hank′s缓冲液1 ml后,采用confocal显微镜测定单个活细胞内Ca2+荧光强度(发射波长505 nm,激发波长488 nm)。测定基础值(静息时)后,依次加入AngⅡ(终浓度10-7mol/L)、CaCl2(原液为1 mol/L,加入D-Hank′s至过量)、TritonX-100(终浓度1%)、EGTA(终浓度10 μmol/L)。动态观察细胞内Ca2+释放引起的钙荧光强度(FI)的变化。采用LSM510软件对数据、图形进行实时动态测量与分析,根据给药(AngⅡ)前后单个细胞的FI值计算出细胞内[Ca2+]i,公式如下:[Ca2+]i(nmol/L)=kd×(F-Fmin)/(Fman-F)。kd 为Fluo-3/AM与Ca2+结合反应的解离参数,室温下kd=320 nmol/L;F为实际测得的FI值;Fmin为加入EGTA将细胞内Ca2+全部螯合,使细胞内无Ca2+时的FI值;Fmax为加入CaCl2、TritonX-100细胞内Ca2+饱和时的FI值。
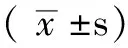
2 结果
2.1 TNF-α对主动脉环收缩功能的影响 有钙条件下,去内皮TNF-α组给予AngⅡ后主动脉环的收缩幅度高于去内皮对照组;无钙条件下,去内皮无钙TNF-α组给予AngⅡ后主动脉环的收缩幅度亦高于去内皮无钙对照组,差异均有统计学意义(P<0.05,见表1)。
2.2 VSMC鉴定 VSMC细胞呈长梭形,胞质多有突起,核呈圆形、卵圆形。细胞可出现重叠生长现象,光镜下观察呈峰谷样生长;免疫荧光抗α-肌动蛋白抗体染色阳性,沿细胞长轴与肌丝相同呈丝状排列,阳性细胞占总细胞数的95%以上,表明所获细胞为VSMC,纯度可达95%以上,电镜下可见细胞内束状肌丝结构(见图1)。
表1 有钙条件和无钙条件下各组主动脉环对AngⅡ的反应性
Table1 In Ca2+-present and Ca2+-free Kreb buffer,the reactiveness of aorta ring induced by AngⅡ in different groups

组别只数主动脉环对AngⅡ的反应性平均值(x±s)有钙条件下 去内皮对照组6014015044021024028024±011 去内皮TNF-α组6030025045069087060053±024∗无钙条件下 去内皮无钙对照组6015000015002004021010±008 去内皮无钙TNF-α组6021014023014015024019±005△
注:与去内皮对照组比较,*t=-2.645,P=0.025;与去内皮无钙对照组比较,△t=-2.35,P=0.047

注:A为新生VSMC(×200),B为传代VSMC(×400),C为α-肌动蛋白抗体荧光染色(×100),D为光镜下细胞内的肌丝结构(×10 000)
图1 VSMC细胞鉴定结果
Figure1 Identification result of VSMC
2.3 VSMC内[Ca2+]i测定 4组VSMC静息状态下[Ca2+]i无自主上升,在无钙缓冲液中,静息状态下4组VSMC内[Ca2+]i间差异无统计学意义(P>0.05)。加入AngⅡ后,4组[Ca2+]i升高值间差异有统计学意义(P<0.05);其中TNF-α组VSMC内[Ca2+]i均高于其他3组,差异有统计学意义(P<0.05);而2-APB拮抗对照组、2-APB拮抗TNF-α组VSMC内[Ca2+]i间差异无统计学意义(P>0.05,见表2)。测钙图见图2。
3 讨论
许多学者认为在感染性休克时由感染促发的全身炎性反应为介导的二次打击对器官的损害比原发感染作用更大,常造成血流动力学的紊乱和器官功能衰竭。TNF-α被公认为是引起感染性休克、MOF的主要递质。Hollenberg等[7]应用主动脉环实验证实大剂量TNF-α(1 000 U/ml)不仅作用于血管内皮,也可直接作用于血管平滑肌,导致血管舒张,对收缩剂反应性下降,但其所采用的TNF-α剂量明显高于临床报道范围(200~800 mg/ml,相当于10~40 U/ml),而Murphey等[8]在注射脂多糖(LPS)前给猪注射小剂量TNF-α(500 ng/kg),发现可以降低死亡率并减轻低血压的程度,提示小剂量TNF-α具有保护作用。说明TNF-α作为一种多效性的细胞因子,其效应有害或有利于机体主要取决于产生的数量、组织特异性定位、局部TNF-α结合蛋白的活性及细胞因子的环境等[9]。有报道指出,在失血性休克时,VSMC内[Ca2+]i的调节能力紊乱可能是造成休克的原因[10];一些治疗休克的药物作用靶点也是调节VSMC内[Ca2+]i[11]。本实验应用的去内皮主动脉环的反应性变化代表了VSMC的舒缩状态,VSMC的收缩受AngⅡ等多种血管活性物质调节,后者与细胞膜上相应受体结合,激活磷脂酶C的β亚型,催化质膜磷脂酰肌醇二磷酸水解,生成三磷酸肌醇(IP3)和甘油二酯。IP3与1,4,5-三磷酸肌醇受体(IP3Rs)结合促进内质网储备Ca2+释放引起细胞收缩。细胞内[Ca2+]i变化能反映VSMC的功能状态,因此监测细胞内[Ca2+]i变化能反映细胞的舒缩状态。而Fluo-3/AM是常用的钙荧光指示剂,其与细胞内游离钙呈高度特异性结合,其FI值与[Ca2+]i呈正比。细胞内Ca2+来源于细胞外Ca2+内流和胞内钙库的钙释放[12]。而IP3Rs及RYR受体是主要的细胞内储备Ca2+释放通道,在VSMC内主要受IP3Rs调控,这一点可被2-APB阻断Ca2+释放实验来证明。

注:A为对照组,B为TNF-α组,C为2-APB拮抗TNF-α组
图2 各组VSMC在AngⅡ刺激下细胞内FI的时间变化曲线
Figure2 AngⅡ-induced VSMC intracellular calcium fluorescence intensity(FI)-time curves in different groups

表2 AngⅡ刺激下4组VSMC内[Ca2+]i比较
注:与TNF-α组比较,*P<0.001
本实验结果显示:(1)与对照组比较,在有钙条件下加入5 g/L TNF-α能使去内皮主动脉环对AngⅡ的反应性升高;在无钙条件下加入5 g/L TNF-α仍能使去内皮主动脉环对AngⅡ的反应性升高,提示主动脉环对AngⅡ的反应性升高与细胞内钙释放有关。(2)对照组、TNF-α组、2-APB拮抗对照组和2-APB拮抗TNF-α组VSMC静息状态下[Ca2+]i间无差异,而加入AngⅡ后,对照组和TNF-α组VSMC在短时间内(约20 s)FI迅速增加(即峰值升高相),TNF-α组[Ca2+]i升高值显著高于对照组,说明TNF-α能促进VSMC内储备钙释放,与Song等[13]在实验中发现感染性休克大鼠VSMC内[Ca2+]i明显增加的结果一致。由于胞外液无钙,胞内钙储库排空后得不到再充盈,FI并未出现缓慢持久升高;当向细胞外液加入过量的CaCl2时两组细胞均出现钙饱和状态且Fmax一致,提示两组细胞的Fluo-3/AM负载水平及活性无差异。在加入2-APB后,2-APB拮抗对照组和2-APB拮抗TNF-α组VSMC此效应均可被40 μmol/L的2-APB完全阻断,表现为对AngⅡ刺激无反应,[Ca2+]i升高值无差异。故TNF-α 间接影响细胞内[Ca2+]i是通过IP3Rs通路起作用的。
总之,TNF-α通过IP3Rs通路增强VSMC内钙释放,能够使主动脉环对缩血管物质的反应性增强,这条信号通路与TNF-α促进核因子-κB受体活化因子配体-RANKL诱导小鼠骨髓巨噬细胞破骨细胞形成与分化的信号通路以及TNF-α调节神经元突触内钙信号的通路是一致的[14-15],这也许是感染性休克早期机体维持血压稳定的机制之一。进一步推测TNF-α在休克早期促进细胞内储备钙大量释放使细胞内钙耗竭,可能是导致休克晚期血管收缩性下降难以维持血压的原因之一,进一步明确这一信号通路及其下游调控机制是未来的研究方向。
1 冯刚,蒋健,史以珏,等.内毒素休克时低血压发病机制的探讨[J].中国危重急救杂志,1999,11(8):494-495.
2 Fahey TJ 3rd,Yoshioka T,Shires GT,et al.The role of tumor necrosis factor and nitric oxide in the acute cardiovascular response to endotoxin[J].Ann Surg,1996,223(1):63-69.
3 Hu J,Wang Y,Wei X,et al.Synthesis and biological evaluation of novel thiazolidinone derivatives as potential anti-inflammatory agents[J].Eur J Med Chem,2013,64:292-301.
4 Suski M,Gebska A,Olszanecki R,et al.Influence of atorvastatin on angiotensin I metabolism in resting and TNF-α-activated rat vascular smooth musclecells[J].J Renin Angiotensin Aldosterone Syst,2013.[Epub ahead of print].
5 Chamley-Campbell J,Campbell GR,Ross R.The smooth muscle cell in culture[J].Physiol Rev,1979,59(1):1-61.
6 Kekenes-Huskey PM,Cheng Y,Hake JE,et al.Modeling effects of L-type ca(2+) current and na(+)-ca(2+) exchanger on ca(2+) trigger flux in rabbit myocytes with realistic T-tubule geometries[J].Front Physiol,2012,3:351.
7 Hollenberg SM,Cunnion RE,Parrillo JE.The effect of tumor necrosis factor on vascular smooth muscle.In vitro studies using rat aortic rings[J].Chest,1991,100(4):1133-1137.
8 Murphey ED,Traber DL.Pretreatment with tumor necrosis factor-alpha attenuates arterial hypotension and mortality induced by endotoxin in pigs[J].Crit Care Med,2000,28(6):2015-2021.
9 Guo Z,Wang S,Jiao Q,et al.Soluble TNFR II/IgG1 Fc fusion protein treatment in the LPS-mediated septic shock of rats[J].Biomed Pharmacother,2009,63(7):537-542.
10 Kai L,Wang ZF,Shi YL,et al.Opioid receptor antagonists increase [Ca2+]i in rat arterial smooth muscle cells in hemorrhagic shock [J].Acta Pharmacol Sin,2004,25(3):395-400.
11 Zhao KS,Jin C,Huang X,et al.The mechanism of Polydatin in shock treatment[J].Clin Hemorheol Microcirc,2003,29(3/4):211-217.
12 Rivera L,Brading AF.The role of Ca2+influx and intracellular Ca2+release in the muscarinic-mediated contraction of mammalian urinary bladder smooth muscle[J].BJU Int,2006,98(4):868-875.
13 Song SK,Karl IE,Ackerman JJ,et al.Increased intracellular Ca2+:a critical link in the pathophysiology of sepsis?[J].Proc Natl Acad Sci U S A,1993,90(9):3933-3937.
14 Xia L,Zhang D,Wang C,et al.PC-PLC is involved in osteoclastogenesis induced by TNF-α through upregulating IP3R1 expression[J].FEBS Lett,2012,586(19):3341-3348.
15 Park KM,Yule DI,Bowers WJ.Tumor necrosis factor-alpha potentiates intraneuronal Ca2+signaling via regulation of the inositol 1,4,5-trisphosphate receptor[J].J Biol Chem,2008,283(48):33069-33079.
