无糖尿病病史的体检者糖化血红蛋白与颈动脉内-中膜厚度及动脉粥样硬化的相关性研究
2014-02-08王亚珍郝志华宋光耀王丽红焦丽娜
李 岩,王亚珍,郝志华,宋光耀,王丽红,焦丽娜
糖化血红蛋白(HbA1c)是血红蛋白与葡萄糖游离醛基间发生的非酶缩合反应,能宏观反映受检者近2~3个月的平均血糖水平。HbA1c作为糖尿病的筛选、诊断及血糖控制效果评价的有效检测指标,在临床中得到了广泛应用。颈动脉内-中膜厚度(IMT)的增加和/或粥样斑块的形成已成为判断动脉粥样硬化(AS)的有效指标,是高血压、冠心病、糖尿病等心脑血管疾病的独立高危因素。本研究旨在探讨本地区无糖尿病病史的体检者HbA1c与颈动脉IMT、AS的相关性。
1 资料与方法
1.1 临床资料 选取2012年9月—2013年6月河北省人民医院体检中心的体检者4 954例,剔除既往有糖尿病病史者454例,最终入选4 500例。其中男2 133例,女2 367例;年龄46~78岁,平均(62.5±4.7)岁。
1.2 方法 对所有体检者进行体格检查、实验室检查及颈动脉超声检查。
1.2.1 体格检查 包括测量身高、体质量、血压等,计算体质指数(BMI)。
1.2.2 实验室检查 空腹抽血,采用高压液相色谱法测定HbA1c水平;使用自动生化仪检测空腹血糖(FPG)和血脂〔总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)〕。再按HbA1c水平和FPG水平将患者分别分为5个亚组:HbA1c≤5.0%为Hb1组(1 223例),HbA1c5.1%~6.0%为Hb2组(1 191例),HbA1c6.1%~7.0%为Hb3组(883例),HbA1c7.1%~8.0%为Hb4组(650例),HbA1c>8.0%为Hb5组(553例);FPG≤5.5 mmol/L为FP1组(1 347例),FPG 5.6~6.0 mmol/L为FP2组(1 077例),FPG 6.1~7.0 mmol/L为FP3组(818例),FPG 7.1~8.0 mmol/L为FP4组(657例),FPG>8.0 mmol/L为FP5组(601例)。
1.2.3 颈动脉超声检查 采用Seimens S2000彩色超声诊断仪,高频线阵探头,频率3~15 MHz,对颈动脉的IMT及斑块进行测量。选择颈总动脉远端近分叉处1 cm处后壁测量颈动脉IMT,取双侧平均值作为颈总动脉IMT,并观察有无斑块形成。颈动脉粥样硬化斑块的测量在可显示最大厚度的长轴切面进行并计算斑块评分。
1.3 诊断标准
1.3.1 IMT增厚的诊断标准 颈总动脉干处IMT≥1.0 mm,分叉处IMT≥1.2 mm确定为增厚。
1.3.2 斑块的诊断标准 局限性IMT增厚凸入动脉管腔至少0.5 mm,或较周围IMT增加超过50%,或IMT超过1.5 mm[1]。
1.3.3 AS的诊断标准 诊断符合中华医学会第四届全国脑血管病学术会议(1995年)修订的《各类脑血管疾病诊断要点》[2],并经超声测定IMT增厚及斑块形成所证实。
1.3.4 斑块评分标准 无斑块为0分;斑块1个,厚度<2.0 mm为1分;斑块1个,厚度2.0~4.0 mm或多个斑块,厚度<2.0 mm为2分;斑块1个,厚度>4.0 mm或多个斑块,厚度2.0~4.0 mm为3分。
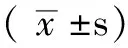
2 结果
2.1 HbA1c不同水平组体检者临床资料比较 HbA1c不同水平组体检者的年龄、BMI、FPG、TC、LDL-C、IMT、斑块评分比较,差异均有统计学意义(P<0.05);组间两两比较:Hb2组年龄、LDL-C高于Hb1组而IMT低于Hb1组;Hb3组年龄、FPG、TC高于Hb1组和Hb2组,BMI、IMT、斑块积分高于Hb2组,但LDL-C低于Hb2组;Hb4组年龄、FPG、IMT、斑块积分均高于Hb1组、Hb2组、Hb3组,TC、LDL-C高于Hb1组和Hb2组,BMI高于Hb2组;Hb5组年龄高于Hb1组和Hb2组但低于Hb3组和Hb4组,FPG、IMT、斑块评分高于其他4组,LDL-C高于Hb1组、Hb2组和Hb3组,BMI、TC高于Hb1组和Hb2组,差异均有统计学意义(P<0.05);各组TG、HDL-C比较,差异无统计学意义(P>0.05,见表1)。
2.2 FPG不同水平组体检者临床资料比较 FPG不同水平组体检者的年龄、BMI、HbA1c、TC、TG、HDL-C、LDL-C、IMT、斑块评分比较,差异均有统计学意义(P<0.05);组间两两比较:FP2组年龄、BMI、TC、TG、LDL-C、斑块积分高于FP1组;FP3组年龄、BMI、HbA1c、TG、LDL-C、IMT、斑块积分高于FP1组和FP2组,而HDL-C低于FP1组和FP2组,TC高于FP1组;FP4组年龄、IMT、斑块评分高于FP1组、FP2组和FP3组,BMI、TG高于FP1组和FP2组,HDL-C低于FP1组和FP2组,LDL-C低于FP2组和FP3组;FP5组年龄高于FP1组、FP2组、FP3组但低于FP4组,HbA1c、TC、IMT、斑块评分高于其他4组,BMI高于FP1组和FP2组,TG高于FP1组、FP2组和FP3组,HDL-C低于FP1组和FP2组,LDL-C高于FP1组和FP4组但低于FP3组,差异有统计学意义(P<0.05,见表2)。
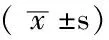
表1 HbA1c不同水平组体检者临床资料比较
注:BMI=体质指数,FPG=空腹血糖,TC=总胆固醇,TG=三酰甘油,HDL-C=高密度脂蛋白胆固醇,LDL-C=低密度脂蛋白胆固醇,IMT=内-中膜厚度;与Hb1组比较,*P<0.05;与Hb2组比较,△P<0.05;与Hb3组比较,▲P<0.05;与Hb4组比较,☆P<0.05
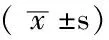
表2 FPG不同水平组体检者临床资料比较
注:HbA1c=糖化血红蛋白;与FP1组比较,*P<0.05;与FP2组比较,△P<0.05;与FP3组比较,▲P<0.05;与FP4组比较,☆P<0.05
2.3 相关性分析 结果显示,IMT与HbA1c、FPG、BMI均呈正相关(r值分别为0.421、0.315、0.378,均P<0.05)。
2.4 HbA1c不同水平组及FPG不同水平组AS患病率比较 HbA1c不同水平组及FPG不同水平组AS患病率比较,差异均有统计学意义(P<0.05);其中Hb2组AS患病率低于Hb1组,然后随着HbA1c水平的逐步升高,AS患病率也逐步升高;FP3组AS患病率低于FP1组,FP4、FP5组AS患病率高于FP1、FP2、FP3组,差异有统计学意义(P<0.005,见表3)。
表3 HbA1c不同水平组和FPG不同水平组体检者AS患病率比较 〔n(%)〕
Table3 Comparison of AS prevalence among groups with different HbA1clevels and among groups with different FPG levels

HbA1c分组例数患病率FPG分组例数患病率Hb1组1223465(3802)FP1组1347527(3912)Hb2组1191384(3224)∗FP2组1077390(3621)Hb3组 883490(5549)∗△FP3组 818259(3166)∗Hb4组 650452(6954)∗△▲FP4组 657339(5160)∗△▲Hb5组 553376(6799)∗△▲☆FP5组 601327(5441)∗△▲χ2值39637χ2值10109P值<001P值<001
注:与Hb1组、FP1组比较,*P<0.005;与Hb2组、FP2组比较,△P<0.005;与Hb3组、FP3组比较,▲P<0.005;与Hb4组、FP4组比较,☆P<0.005
3 讨论
2型糖尿病(T2DM)是目前最常见的代谢性疾病,且患病率不断提高。根据河北省疾病预防控制中心的调查数据,目前我省T2DM患病人数为600多万人,以中老年尤甚,在部分病程较短甚至刚确诊的T2DM患者中,可发现不同程度的AS,但AS病变常无任何症状,可仅表现为大血管IMT增加和/或血管内动脉粥样硬化斑块形成,是亚临床AS的重要表现之一[3]。HbA1c是血液中的葡萄糖游离醛基与血红蛋白游离氨基间的非酶缩合产物,血糖水平是其含量发生波动的因素之一。由于红细胞在血液循环中的寿命约为120 d,因此检测HbA1c可以反映近2~3个月的平均血糖水平,且不受抽血时间、饮食、用药等情况的影响,为中长期血糖水平指标,目前已成为临床评价糖尿病血糖控制效果的金指标[4-6]。既往的前瞻性流行病学研究结果提示,HbA1c水平能预测未来发生糖尿病[7]、心血管事件或心血管死亡的危险性[8-10]。此外,HbA1c可直接反映体内终末糖基化产物(AGE)水平,大量AGE堆积于血管壁引起血管结构改变和功能障碍,并通过促进分泌细胞因子,促进动脉硬化、血凝异常及血栓形成。AGE普遍存在于糖尿病患者的血管系统内,对AS病程的进展起着十分重要的作用[11]。在本研究人群中,随着HbA1c水平不同程度的提高,FPG、IMT、斑块评分也随之升高,体检者发生AS的危险性增加。且相关分析显示IMT与HbA1c水平呈正相关。
高血糖是糖尿病大血管病变的另一个重要危险因素。长期的高血糖可能影响一氧化氮/内皮素系统、氧化应激、激活凝血酶原、增加内皮细胞间黏附性以及细胞因子分泌,从而使血管收缩和通透性增加、机体抗血栓能力下降、血栓形成、血管内膜-中层增殖变厚,泡沫细胞堆积逐渐形成动脉粥样硬化斑块[12]。持续高血糖对血管的损害是全身性、广泛性、多部位的,其对大、中血管和微小血管病变均起一定作用。在本研究人群中,随着FPG水平的提高,受检者IMT、斑块评分也随之升高,FP3组HbA1c高于FP1组和FP2组,FP5组HbA1c均高于其他4组,且相关分析显示IMT与FPG水平呈正相关。因此,可以通过检测IMT来了解受检者的心脑血管高危状态,通过对血糖水平的良好控制来改善血管病变,进而降低发生心脑血管病的风险。
本研究同时也观察到HbA1c不同水平组(除外TG和HDL-C)和FPG不同水平组TC、TG、HDL-C、LDL-C水平间有差异。糖尿病患者持续高血糖严重影响体内脂质代谢,表现为TC、TG、LDL-C升高,HDL-C降低,从而进一步加速斑块形成。高TC可促进膜磷脂释放花生四烯酸,使血浆血栓素A2(TXA2)增高,加速血栓形成[13]。高TG抑制纤溶系统,降低HDL-C,增加子颗粒LDL-C参与AS形成,LDL-C增加亦促发AS。HDL-C被认为是一种抗AS的脂蛋白,其水平升高则AS的发生率减少[3]。
此外,本研究还发现在无糖尿病病史的体检者中,随着HbA1c、FPG的升高,BMI也有升高的趋势。有文献报道,糖代谢异常尤其是T2DM的易患因素之一是肥胖。肥胖人群中糖尿病患病率远高于非肥胖者。BMI是反映肥胖的人体测量指标之一。有研究发现,肥胖者患糖尿病的发生率在6.8%~100.0%。随着肥胖的加重和持续时间的延长,糖尿病发病率不断升高,中等程度肥胖者糖尿病发病率是体质量正常者的4倍,而高度肥胖者为正常人的21倍[14]。而且,本研究发现IMT与BMI呈正相关,其机制可能为:(1)脂肪因子改变,研究证实脂肪是重要的内分泌器官,能分泌多种脂肪因子、炎性因子、血管活性物质及游离脂肪酸,这些因子通过旁分泌或自分泌作用于心血管系统;(2)肥胖加重胰岛素抵抗,腹型肥胖易导致内脏脂肪分解,产生的游离脂肪酸易在肝和肌肉酯化,形成脂质异位沉积,产生胰岛素抵抗[15]。
国内外已有较多研究证实,颈动脉粥样硬化的程度可作为反映冠状动脉及全身AS的一项指标。颈部血管位置浅表,易于观察,可以作为观察大血管粥样硬化的窗口,而颈动脉IMT与颈动脉粥样硬化程度呈正相关[16],是对心血管疾病评估的有效方法和指标[17]。本研究结果显示,IMT随HbA1c、FPG水平的升高而逐渐升高,因此对颈动脉IMT的超声监测有重要意义。
总之,在无糖尿病病史的体检者中,IMT与HbA1c、FPG及BMI水平呈正相关。因此,可以通过对HbA1c、FPG水平的良好控制来改善血管病变,进而降低发生心脑血管病的风险,可以通过检测IMT来了解糖尿病患者的心脑血管高危状态,早期发现和评价糖尿病患者的AS程度[18]。彩色多普勒超声不仅能够较为准确地反映斑块的形态和性质,而且可以判断颈部动脉狭窄的严重程度和范围,已成为早期诊断AS和选择治疗方案的重要检查手段。
1 Touboul PJ,Hennerici MG,Meairs S,et al.Mannheim carotid intima-thickness consensus(2004—2006).An update on behalf of the Advisory Board of the 3th and 4th Watching the Risk Symposium,13th and 15th European Stroke Conferences,Mannheim,Germany,2004,and Brussels,Belgium,2006[J].Cerebrovas Dis,2007,23(1):75-80.
2 中华神经学会,中华神经外科学会.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,29(6):379-380.
3 Chambless LE,Folson AR,Davis V,et al.Risk factors for progression of common carotid atherosclerosis:the Atherosclerosis Risk in Communities Study,1987-1988[J].Am J Epidemiol,2002,155(1):38-47.
4 周翔海,纪立农.空腹血糖和糖化血红蛋白用于筛查糖尿病的研究[J].中华糖尿病杂志,2005,13(3):203-205.
5 张震,李军,李思源,等.糖化血红蛋白在筛查和诊断糖尿病中的价值研究[J].中国全科医学,2013,16(5):1590-1592.
6 周红坚,周圆媛,周雪坚,等.糖化血红蛋白在老年高血糖人群中筛查价值的临床观察 [J].中国临床医生,2013,41(3):51.
7 Ko GT,Chan JC,Tsang LW,et al.Combined use of fasting plasma glucose and HbA1cpredicts the progression to diabetes in Chinese subjects[J].Diabetes Care,2000,23(12):1770-1773.
8 Levitan EB,Song Y,Ford ES,et al.Is nondiabetic hyperglycemia a risk factor for cardiovascular disease?A meta-analysis of prospective studies[J].Arch Intern Med,2004,164(19):2147-2155.
9 Selvin E,Coresh J,Golden SH,et al.Glycemic control and coronary heart disease risk in persons with and without diabetes:the atherosclerosis risk in communities study[J].Arch Intern Med,2005,165(16):1910-1916.
10 郑雪芹,杨志彩,王树玲.冠心病患者糖化血红蛋白水平与冠状动脉病变程度的相关性研究[J].中国全科医学,2013,16(8):2691-2693.
11 Goldin A,Beckman JA,Schmidt AM,et al.Advanced glycationend products:sparking the development of diabetic vascular injury[J].Circulation,2006,114(6):597-605.
12 Wang TJ,Larson MG,Levy D,et al.Impact of obesity on plasma natriuretic peptide levels[J].Circulation,2004,109(5):594-600.
13 杨丽萍.血脂与急性脑梗塞的关系探讨[J].临床医药实践杂志,2005,14(1):39.
14 顾景范,杜寿玢,郭长江.现代临床营养[M].北京:科学出版社,2009:505-543.
15 衡先培,黄国良,修玲玲.糖尿病大血管病变[M].北京:人民卫生出版社,2011:46-49.
16 刘文星,王晓军,徐丽梅,等.不同血糖水平人群C反应蛋白与颈动脉硬化的关系[J].广东医学,2008,29(10):1670-1671.
17 Hodis HN,Mack WJ,LaBree L,et al.The role of carotid arterial intima-media thickness in preducting clinical coronary events[J].Ann Intern Med,1998,128(4):262-269.
18 Steinvil A,Sadeh B,Arbel Y,et al.Prevalence and predictors of concomitant carotid and coronary artery atherosclerotic disease[J].J Am Coll Cardiol,2011,57(7):779-783.
