褪黑素对睡眠剥夺大鼠胃黏膜损伤的保护作用*
2013-11-21闫昱博董开源刘芳娥
韩 俊,王 彬,马 珂,闫昱博,董开源,刘芳娥
1)第四军医大学药学系 西安710032 2)第四军医大学航空航天医学系 西安710032 3)第四军医大学基础部教学实验中心 西安 710032
睡眠不足在当今处于重大工作压力下的人群中很常见。睡眠不足可引起机体代谢紊乱,由此出现一系列健康问题。因此,研究睡眠剥夺对机体的不良影响及其防治措施很有意义。实验[1-2]表明,睡眠剥夺作为一种强烈应激源,对机体造成多方面负面影响,令动物或人产生疲劳、学习记忆受损和行为改变,还可以对机体的血液循环系统、内脏器官和中枢神经系统产生很大危害。还有研究[3]表明,应激可引起胃黏膜损伤从而引起消化系统的功能障碍。具有抗氧化特性的褪黑素可以在应激导致的机体损伤中起保护作用[4]。但是,褪黑素对应激引起的胃黏膜损伤的保护作用机制尚不清楚,其相关报道较少。作者研究了褪黑素对睡眠剥夺大鼠胃黏膜损伤的影响及可能的作用机制,为睡眠剥夺引起的胃黏膜损伤的防治提供理论依据。
1 材料与方法
1.1动物、试剂及仪器成年、雄性、健康SD大鼠24只,体质量(180±15) g(第四军医大学实验动物中心提供)。褪黑素(Sigma公司,使用前需少量乙醇助溶,以生理盐水配制成所需浓度,终溶液中乙醇体积分数<5%),丙二醛(malondialdehyde,MDA)、还原型谷胱甘肽(reduced glutathione hormone,GSH)和前列腺素E2(prostaglandin E2,PGE2)试剂盒(南京建成生物工程研究所)。睡眠剥夺装置、离心机、721分光光度计、恒温水浴箱等。
1.2实验分组将24只大鼠采用随机数字表法分为3组,每组8只。分别为在大平台上不剥夺睡眠并注射生理盐水的对照组,睡眠剥夺并注射生理盐水的模型组,睡眠剥夺并注射褪黑素的实验组。对照组和模型组于每日19: 00腹腔注射2 mL生理盐水,实验组腹腔注射15 mg/kg褪黑素2 mL,连续7 d。然后进行睡眠剥夺3 d,期间依然按分组每日给药。
1.3睡眠剥夺模型的建立采用小平台水环境法[5]建立大鼠睡眠剥夺模型。制作30 cm×30 cm×30 cm的鼠箱,其中有4个高8.0 cm、直径6.3 cm的圆形平台,在平台周边注满水,水面低于平台面约1.0 cm。水温保持在20 ℃左右。大鼠在平台上可自行进食、饮水但不可睡眠。若其睡眠,则肌肉
张力松弛而落入水中,只能恢复清醒再爬上平台,如此反复则为睡眠剥夺。睡眠剥夺前,在给予大鼠褪黑素或生理盐水腹腔注射时,将各组大鼠放在没有注水的睡眠剥夺箱内,让其熟悉睡眠剥夺环境7 d。然后对模型组和实验组大鼠进行睡眠剥夺72 h,对照组大鼠也置于相同的睡眠剥夺箱中,但是大鼠站立的平台直径为16 cm,大鼠在平台上可以自由睡眠。大鼠活动空间内持续40 W日光灯照射,室内温度控制在18~22 ℃。
1.4标本采集取上述各组睡眠剥夺结束后的大鼠立即进行眼球后静脉丛取血并分离血清,然后沿剑突下正中剪开腹壁,暴露鼠胃,切下全胃,沿大弯侧剪开胃壁,用生理盐水冲洗干净待检。
1.5血清GSH、PGE2、MDA含量及胃黏膜损伤指数的测定取血清后,严格按照试剂盒说明书进行操作,测量血清中GSH、PGE2及MDA含量。胃黏膜损伤指数的评定:胃黏膜损伤长度<1 mm为1分,1~ mm为2分,2~ mm为3分, 3~ mm为4分,4~ mm则分段测量并评分;病灶宽度>2 mm评分乘以2;最终计算全胃病灶总的评分即为胃黏膜损伤指数。
1.6胃黏膜组织病理观察胃黏膜损伤指数测定完毕后,在损伤明显处取组织,石蜡包埋,切片,HE染色,并在光镜下观察。
1.7统计学处理采用SPSS 10.0进行数据分析,3组间血清MDA、GSH、PGE2含量及胃黏膜损伤指数的比较采用单因素方差分析,两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.1各组大鼠血清GSH、MDA及PGE2的含量模型组相对于对照组来说,MDA含量升高,GSH含量降低,PGE2含量升高。实验组相对于模型组来说,MDA含量降低,GSH含量升高,PGE2含量降低。见表1。
2.2各组大鼠胃黏膜损伤指数结果显示模型组胃黏膜损伤指数高于对照组,实验组低于模型组。见表1。
2.3各组大鼠胃黏膜组织病理观察对照组大鼠胃黏膜光整完好,淡红色,质地柔软,肉眼少见糜烂及溃疡;模型组大鼠胃黏膜均有不同程度的充血、水肿,可见散在点状出血、糜烂;实验组大鼠胃黏膜有轻度的糜烂和水肿。对照组大鼠镜下黏膜层结构完整,黏膜上皮层细胞完整,固有层腺体结构完整,主细胞、壁细胞清晰可见,未见炎症细胞;模型组大鼠镜下黏膜层破坏,可见黏膜中断现象,有局灶性坏死;实验组镜下黏膜层细胞脱落,有少量黏膜糜烂和坏死现象。见图1。
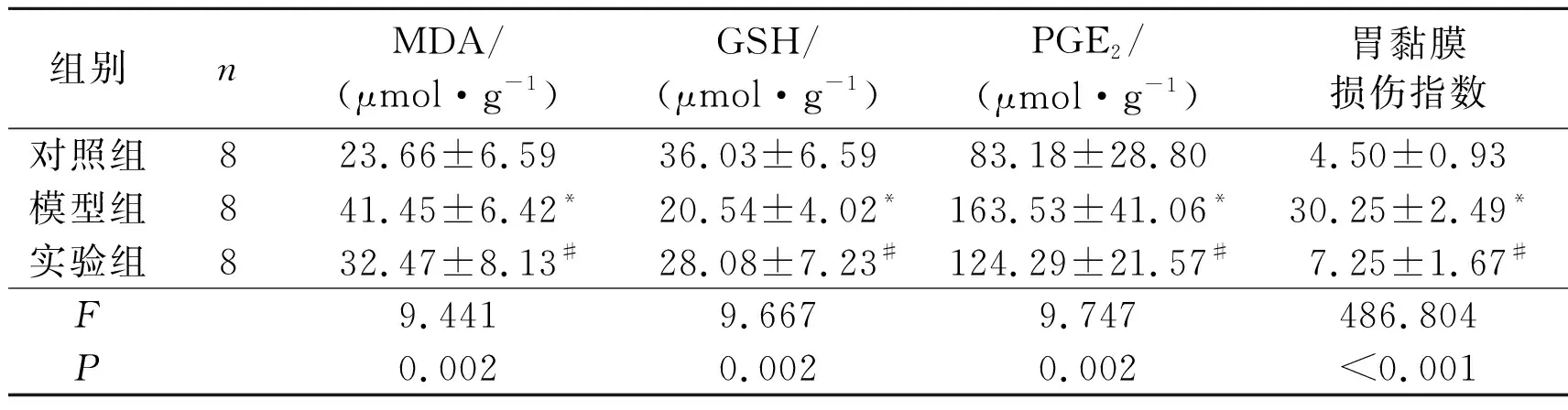
表1 3组大鼠血清MDA、GSH、PGE2含量及胃黏膜损伤指数比较
*:与对照组相比,P<0.05;#:与模型组相比,P<0.05。
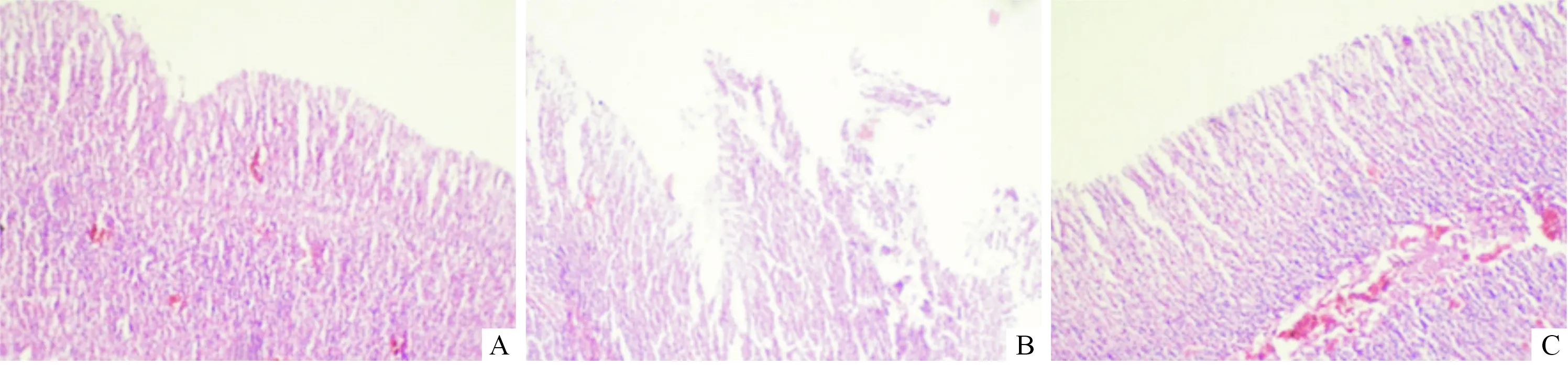
图1 各组大鼠胃黏膜组织病理观察结果(HE,×400)
3 讨论
睡眠是人和哺乳动物的基本生理需要,因此睡眠剥夺可引起机体内稳态失衡。睡眠剥夺大鼠的病理变化以营养不良较为突出,主要继发于能量消耗增多,体内的氧自由基含量明显增高,当机体的抗氧化能力不足以清除增多的活性氧就会发生氧化应激[6]。胃黏膜损伤指数是衡量睡眠剥夺对大鼠胃黏膜损伤的重要指标。损伤程度同时也可通过溃疡个数及溃疡大小来表示。该研究结果显示,实验组的胃黏膜损伤指数明显低于模型组;模型组镜下黏膜层多见病灶坏死区域,且出现黏膜层断裂现象,而实验组镜下黏膜层少见溃疡及病灶坏死区域,说明褪黑素对睡眠剥夺产生的应激作用有明显效果。对照组也出现溃疡,可能由于每天腹腔注射对其造成了刺激从而导致大鼠应激产生溃疡。
褪黑素是由松果体、胃肠道、视网膜等多器官分泌的一种神经内分泌激素,是体内抗自由基、抗氧化作用很强的活性物质[7];具有广泛的生物学作用,除能直接清除和抑制氧自由基产生外,还能增强内源性抗氧化酶的作用[8]。近年来其在消化系统疾病中的作用得到重视。
有研究[9]表明,氧自由基的大量产生在多种原因引起的胃黏膜损伤的病理过程中均起重要作用。而MDA是细胞膜脂质过氧化的终产物之一,其产生的量与氧自由基的量及脂质过氧化的程度呈正相关[10],与自由基的清除能力呈负相关,是反映自由基对生物大分子的损伤程度及生物体抗氧化能力的最好指标之一[11-12],MDA增多与应激作用有关。该研究结果表明,实验组大鼠血清MDA含量明显低于模型组,提示褪黑素对睡眠剥夺大鼠血清中MDA含量的升高有显著的抑制作用,对胃黏膜的保护作用可能与抗脂质过氧化作用有关,在睡眠剥夺对机体造成氧化损伤时起保护作用。
机体可通过酶类和非酶类2种分子来保护氧化应激的细胞,后者的代表为GSH。GSH是在肝内由谷氨酸、半胱氨酸和甘氨酸组成的三肽物质,广泛分布于机体各器官内,是细胞内重要的水溶性抗氧化剂,它含有巯基,通过巯基与体内的自由基结合,对过氧化物、自由基和亲电子基起拮抗作用,能清除过氧化代谢产物,调节细胞的氧化还原稳态,维持细胞生物功能[13]。GSH清除过氧化物时需在谷胱甘肽过氧化物酶作用下转化成氧化型谷胱甘肽(GSSG),GSSG经谷胱甘肽还原酶催化还原为GSH继续发挥抗氧化功能。实验组大鼠血清中GSH的含量明显低于对照组但高于模型组,提示褪黑素可促进血清中GSH含量的增高,对睡眠剥夺造成机体氧化损伤起到防护作用。
PGE2由胃黏膜产生并释放入血,被认为是胃黏膜的保护因子,可增加黏膜血流,为黏膜细胞供应充足的营养物质和氧气,还可抑制胃酸、胃蛋白酶原分泌,刺激黏液和碳酸氢盐分泌来调节体内酸碱度并维护胃黏膜的完整性,增强胃黏膜的防御功能[8]。在胃黏膜遭受应激损害时,机体可以通过产生PGE2而起到对胃黏膜的保护作用。该研究结果中模型组大鼠血清PGE2含量明显高于对照组,说明睡眠剥夺引起的胃溃疡促使机体产生PGE2来应对氧化应激,以减少应激带来的不良影响。而实验组PGE2含量明显低于模型组,推测可能的原因是作者在对实验组大鼠进行睡眠剥夺之前就已经用褪黑素进行预处理,在睡眠剥夺期间,褪黑素对睡眠剥夺大鼠的胃黏膜损伤即起到了缓解或保护作用,从而使机体本身应对应激时的反应没有那么激烈,因此产生的PGE2也没有模型组多,并猜测PGE2和褪黑素可能分别通过各自的途径对氧化应激引起的胃黏膜损伤起保护作用。该结果与Nassar等[14]的研究结果一致,而与王鑫国等[15]的研究结果并不完全一致,其具体机制尚有待进一步研究。
睡眠障碍因素的不断作用会导致某些疾病的发生,将对机体产生巨大危害。现在相当多的人在研究如何减少睡眠剥夺所带来的影响,从大脑、肝脏、免疫系统等方面分别阐述了睡眠剥夺的影响及可能的机制。作者着重强调对胃的研究,探讨睡眠剥夺对消化系统的作用,为因睡眠剥夺产生的消化系统疾病的预防和治疗提供理论依据。褪黑素作为一种内源性多效应的生理活性物质,具有低毒安全的特点[16]。迄今为止,其不良反应仅为嗜睡,未见其他有关的毒理报道,在多种动物体内也未建立其半数致死剂量, 故其临床应用具有较高的安全性和前景。
[1]Papakonstantinou E,Ryan DH,Harris RB.Dietary fish oil does not protect rats exposed to restraint or sleep deprivation stress[J].Physiol Behav,2003,78(4/5):759
[2]Edéll-Gustafsson UM, Gustavsson G, Yngman Uhlin P.Effects of sleep loss in men and women with insufficient sleep suffering from chronic disease:a model for supportive nursing care[J]. Int J Nurs Pract,2003,9(1):49
[3]Matsumoto T,Yoshiyama S,Kobayashi T,et al.Mechanisms underlying enhanced contractile response to endothelin-1 in diabetic rat basilar artery[J].Peptides,2004,25(11):1985
[4]佘晓俊,韦京豫,李慧琴,等. 睡眠剥夺大鼠松果体中褪黑素含量测定[J].解放军预防医学杂志,2002,20(5):343
[5]刘长云,王海明,陈坚,等.大鼠睡眠剥夺后行为及下丘脑诱生型一氧化氮合酶mRNA表达的变化[J].第二军医大学学报,2002,23(3):281
[6]唐庆娟,陶凯忠,胡淼淼,等. 72小时睡眠剥夺大鼠的氧化应激[J].中华行为医学科学,2003,12(5):500
[7]黄碧兰,王秋桂,余良主,等.褪黑素对大鼠应激性胃粘膜损伤的保护作用及其机理[J].咸宁学院学报:医学版, 2006,20(4):288
[8]单岩,张谦,刘章锁.褪黑素在大鼠慢性肾功能衰竭进展中对肾组织细胞增殖和凋亡的影响[J].郑州大学学报:医学版,2009,44(3):629
[9]Kwiecien S,Brzozowski T,Konturek SJ.Effects of reactive oxygen species action on gastric mucosa in various models of mucosal injury[J].J Physiol Pharmacol,2002,53(1):39
[10]曲宏,刘华.褪黑素对高糖诱导白内障形成抑制作用的实验研究[J].国际眼科杂志,2011,11(3):403
[11]Gutteridge JM. Lipid peroxidation and antioxidants as biomarkers of tissue damage[J].Clin Chem,1995, 41(12 Pt 2):1819
[12]Col C, Dinler K, Hasdemir O, et al. Oxidative stress and lipid peroxidation products: effect of pinealectomy or exogenous melatonin injections on biomarkers of tissue damage during acute pancreatitis[J].Hepatobiliary Pancreat Dis Int,2010,9(1):78
[13]张丽琴,陈兴无,涂雄文,等.不同人群对香烟烟雾提取物炎症反应及其斯伐他汀调节效应研究[J].中国实用内科杂志,2010,30(8):711
[14]Nassar NN, Schaalan MF, Zaki HF, et al. Octreotide ameliorates gastric lesions in chronically mild stressed rats[J].World J Gastroenterol,2011,17(9):1135
[15]王鑫国,马志红,牛丽颖,等.胃舒胶囊防治消化性溃疡的机制研究[J].中药药理与临床,2007,23(1):58
[16]胡爱民,张治国,侯志贞,等.褪黑素对大鼠实验性脊髓损伤的神经保护作用[J].解放军医学杂志,2011,36(2):164
