原花青素通过Caspase途径诱导乳腺癌MCF-7细胞凋亡
2013-10-16王明仲洪学军
薛 瑞,王明仲,洪学军,吴 倩,廉 果,何 标
原花青素(Proanthocyanidin/Procyanidin,PC)是天然植物中广泛存在的一类多酚化合物的总称,是由不同数量的儿茶素或表儿茶素结合而成,为多酚类黄酮。近年研究显示,PC不仅可以抑制肺癌、慢性骨髓白血病、前列腺癌等肿瘤细胞的生长,还可诱导多种肿瘤细胞凋亡[1-2]。本研究旨在探讨PC对人乳腺癌MCF-7细胞的生长抑制、诱导凋亡作用,为研究开发PC作为抗乳腺癌新药提供部分实验依据。
1 材料与方法
1.1 材料、试剂和仪器 人乳腺癌MCF-7细胞由华中科技大学同济医学院提供;胎牛血清(杭州四季青生物工程材料公司);RPMI 1640培养粉(Gibco公司);顺铂(江苏豪森药业股份有限公司);MTT和胰蛋白酶(Sigma公司);Caspase-9、Caspase-12酶联免疫检测试剂盒(GDB公司);ELx800型酶联免疫检测仪(BIO-TEK公司);CO2孵箱(JOUAN公司);流式细胞仪FACS Calibur(Becton Dickinson公司);计算机数据处理软件CELLQUEST(B.D.公司);其他试剂均为国产分析纯。
1.2 方法
1.2.1 MTT法测定PC对MCF-7细胞生长的抑制作用 常规培养人乳腺癌MCF-7细胞,处于对数生长期时,常规消化、洗涤后,以1×105/mL密度接种于96孔培养板中,于5%CO2、37℃孵箱中预培养24 h后,分别加入不同浓度的PC,使最终每组含 PC 浓度分别为 10、20、40、80、160、320 μg/mL,每个浓度6个复孔,并设阳性对照药顺铂组和正常细胞组,继续培养。分别于24、48、72 h 3个时相进行MTT比色实验:每次于实验结束前每孔加入MTT,继续培养4 h后按常规采用酶标仪(波长570 nm)测定各孔吸光度值(A)。按公式“(1-药物孔A值/对照孔A值)×100%”计算细胞抑制率,以剂量和生长抑制率做直线相关分析。
1.2.2 流式细胞术检测MCF-7细胞周期和凋亡将MCF-7细胞以1×106/mL密度接种于培养瓶中,24 h后随机分组,分别加入不同浓度的PC,使最终每组含PC 浓度分别为40、80、160 μg/mL,并设阳性对照药顺铂组和正常对照组,继续培养48 h后收集细胞培养上清液,置-20℃环境待测相关基因蛋白;常规消化洗涤细胞后,用70%预冷乙醇固定细胞,置4℃环境待测凋亡率和细胞周期。检测前,先离心弃乙醇,再用PBS洗涤后置于柠檬酸缓冲液中1 h以上,调整细胞浓度至1×106/mL左右,按照试剂盒说明书操作,上流式细胞仪检测细胞凋亡率并分析细胞周期。
1.2.3 ELISA法检测凋亡相关基因蛋白Caspase-9、Caspase-12含量 采用ELISA法检测凋亡相关基因蛋白 Caspase-9和 Caspase-12含量。取“1.2.2”项中冻存的细胞培养上清液,按Caspase-9酶联免疫检测试剂盒说明书进行操作,用酶标仪(波长450 nm)测吸光度值,绘制标准曲线,并计算Caspase-9含量。同法检测Caspase-12的含量。
2 结果
2.1 PC对MCF-7细胞生长的抑制作用 置显微镜下观察,PC作用后的细胞排列稀疏,随作用时间延长和药物浓度的增加细胞密度逐渐减少。各剂量组PC对MCF-7细胞的增殖均有一定的抑制作用,抑制率与药物浓度和作用时间呈正相关。结果见图1。
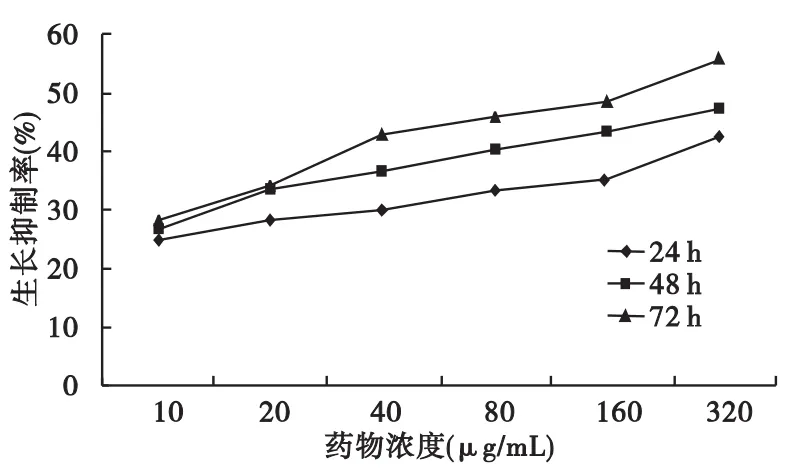
图1 PC对MCF-7细胞增殖的抑制作用
2.2 PC对 MCF-7细胞凋亡的影响 40、80、160 μg/mL PC作用于MCF-7细胞后的细胞凋亡率明显高于对照组,随着剂量的增加,细胞凋亡率明显增加,并出现凋亡典型性特征峰。见表1。
表1 PC对MCF-7细胞凋亡的影响(,n=3)

表1 PC对MCF-7细胞凋亡的影响(,n=3)
注:与细胞对照组比较,*P<0.001
组别 剂量(μg/mL) 凋亡率(%)细胞对照7.57±0.37顺铂 40 22.49±0.28*PC 40 22.37±0.31*PC 80 31.25±0.38*PC 160 53.42±0.42-*
2.3 PC对MCF-7细胞周期的影响 PC作用48 h后,细胞周期均受到不同程度的影响,与对照组相比,3个剂量组G2-M期细胞比例均显著增加(P<0.01);且随着药物剂量的增加,G2-M期的比例也增加;G0-G1期和S期略有减少,但与对照组比较差异无统计学意义。提示PC可通过G2-M期阻滞抑制乳腺癌细胞的生长,见表2。
表2 PC对MCF-7细胞周期的作用(,n=3)
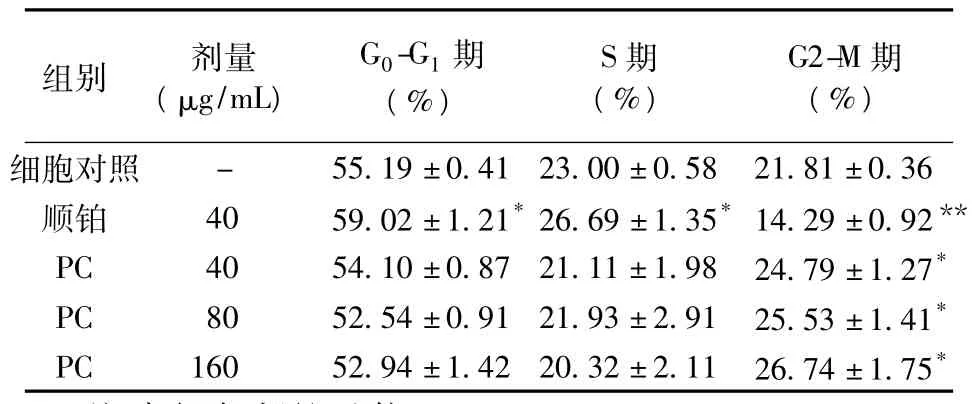
表2 PC对MCF-7细胞周期的作用(,n=3)
注:与细胞对照组比较,*P<0.01,**P<0.001
细胞对照- 55.19±0.41 23.00±0.58 21.81±0.36顺铂 40 59.02±1.21*26.69±1.35*14.29±0.92**PC 40 54.10±0.87 21.11±1.98 24.79±1.27*PC 80 52.54±0.91 21.93±2.91 25.53±1.41*PC 160 52.94±1.42 20.32±2.11 26.74±1.75*
2.4 对Caspase-9、Caspase-12蛋白表达的影响PC 3个剂量组Caspase-12蛋白表达均高于对照组(P <0.05 或 0.01);在 40、80 μg/mL 剂量下,PC亦促进Caspase-9蛋白表达(P<0.01),见表3。

表3 PC对MCF-7细胞Caspase-9、Caspase-12蛋白表达的影响
3 讨论
乳腺癌是女性常见的恶性肿瘤之一,严重危害妇女健康。乳腺癌具有易复发转移的特性,部分患者在确诊时已有远处转移。原花青素作为一种天然药物,水溶性好,极易被机体吸收,生物利用度高达90%以上,具有广泛的药理作用。现代研究发现,其抗肿瘤作用较强,可选择性抑制各种肿瘤细胞的生长,但对正常组织和细胞无杀伤作用,在抗肿瘤治疗方面有巨大潜力[4]。
细胞凋亡不仅直接影响机体组织的正常发育、分化与死亡,在肿瘤治疗中的作用也已受到极大的重视[5-6]。目前认为,诱导细胞凋亡主要有Caspase依赖途径和非Caspase依赖途径,以前者为主[7-8]。而根据通路中的起始Caspase蛋白不同,Caspase依赖途径又可分为3种:①死亡受体通路,激活的Caspase-8可激活下游效应Caspase裂解多种蛋白质而最终导致细胞凋亡;②内质网介导细胞凋亡通路,Caspase-12位于内质网膜,内质网钙离子失衡或者蛋白过量表达都会诱导产生Caspase-12,同时也导致胞质的Caspase-7转移到内质网表面,Caspase-7激活 Caspase-12,激活的Caspase-12可进一步剪切Caspase-3而引发细胞凋亡;③线粒体介导细胞凋亡,线粒体中的促凋亡蛋白受到凋亡信号刺激,释放到细胞质,激活Caspase-9及下游的Caspase-3、7或6,其最终都能激活凋亡执行者Caspase-3,水解细胞成分而使细胞凋亡。
本实验分别采用MTT法和流式细胞术探讨PC对乳腺癌MCF-7细胞增殖、凋亡和细胞周期的影响。实验结果表明,PC能够有效杀伤乳腺癌MCF-7细胞,抑制其增殖,细胞抑制率呈浓度、时间依赖性,且细胞形态发生明显改变。PC能够明显将细胞周期阻滞在G2-M期,并可促进细胞凋亡,其在诱导MCF-7细胞凋亡的同时,基因蛋白Caspase-12表达显著增加,中、低浓度时也可诱导Caspase-9表达增加,提示PC抑制人乳腺癌MCF-7细胞的作用机制与阻滞细胞周期于G2-M期和诱导细胞凋亡有关,该细胞凋亡诱导途径与Caspase有关,可能涉及Caspase家族的内质网和线粒体2条激活通路。细胞凋亡激活信号通路十分复杂,不同信号分子之间相互联系[9],有待进一步研究。
[1]Mitsunaga T.Anti-caries activity of bark proanthocyanidins[J].Basic Life Sci,1999,66:555-573.
[2]Vayalil PK,Mittal A,Katiyar SK.Proanthocyanidins from grape seeds inhibit expression of matrix metalloproteinases in human prostate carcinoma cells,which is associated with the inhibition of activation of MAPK and NF kappa B[J].Carcinogenesis,2004,25(6):987-995.
[3]Smart DJ,Halicka HD,Traganos F,et al.Ciprofloxacin induced G2 arrest and apoptosis in TK6 lymphoblastoid cells is not dependent on DNA double-strand break formation[J].Cancer Biol Ther,2008,7(1):113-119.
[4]Wu L,Huang Z,Qin P,et al.Chemical characterization of a procyanidin-rich extract from sorghum bran and its effect on oxidative stress and tumor inhibition in vivo[J].Agric Food Chem,2011,59,8609-8615.
[5]王炎,李琦,范忠泽,等.丹参酮ⅡA介导p38 MAPK信号转导诱导人肝癌细胞凋亡[J].世界华人消化杂志,2009,17:124-129.
[6]Lee SK,Kim HN,Kang YR,et al.Obovatol inhibits colorectal cancer growth by inhibiting tumor cell proliferation and inducing apoptosis[J].Bioorg Med Chem,2008,16:8397-8402.
[7]Vaidya S,Velázquez-Delgado EM,Abbruzzese G,et al.Substrate-induced conformational changes occur in all cleaved forms of caspase-6[J].J Mol Biol,2011,406(1):75-91.
[8]Reuter S,Eifes S,Dicato M,et al.Modulation of anti-apoptotic and survival pathways by curcumin as a strategy to induce apoptosis in cancer cells[J].Biochemical Pharmacology,2008,76:1340-1351.
[9]杨洁,邓子鲲,朱彤阳,等.肿瘤坏死因子相关凋亡诱导配体临床治疗应用前景[J].世界临床药物,2012,33(2):105-115.
