1-MCP 处理对采后机械损伤黄瓜生理生化特性的影响
2013-08-07邓红军陈小红侯晓荣茅林春
邓红军,陈小红,李 萍,侯晓荣,茅林春
(浙江大学生物系统工程与食品科学学院,浙江杭州310058)
黄瓜(Cucumis sativus L.)是重要的果蔬品种之一,嫩果清脆爽口,营养丰富,既是酒宴佳肴,又是深受大众喜爱的蔬菜。果蔬在采收、储运过程中,不可避免的会出现机械损伤。机械损伤将破坏果蔬组织细胞膜系统和细胞结构的完整性,导致有关代谢物质的改变,发生一系列异常生理生化变化,加速果蔬采后衰老进程,造成品质下降,贮藏期缩短,从而导致大量的经济损失[1]。因此,研究如何减少因机械损伤导致的商品价值流失是提高果蔬采后商品价值的主要途径之一。1-MCP(1-Methylcyclopropene,1-甲基环丙烯)是一种乙烯抑制剂,通过阻断乙烯和受体蛋白的结合[2],抑制乙烯的生理作用,延缓果实的成熟与衰老[3]。近年来的研究表明,1-MCP 对机械损伤番茄[4],鲜切 猕 猴桃[5],鲜切胡 萝 卜[6],鲜切苹果[7],鲜切西瓜[8],切分哈密瓜[9]等有一定的保鲜效果,有利于果蔬在逆境条件下,增强自身抵抗逆境的能力,延长货架期,降低因逆境胁迫导致的商品价值损失。
1 材料与方法
1.1 材料与仪器
本实验所用黄瓜品种为“浙秀一号”,采自浙江大学华家池校区黄瓜蔬菜基地,为开花之后第10d采摘,采后2h 内运回实验室。选择大小均匀,色泽一致,无虫害,无机械损伤的黄瓜进行实验。
O2-CO2气体分析仪 PBI Dansensor check Mate 3 顶空气体分析仪;电导率仪(DDS-11A 型电导率仪 杭州亚美电子仪器厂;UV-1750 紫外分光光度计 日本岛津;Hettich UNIVERSAL 320R 高速冷冻离心机 德国;气调冷库等。
1.2 实验方法
1.2.1 样品处理 将黄瓜用浓度为0.21%的次氯酸钠溶液(pH6.5)清洗消毒2min[9],自然风晾干。将黄瓜分为处理组、对照组和空白组,每组25 个黄瓜。处理组黄瓜用1ppm 1-MCP(SmartFreshTM,0.14%,AgroFresh Inc.)于20℃密闭条件下处理12h 后模拟机械损伤,参照William 等[10]的方法,用削皮器在黄瓜表面按照5cm ×16cm ×0.1cm 进行损伤。对照组黄瓜,无1-MCP 处理,在气调库中放置12h 后,进行机械损伤,损伤方法同上。空白组黄瓜,无损伤也无1-MCP 处理。3 组样品处理完成后置于气调库中贮藏((20 ±0.5)℃,RH90%~95%),每隔3d 取样,测定相关指标,重复3 次。实验开始当天,另取5 个黄瓜样品用作测定0d 新鲜黄瓜相关指标。
1.2.2 呼吸强度 每次取5 个黄瓜样品置于密闭容器内,放置2h 后,用O2- CO2气体分析仪(PBI Dansensor Check Mate 3)测定容器内CO2含量,并参照张桂[11]的方法计算CO2的含量,重复3 次。
1.2.3 相对电导率 参照Mao[12]方法,并作部分改进,用不锈钢打孔器切取相同部位果肉块(直径为0.5cm,长度1.5cm),取相同数量放入试管,用去离子水洗3 次,然后,加入20mL 的去离子水,放入真空泵中,压力为0.1MPa,抽真空10min 后,用DDS-11A 型数显电导率仪测定浸泡液的电导值。然后放入沸水中煮10min 后冷却至室温再次测定其电导率,重复3次。以相对电导率(%)表示黄瓜细胞膜完整性。
1.2.4 酶活性及丙二醛含量测定 抗氧化酶活性含量参照曹建康[13]等的方法,CAT 活性的测定采用紫外分光吸收法,POD 活性测定采用愈创木酚法测定,APX 活性的测定方法参照曹建康[13]等方法,丙二醛(MDA)含量测定采用硫代巴比妥酸法(TBA)比色法,PAL 测定参照曹建康[13]方法。
1.3 数据统计与分析
实验数据用Excel 2010 进行处理,用SPSS17.0统计软件中“one-way ANOVA”进行差异显著性分析,采用LSD 多重比较法进行差异性比较。p >0.05表示差异不显著,p <0.05 表示差异显著,p <0.01 表示差异极显著。
2 结果与讨论
2.1 1-MCP 处理对机械损伤黄瓜呼吸作用的影响
从图1 可见:机械损伤且没有用1-MCP 处理的对照组黄瓜,呼吸强度显著高于处理组和空白组(p <0.05),机械损伤但经1-MCP 处理组黄瓜呼吸强度显著低于没有经1-MCP 处理的对照组(p <0.05),但是高于未受机械损伤未经1-MCP 处理的空白组。说明机械损伤会使黄瓜呼吸强度增大,这与在苹果果实上的研究一致[14],而1-MCP 处理可以抑制机械损伤黄瓜的呼吸作用,降低其呼吸强度。在贮藏期间,各组黄瓜的呼吸强度在第3d 时均达到最大值,之后呈现下降上升,上升下降的规律。第6d 时下降幅度大,对照组、处理组、空白组分别比第3d 下降了25.02%、25.39%、28.12%。6d 至15d 三组均呈现上升下降的变化规律,但是均低于第3d 的值。说明受到机械损伤刺激,黄瓜的呼吸强度增大,同时也会使黄瓜的营养物质消耗量增多。因此,在第3d 时呼吸强度最大,说明机械损伤诱导了黄瓜伤呼吸的产生,补充因机械损伤导致的黄瓜营养物质的过快消耗,3d 之后各组的呼吸强度虽都呈现一定的变化规律,但均低于3d 的值,可能是其体内营养物质的消耗达到一定程度后,不足以供给其呼吸作用所需要的营养物质所致,所以其呼吸作用逐渐减弱。吕贵华等[15]对损伤黄瓜的研究表明,伤诱导的呼吸上升与乙烯产生量平行发展。
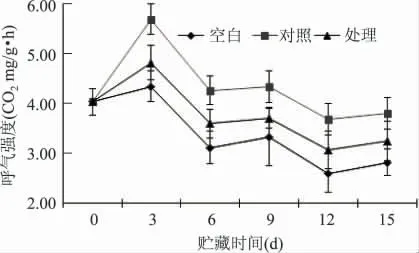
图1 1-MCP 处理对机械损伤黄瓜呼吸作用的影响Fig.1 Effect of 1-MCP on the changes of respiration rate in mechanical damage cucumber fruit
2.2 1-MCP 处理对机械损伤黄瓜相对电导率及丙二醛(MDA)含量的影响
膜结构在植物组织中具有重要作用,细胞膜透性的高低可以反应出细胞膜的完整程度和稳定性,也可以在一定程度上反映组织受伤害的情况。相对电导率是反应果蔬细胞膜透性的重要指标之一,当其受到逆境胁迫时,相对电导率值会出现相应的响应,组织相对电导率越高,说明细胞膜透性越大,细胞组织受损伤的程度也就越严重[16]。从图2 可知,各组电导率均随着贮藏时间的延长,逐渐增大,说明随着贮藏时间的延长,膜脂过氧化程度逐渐加剧。各组黄瓜相对电导率呈现出:对照>处理>空白,且各组间差异显著(p <0.05)。说明机械损伤对黄瓜细胞膜产生了破坏,导致细胞膜透性增大,而处理组经1-MCP 处理后,其相对电导率显著低于未经1-MCP处理的对照组(p <0.05)。空白组,因没有受到损伤,其细胞膜相对完整程度较高,相对电导率也显著低于处理组和对照组(各组间p <0.05)。说明1-MCP处理能减轻因机械损伤导致的黄瓜相对电导率的增大,有效防止了膜脂过氧化,维持细胞膜较好的完整性,减轻机械损伤胁迫对黄瓜细胞组织的伤害[17],延缓了黄瓜果实的衰老,有利于延长其贮藏期。
植物遭受机械损伤,病害或冷害胁迫时会打破果实组织活性氧产生和清除代谢之间的平衡,导致活性氧大量积累从而加剧膜脂过氧化[18],而MDA 是膜脂过氧化的最终分解产物[19],是鉴别植物受损伤程度的指标之一,因此可以用来衡量膜脂过氧化程度[4,20]。由图3 可知:在黄瓜受到机械损伤初期,MDA 含量迅速积累,在第3d 时达到最大值,损伤但是未经1-MCP 处理的对照组MDA 含量增速最快,是损伤但经1-MCP 处理组果实的1.40 倍(p <0.05)。而未经机械损伤且未经1-MCP 处理的空白组的MDA 值显著低于对照和处理组(p <0.05)。表明机械损伤加速了膜脂的过氧化,而1-MCP 处理可以抑制由于机械损伤导致的膜脂过氧化。随着时间的延长,黄瓜果实的MDA 含量逐渐下降,这可能是果实中的活性氧清除系统发挥了作用;而MDA 在第12d 时又升高,可能是由于活性氧清除酶仍然不能清除过剩自由基,导致膜脂过氧化继续加剧,从而导致MDA 含量再次上升。

图2 1-MCP 处理对机械损伤黄瓜相对电导率的影响Fig.2 Effect of 1-MCP on the changes of relative electrolyte leakage in mechanical damage cucumber fruit

图3 1-MCP 处理对机械损伤黄瓜MDA 含量的影响Fig.3 Effect of 1-MCP on the changes of MDA contents in mechanical damage cucumber fruit
2.3 1-MCP 处理对机械损伤黄瓜POD 活性的影响
POD 是植物在受到逆境条件下酶促及防御酶系统的关键酶之一,它通过与植物体内其他防逆境酶相互协调作用,清除过量自由基,使体内自由基维持在正常动态水平,以提高植物的抗逆性[21-22]。如图4所示:在贮藏过程中黄瓜果实的POD 活性呈现前期先上升后下降,再上升下降的趋势,在第3d 时各组POD 活性峰值均达到最大,空白组,对照组,处理组分别是第0d 的2.37、2.91、3.37 倍。第9d 时POD 活性峰值再次小幅度升高,可能是果实在成熟衰老过程中也能激发POD 活性,提高组织对逆境的抗氧化能力。另外,未经1-MCP 处理的对照组POD 活性值始终显著低于经1-MCP 处理的组(p <0.05),表明1-MCP处理有利于保持机械损伤黄瓜果实较高的POD 活性,增加果实清除自由基的能力,从而减轻过量自由基对果实组织的毒害,利于保持果实较好的品质。

图4 1-MCP 处理对机械损伤黄瓜POD 活性的影响Fig.4 Effect of 1-MCP on the changes of POD activities in mechanical damage cucumber fruits
2.4 1-MCP 处理对机械损伤黄瓜CAT 活性的影响
CAT 活性与植物的抗逆性、耐贮性密切相关。植物在逆境下或衰老时,由于体内活性氧代谢加强而使H2O2发生累积,过量的H2O2会导致过氧化伤害,CAT 可以催化过量的H2O2分解(2H2O2→O2+2H2O),清除H2O[23-24]2。从图5 知:总体上各组CAT活性值呈现先上升后下降趋势,前期快速上升,在第3d 时CAT 活性峰值达到最大。处理组、对照组、空白组CAT 活性值分别是第0d 的1.64、2.00、2.27 倍,处理组CAT 活性显著高于对照,说明1-MCP 处理可以保持黄瓜果实较高的CAT 活性,从而有效地清除因损伤胁迫产生的活性氧,而对照组CAT 活性高于空白组,说明机械损伤胁迫会激发黄瓜体内CAT 活性,清除因机械损伤胁迫产生的过量活性氧。因此,1-MCP 处理能保持黄瓜果实较高的CAT 活性,从而清除因机械损伤导致的过量自由基,减轻过量自由基对组织的伤害。
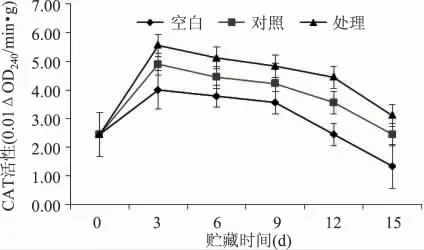
图5 1-MCP 处理对机械损伤黄瓜CAT 活性的影响Fig.5 Effect of 1-MCP on the changes of CAT activity in mechanical damage cucumber fruit
2.5 1-MCP 处理对机械损伤黄瓜PAL 活性的影响
苯丙氨酸解氨酶(PAL)是存在于高等植物中的苯丙烷类代谢途径中的第一个关键酶和限速酶[25],它能催化L-苯丙氨酸脱氨产生大量次生代谢物质,如木质素及各种酚类化合物[26]。大量研究表明,果蔬在受到机械损伤后,苯丙烷类代谢被激活,PAL 活性快速升高[27]。因此,当黄瓜在遭受机械损伤时,PAL 活性上升以产生较多的植保素、木质素来减轻伤害,促进损伤愈合。当合成较多的次生代谢物后,他们会反馈抑制PAL 活性,从而减少营养物质的消耗,达到保护自身的目的,有利于黄瓜伤口的愈合[28]。从图6 可知:各组PAL 活性呈现先上升接着下降,再上升下降的趋势,在第6d 达到最大值。1-MCP处理组黄瓜果实PAL 活性显著高于对照组(p <0.05),说明1-MCP 处理能保持损伤黄瓜果实较高的PAL 活性,而对照组显著高于空白组(p <0.05),表明机械损伤诱导黄瓜果实产生PAL 来减轻伤害。王丰等[29]对黄瓜子叶机械损伤后进行研究发现,黄瓜幼苗体内PAL 活性显著高于对照,说明机械损伤诱导黄瓜植株产生更多的PAL 减轻伤害,与本实验的对照结论相符,而本实验用1-MCP 处理则能保持损伤黄瓜果实较高的PAL 活性。
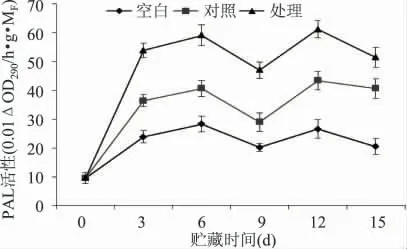
图6 1-MCP 处理对机械损伤黄瓜PAL 活性的影响Fig.6 Effect of 1-MCP on the changes of PAL activity in mechanical damage cucumber fruit
2.6 1-MCP 处理对机械损伤黄瓜APX 活性的影响
抗坏血酸过氧化物酶(APX)是植物体内清除H2O2的关键酶,其通过催化反应2AsA + H2O2→2MDHA(单脱氢抗坏血酸)+ 2H2O 清除过量的H2O2,APX 活性的升高有利于植物体内H2O2的清除[30-31]。从图7 可知,APX 活性整体上呈现先上升后下降的趋势,处理组APX 活性显著高于对照组和空白组(p <0.05),说明1-MCP 处理有利于APX 保持较高的活性,增强对活性氧的清除能力。对照和空白组在第3d 达到最大活性峰值,而处理组的活性峰值延迟出现,第6d 达到最大,说明1-MCP 处理延缓了APX 活性峰值的出现。

图7 1-MCP 处理对机械损伤黄瓜APX 活性的影响Fig.7 Effect of 1-MCP on the changes of APX activity in mechanical damage cucumber fruit
3 结论
经1-MCP 处理后机械损伤的黄瓜,在贮藏过程中其生理生化代谢受到明显的影响,其呼吸强度、相对电导率、MDA 含量等均低于对照组,而POD、CAT、APX 等抗氧化酶活性显著高于对照组,说明1-MCP处理提高了损伤黄瓜果实组织的抗氧化能力,清除因机械损伤导致的过量自由基。1-MCP 处理后机械损伤的黄瓜果实能保持较高PAL 活性,可以产生较多的植保素、木质素来促进伤口愈合,减轻伤害。因此,1-MCP 处理后机械损伤的黄瓜果实能保持较好的采后品质,对延缓损伤黄瓜的品质劣变,减少其食用和商用价值的流失具有积极的作用。
[1]陈绍军,陈明木,康彬彬,等.机械伤害对枇杷果实采后生理的影响[J].福建农林大学学报:自然科学版,2004,33(2):250-253.
[2]Sisler E C,Serek M,DupilleE,et al.Inhibition of ethylene responses by 1-methycyclopropene and 3-methylcyclopropene[J].Plant Growth Regulation,1999,27(2):105-111.
[3]Hofman P J,Jobin-Decor M,Meiburg G F,et al.Ripening and quality responses of avocado,custard apple,mango and papaya fruit to 1 - methylcyclopropene[J]. Australian Journal of Experimental Agriculture,2001,41,567-572.
[4]解静.1-MCP 对番茄冷害及机械损伤的影响[D].杭州:浙江大学,2010.
[5]Mao L C,Wang G Z,Que F. Application of 1 -methylcyclopropene prior to cutting reduces wound responses and maintains quality in cut kiwifruit[J].Journal of Food Engineering,2007,78,361-365.
[6]马跃,胡文忠,程双,等.1-MCP 处理对鲜切胡萝卜生理生化变化的影响[J].食品工业科技,2011,32(4):341-344.
[7]Mao L C,Lu F J,Wang G Z. Application of 1 -methylcyclopropene reduces wound responses and maintains quality in fresh-cut apple [J].Asia Pacific Journal of Clinical Nutrition,2007(16):111-115.
[8]SaftnerR,LuoY,McEvoyJ,et al.Quality characteristics of fresh- cut watermelon slices from non - treated and 1 -methylcyclopropene and/or ethylene- treated whole fruit[J].Postharvest Biology and Technology,2007(44):71-79.
[9]谢绍忠,吴斌,钟梅,等.1-MCP 对切分哈密瓜保鲜效果的研究[J].食品科学,2009,30(10):278-281.
[10]William M,WalterJr,Randall - SchadelB,et al. Wound healing in cucumber fruit[J].Journal of the American Society for Horticultural Science,1990,115(3):444-452.
[11]张桂.果蔬采后呼吸强度的测定方法[J].理化检验-化学分册,2005,41(8):596-597.
[12]Mao L C,Wang G Z,Zhu C G,et al. Involvement of phospholipase D and lipoxygenase in response to chilling stress in postharvest cucumber fruits[J].Plant Science,2007,172(2):400-405.
[13]曹健康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007:32-154.
[14]申琳,生吉萍,罗云波.运输中的机械损伤对贮藏初期苹果活性氧代谢的影响[J].中国农业大学学报,1999,1(5):107-110.
[15]吕贵华,吕忠怒.黄瓜果实圆片诱导呼吸和乙烯产生的研究[J].植物生理学通讯,1988(5):21-23.
[16]纪淑娟,韩晶,李江阔,等.1-MCP 处理对新高梨冷藏后常温货架寿命的影响[J].北方园艺,2008(7):244-247.
[17]杨绍兰.1-MCP 处理对黄瓜冷藏期间保鲜效果的影响[J].中国农学通报,2009,25(6):70-72.
[18]彭丽桃,蒋跃明,杨书珍,等.鲜切加工加速茡荠组织衰老与H2O2累积的关系[J].植物生理与分子生物学学报,2005,31(5):523-527.
[19]ScandaliosJG.Oxygen stress and superoxide dismutase[J].Plant Physiology,1993,101:7-12.
[20]边燕.黄瓜植株机械损伤效应及其生理生化物质应答的研究[D].呼和浩特:内蒙古农业大学,2009.
[21]GechevT,WillekensH,Montagu M V,et al. Different responses of tobacco antioxidant enzymes to light and chilling stress[J].Journal of Plant Physiology,2003,160:509-515.
[22]王艳颖,胡文忠,庞坤.机械损伤对富士苹果抗氧化酶活性的影响[J].食品与机械,2007,23(5):26-30.
[23]Chance B,OShino N.Kinetics and mechanisms of catalase in peroxisomes of the mitochondrial fraction [J].Biochemical Journal,1971,122(2):225-233.
[24]宋新华,赵风云.植物体内过氧化氢酶的研究进展[J].安徽农业科学,2007,35(31):9824-9827.
[25]李正国,高雪,樊晶,等.奉节脐橙果实苯丙氨酸解氨酶活性及其基因表达与果皮褐变的关系[J].植物生理与分子生物学报,2006,32(3):381-386.
[26]刘媛.1-MCP 对黄金梨病理和生理生化及品质的影响[D].石家庄:河北师范大学,2008.
[27]潘永贵,施瑞城.采后果蔬受机械伤害的生理生化反应[J].植物生理学通讯,2000,36(6):568-572.
[28]王艳颖,胡文忠,庞坤,等.机械损伤对富士苹果生理生化变化的影响[J].食品与发酵工业,2007,33(7):58-62.
[29]王丰,云兴福,李蕾.机械损伤对黄瓜幼苗体内苯丙氨酸解氨酶和几丁质酶活性的影响[J].内蒙古农业大学学报,2009,30(1):36-40.
[30]孙学成,谭启玲,胡承孝,等.低温胁迫下钼对冬小麦抗氧化酶活性的影响[J].中国农业科学,2006,39(5):952-959.
[31]李惠华,赖钟雄.植物抗坏血酸过氧化物酶研究进展(综述)[J].亚热带植物科学,2006,35(2):66-69.
