免疫亲和柱同时净化 HPLC 法测定植物油中黄曲霉毒素和玉米赤霉烯酮
2013-08-07吴振兴许艳丽
鲍 蕾,吕 宁,吴振兴,静 平,许艳丽,江 帆,董 韬,果 旗,王 雄,* ,王 岳
(1.山东出入境检验检疫局,山东青岛266002;2.北京中检维康技术有限公司,北京100044;3.中国海洋大学,山东青岛266100)
黄曲霉毒素和玉米赤霉烯酮经常同时存在于农作物如花生、玉米、棉籽、芝麻、核桃之中[1],它们会发生致毒协同作用,植物油中有同时受到黄曲霉毒素和玉米赤霉烯酮污染的风险。中国标准[2]规定花生油、玉米油中黄曲霉毒素B1不得超过20μg/kg,其它植物油黄曲霉毒素B1不得超过10μg/kg。欧盟[3]规定毛油和精炼植物油中的黄曲霉毒素B1不得超过2μg/kg,黄曲霉毒素B1、B2、G1、G2总量不得超过4μg/kg,精炼玉米油中玉米赤霉烯酮不得超过200μg/kg。鲍蕾等[4]应用免疫亲和柱净化-光化学柱后衍生-高效液相色谱法结合荧光检测器测定了植物油中的黄曲霉毒素B1、B2、G1和G2,隋凯等[5]应用免疫亲和柱净化-高效液相色谱法荧光法测定了玉米中的玉米赤霉烯酮,李军等[6]应用免疫亲和柱同时净化-高效液相色谱法测定了谷物中的黄曲霉毒素、赭曲霉毒素A 和玉米赤霉烯酮。免疫亲和柱作为样品前处理的方法能有效地将干扰物质去除。采用免疫亲和柱作为样品前处理手段,减少了有机溶剂的使用和目标分析物的损失,具有结合容量大、回收率高、洗脱条件温和、可以方便地重复再生使用等优点。本文应用黄曲霉毒素、玉米赤霉烯酮多功能亲和柱(IAC-AZ)同时净化经90%乙腈提取的植物油样品,然后采用高效液相色谱法荧光法分别定量检测了黄曲霉毒素B1、B2、G1、G2和玉米赤霉烯酮的含量。
1 材料与方法
1.1 材料与仪器
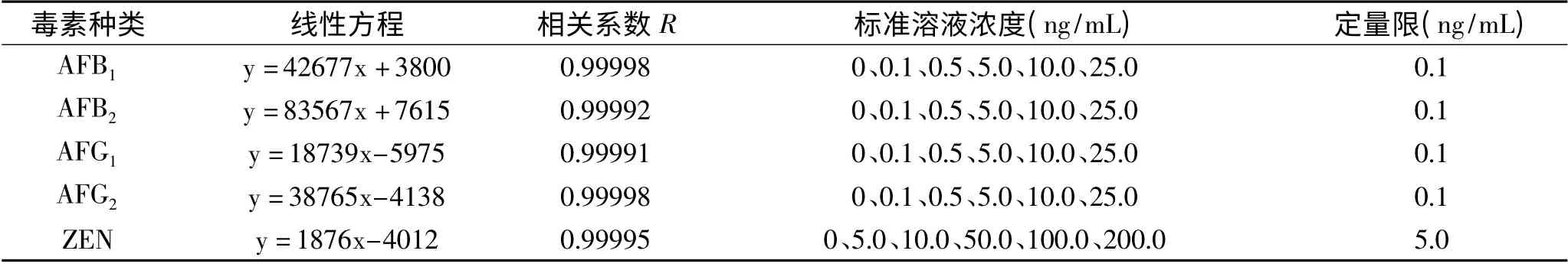
表1 黄曲霉毒素B1、B2、G1、G2、玉米赤霉烯酮的标准曲线值Table 1 Calibration curve values of aflatoxin B1,B2,G1,G2 and zearalenone standard solution
IAC-AZ 免疫亲和柱 北京中检维康技术有限公司,对黄曲霉毒素的柱容量为300ng,对玉米赤霉烯酮的柱容量为1200ng;甲醇、乙腈 色谱纯,美国JT BAKER 公司;1.5μm 玻璃纤维滤纸 美国VICAM公司;黄曲霉毒素混合标准溶液、玉米赤霉烯酮标准溶液 美国SUPLCO 公司;花生油、玉米油、芝麻油、调和油 从青岛、北京市场购得和企业赠送。
高效液相色谱仪配荧光检测器 型号L2000,日立公司;光化学衍生器 美国AURA INDUSTRIES 公司;多功能混合器 型号QB-206,海门市其林贝尔仪器公司;高速匀质器 型号FSH-2,江苏金坛荣华仪器公司。
1.2 液相色谱测定条件
测定黄曲霉毒素B1、B2、G1、G2的液相色谱工作条件:色谱分析柱:Cloversil ODS-C18柱,5μm,4.6mm×250mm;流动相:甲醇+ 水(45 +55,V/V);流速:1mL/min;进样量:20μL;柱温:25℃;荧光检测波长:激发360nm,发射440nm。
测定玉米赤霉烯酮的液相色谱工作条件:色谱分析柱:Cloversil ODS-C18柱,5μm,4.6mm ×250mm;流动相:乙腈+ 甲醇+ 水(46 +46 +8,V/V/V);流速:1mL/min;进样量:20μL;柱温:25℃;荧光检测波长:激发274nm,发射440nm。
1.3 实验方法
1.3.1 样品的提取 称取5.00g 样品于50mL 离心管中,加入25mL 提取液乙腈+水(90 +10,V/V),用多功能旋转混合器混合10min(或者用人工用手剧烈振荡3min,或用高速均质器均质1~2min),用中速定性滤纸过滤,收集全部滤液。
1.3.2 免疫亲和柱净化 取滤液10mL,用40mL 纯水液稀释、混匀后用玻璃纤维滤纸过滤,移取滤液20mL(相当于0.8g 样品)过IAC-AZ 免疫亲和柱免疫亲和柱,调节流速约1 ~2 滴/s,待溶液全部流出后,分别用10mL 的纯水以约2~3 滴/s 清洗免疫亲和柱,待溶液全部流出后。加入2mL 甲醇,调节流速约1~2 滴/s 的流速将免疫亲和柱中的黄曲霉毒素和玉米赤霉烯酮洗脱下来。
1.3.3 液相色谱的测定 将上述洗脱液,在50℃氮气下吹干,加入0.8mL 50%甲醇水溶液,混匀,注入液相色谱仪中进行分析。
2 结果与讨论
2.1 标准曲线的建立
按照1.2 的液相色谱测定条件,建立标准曲线。见表1。
应用液相色谱计算软件,以基线噪声10 倍峰面积对应的峰面积对应的五种毒素的含量作为定量限的规则(S/N =10),得出黄曲霉毒素B1、B2、G1、G2的定量限均为0.1μg/kg,玉米赤霉烯酮的定量限为5.0μg/kg。五种毒素的标准曲线的相关系数R 均大于0.9999,结果表明,黄曲霉毒素B1、B2、G1、G2在0.1~25.0ng/mL 范围内具有良好的线性关系;玉米赤霉烯酮在5.0 ~200.0ng/mL 范围内具有良好的线性关系。
2.2 准确性和重复性的实验结果
为了验证方法的准确性和可靠性,对测定方法进行加标回收和精密度测定。在空白样品中(调和油)分别添加黄曲霉毒素B1、B2、G1、G2、玉米赤霉烯酮三个浓度水平,然后进行5 次重复实验,其检测结果见表2。
从表2 中回收率及精密度数据可以看出,本方法测定黄曲霉毒素B1、B2、G1和G2回收率数据全部在82.0%~91.0%之间,室内三个水平添加五次重复的变异系数在10.4%以内。测定玉米赤霉烯酮回收率数据在83.7%~95.5%之间,室内三个水平添加五次重复的变异系数在7.9%以内。基本满足了定量检测对回收率和相对标准偏差的要求。
免疫亲和柱的高度选择性使样品前处理大为简化,本实验中用90%乙腈水提取,植物油中的黄曲霉毒素和玉米赤霉烯酮,提取液用纯水稀释5 倍后,经过免疫亲和柱净化,用水稀释的目的是减小有机溶剂乙腈对免疫亲和柱的亲和力的干扰。然后用10mL 纯水淋洗亲和柱,去除非特异性吸附杂质。最后用2mL 甲醇将特异性吸附的黄曲霉毒素和玉米赤霉烯酮洗脱到甲醇中。目标分析物得到分离纯化与富集,避免了提取液中干扰物质HPLC 测定的影响(色谱峰中除了样品峰和溶剂峰外,没有其它杂峰),净化效果见图1、图2。
2.3 实际样品的检测结果
花生油、玉米油、芝麻油、调和油各采集5 份共20个样本,分别进行检测。发现有三个花生油样品黄曲霉毒素总量分别为7.9、4.5 和3.8μg/kg,有1 个芝麻油样品中检测出黄曲霉毒素总量含量为3.5μg/kg,花生油和芝麻油中均未检出玉米赤霉烯酮。玉米油有2 个样本中检出有黄曲霉毒素,总量分别为2.7、7.8μg/kg,但所有样本均检出有玉米赤霉烯酮,含量为49.0~507.0μg/kg。调和油有1 个样品中检测出黄曲霉毒素总量含量为2.6μg/kg,3 个样本中检出有玉米赤霉烯酮,含量分别为10.6、27.2、49.5μg/kg。
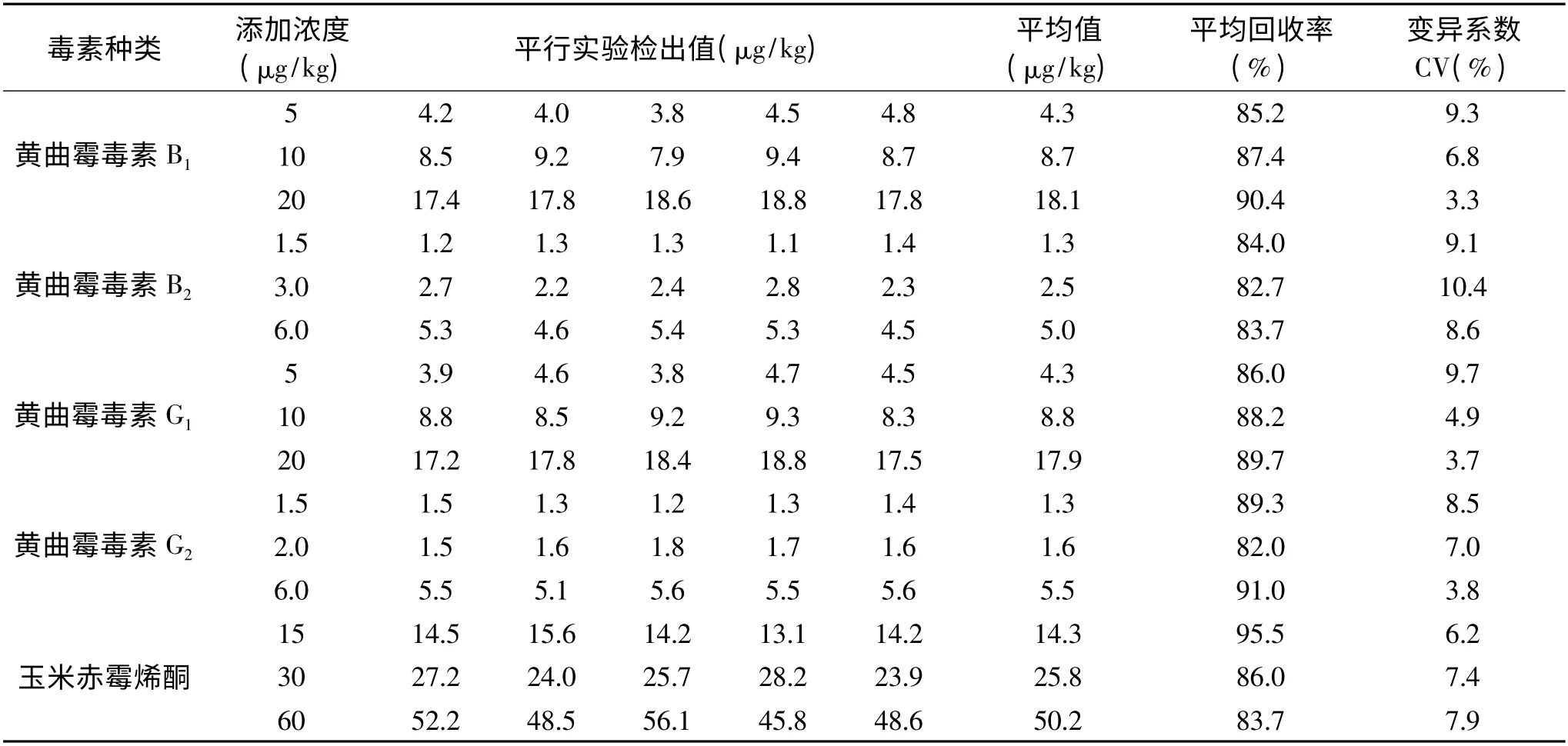
表2 准确性和重复性的实验结果Table 2 The accuracy and repeatability of the results
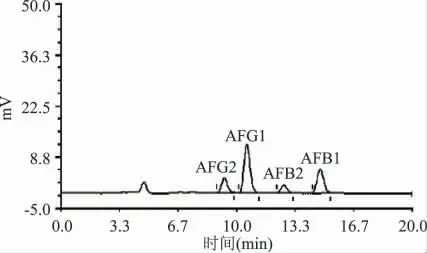
图1 花生油样品的免疫亲和柱净化-HPLC 法检测黄曲霉毒素的色谱图Fig.1 HPLC chromatogram of aflatoxins in peanut oil cleaning up by immunoaffinity column
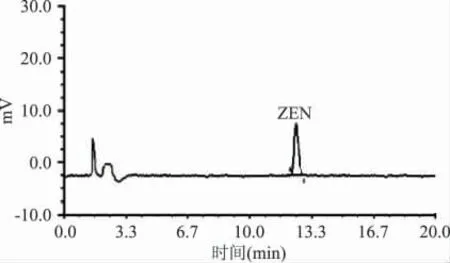
图2 玉米油样品的免疫亲和柱净化-HPLC 法检测玉米赤霉烯酮的色谱图Fig.2 HPLC chromatogram of zearalenone in corn oil cleaning up by immunoaffinity column
3 结论
免疫亲和柱作为样品前处理的方法是利用抗原抗体的高度特异性来进行样品的分离纯化与富集的,因此能有效地将干扰物质去除。采用免疫亲和柱作为样品前处理手段,减少了有机溶剂的使用和目标分析物的损失,具有结合容量大、回收率高、洗脱条件温和、可以方便地重复再生使用等优点。本实验很好的将免疫亲和柱技术应用到植物油中的黄曲霉毒素B1、B2、G1、G2和玉米赤霉烯酮的测定。减少了乙腈的使用,提高了样品的净化效果,并满足了定量检测对回收率和相对标准偏差的要求。
免疫亲和柱同时净化-高效液相色谱法荧光法检测了植物油中黄曲霉毒素B1、B2、G1、G2的方法的定量限分别为0.1μg/kg,玉米赤霉烯酮的方法的定量限分别为5.0μg/kg,相对标准偏差低于10.4%,回收率为82.0%~95.5%,其准确性和可靠性均可以满足欧盟[7]和中国[8]对黄曲霉毒素B1、B2、G1、G2和玉米赤霉烯酮定量分析方法标准的技术要求:回收率70%~110%,CV 小于21%。该方法可以简便快速、准确可靠、重复性好,可以用于对植物油中黄曲霉毒素B1、B2、G1、G2和玉米赤霉烯酮进行快速定量检测。
[1]张艺兵,鲍蕾,褚庆华.农产品中真菌毒素的检测分析[M].北京:化学工业出版社,2006:1-42.
[2]对(EC)No 1881/2006 条例中食品中黄曲霉毒素的最大限量值的修订[S].欧盟(EU)条例,(EU)No 165/2010。
[3]食品安全国家标准 食品中真菌毒素限量[S].中华人民共和国国家标准,GB 2761-2011.
[4]Bao L,Trucksess MW,White KD.Determination of aflatoxins B1,B2,G1,and G2 in olive oil,peanut oil,and sesame oil[J].J AOAC Int,2010,93(3):36-42.
[5]隋凯,李军,卫锋,等.免疫亲和柱-高效液相色谱法检测玉米中的玉米赤霉烯酮[J].中国卫生检验杂志,2006(6):22-23.
[6]李军,于一茫,田苗,等.免疫亲和柱净化-柱后光化学衍生-高效液相色谱法同时检测黄曲霉毒素、玉米赤霉烯酮和赭曲霉毒素A[J].色谱杂志,2006,24(6):581-584.
[7]Food analysis-Biotoxins-Criteria of analytical methods of mycotoxins[S].CEN(European Committee for Standardization),CR 13505-1999.
[8]出口商品中农药、兽药残留物及生物毒素检验方法编写的基本规定[S].中华人民共和国进出口商品检验行业标准,SN/T 0001-1995.
