响应面法优化猕猴桃原酒发酵工艺
2013-08-07霍丹群王洪彬宋兴兴侯长军
霍丹群,王洪彬,宋兴兴,刘 淼,何 诚,周 军,侯长军
(1.重庆大学生物工程学院,重庆400044;2.国家固态酿造工程技术研究中心,泸州老窖股份有限公司,四川泸州646000)
猕猴桃又名阳桃,果实皮薄多汁,酸甜可口,含有丰富的营养物质,如维生素、有机酸、糖分及Ca、Fe、K 等[1],素有“水果之王”的美誉[2]。研究发现,猕猴桃具有预防老年骨质疏松,改善心肌功能,防治心脏病等功效。中国是猕猴桃的故乡[3],栽培面积和产量分居世界第一和第四,由于猕猴桃不易贮存,成熟季节猕猴桃市场供大于求,除鲜食外,主要用于加工附加值较低的果汁、果脯、果酱等产品[4-6],因此开发猕猴桃新产品,推动猕猴桃产业发展势在必行。用猕猴桃生产果酒,其独特的保健作用和高附加值,不仅会受到消费者和生产者的喜爱,且顺应酒类产业政策转变(粮食酒向果酒转变,高度酒向低度酒转变,低档酒向高档酒转变)[7],具有广阔的发展前景。研究者们对猕猴桃果酒的发酵温度、二氧化硫添加量、装瓶量、接种量、原酒的后处理等工艺条件进行了研究[8-10],较多的沿用传统的残糖、总酸等作为理化指标,对于酿造工艺参数与猕猴桃酒香味物质含量(g/L)之间的关系研究较少。因此,本实验通过Box- Behnken 响应面法,采用猕猴桃酒酒精度(20℃)[11]及主要香味物质含量(g/L)作为双重响应值,得到二者与工艺参数之间的最优条件,为实现猕猴桃酒的工业化生产及其新产品的开发提供了基础研究资料。
1 材料与方法
1.1 材料与仪器
实验猕猴桃 四川长清;葡萄糖、碳酸钙 重庆博艺化学试剂有限公司;柠檬酸、亚硫酸 重庆川东化工(集团)有限公司;安琪葡萄酒用高活性干酵母湖北安琪酵母股份有限公司。
2010 型质谱仪GC-MS 岛津;DB-Wax 型色谱柱(30m ×0.25mm ×0.25μm) 安捷伦;恒温恒湿培养箱 上海森信;精密电子天平 梅特勒—托利多;糖度计 天津镜象仪器;酒精度计 河北武强仪表;PHS-3C 型精密酸度计 上海雷兹。
1.2 实验方法
1.2.1 猕猴桃原酒发酵工艺流程 猕猴桃鲜果→分选→清洗→破碎榨汁→调整果汁糖度→添加亚硫酸→调节pH→接种→前发酵→倒罐→去除酒脚→后发酵→降酸→陈酿→过滤→猕猴桃发酵原酒
1.2.2 发酵条件 初始糖度调整:根据需要的酒精度,以1.70g/L 糖产1°酒精计算所需要添加的葡萄糖量[12];亚硫酸的添加:以60mg/L 的SO2量添加[13];pH 的调整:添加柠檬酸或者碳酸钙[14];酵母活化:在猕猴桃果汁中按0.05g/mL 的量添加干酵母,搅拌溶解,38℃复水活化30min,冷却至30℃即可使用;前发酵:将调整好的猕猴桃果浆以70%的装瓶量在25℃下发酵,至发酵缪残糖≤4g/L[15]。降酸、陈酿:用酒石酸钾降酸至6.5g/L(柠檬酸计),陈酿30d。
1.2.3 发酵工艺最优参数的确定 在单因素实验时,固定其中两种因素不变,依次改变初始接种量、初始pH 和接种量;以酒精度(20℃)和主要香味物质含量为评价指标进行研究和分析,并确定三因素三水平的最佳参数进行响应面分析[16-21],共17 个实验点,5 个中心点重复实验,其中各因素及水平编码见表1。

表1 响应面实验因素水平编码表Table 1 Factors and levels of response surface experiments
1.2.4 猕猴桃原酒香气分析 异丁醇、3-甲基丁醇、甲醇、丁酸乙酯、乙酸乙酯、乳酸乙酯、乙酸、己酸、辛酸等是果酒中含量较高的微量物质[22],这对其风味物质特征的形成具有重要的作用,因此主要选择以上几种含量较高的微量物质最为总醇、总酯和总酸的代表物质作为香气成分分析的研究对象。
GC-MS 分析条件:色谱条件:以N2作为载气,柱流速为0.5mL/min;分流比为50∶1,尾吹约30~40mL/min;氢气流速为30mL/min;空气流速为300mL/min;检测器温度220℃;进样口温度220℃,程序升温条件为初始柱温40℃、保持4min,以4℃/min 的速度上升至200℃,保持10min。质谱条件:EI 电力源,电子能量为70eV,离子源温度为200℃,接口温度为250℃,扫描范围为30~50amu。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 初始糖度对猕猴桃酒发酵的影响 固定接种量为0.25%,pH3.31 不变,设置不同的初始糖度,研究其对猕猴桃酒发酵的影响,结果见图1、图2。酒精度与香味物质含量随着初始糖度升高而增大。从图1 可知,随着初始糖度的升高,酒精度成增加趋势,在初始糖度为25%之后基本上趋于稳定;从图2 可知,随着初始糖度的增加,总醇含量逐渐升高,并在初始糖度为25%达到最大;总酯和总酸含量变化不大;总香味物质含量逐渐升高势,在初始糖度为25%达到最大。综合考虑两种评价指标的最佳初始糖度,选取初始糖度22%、25%、28%做猕猴桃发酵酒的响应面分析以确定最佳的初始糖度。

图1 初始糖度对酒精度影响Fig.1 Influence of initial sugar content on alcohol content
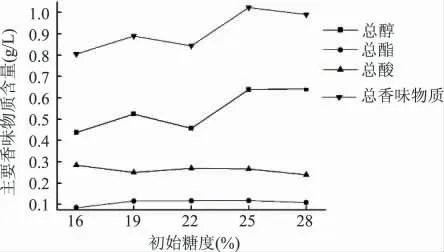
图2 初始糖度对主要香味物质的影响Fig.2 Influence of initial sugar content on main aroma components content
2.1.2 初始pH 对猕猴桃酒发酵的影响 固定接种量为0.25%,初始糖度为25%,设置不同初始pH,研究其对猕猴桃酒发酵的影响,结果见图3、图4。从图3 可知,随着pH 的升高酒精度逐渐增大,并在初始pH 为3.50 时酒精度达到最大;从图4 可知,随着初始pH 的升高,主要香味物质含量基本成先增加后降低的趋势,在初始pH3.50~4.50 之间,总醇和总酯的含量趋于稳定,总酸与总香味物质含量逐渐升高,而甲醇含量在pH4.00 之后快速增长,而甲醇含量过高容易对身体健康造成损害,因此应控制在较低的范围内。综合考虑两种评价指标的最佳初始pH,选取初始pH3.30、3.60、3.90 作猕猴桃发酵酒的响应面分析以确定最佳的初始pH。

图3 初始pH 对酒精度影响Fig.3 Influence of initial pH on alcohol content
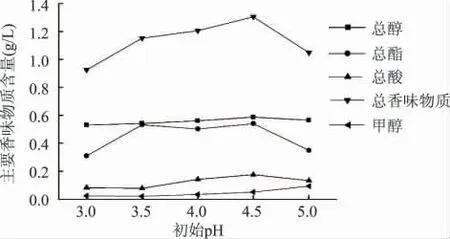
图4 初始pH 对主要香味物质的影响Fig.4 Influence of initial pH on main aroma components content
2.1.3 接种量对猕猴桃酒发酵的影响 固定初始糖度为25%,pH3.31 时,设置不同接种量,研究其对猕猴桃酒发酵的影响,结果见图5、图6。如图5 所示,随着接种量的增大,酒精度逐渐升高,并在接种量0.55%时达到最大,而后逐渐下降,其原因可能是较高浓度的酵母菌完成自身繁殖需要消耗大量的糖类物质,致使发酵液中转化为酒精的糖度降低,从而使酒精度偏低;从图6 可知,随着接种量的增大,主要香味物质含量基本成先增加后降低趋势,其中接种量0.35%~0.55%时,总香味物质含量相对较高。综合考虑两种评价指标的最佳接种量,选取接种量0.30%、0.45%、0.60%做猕猴桃发酵酒的响应面分析以确定最佳的接种量。
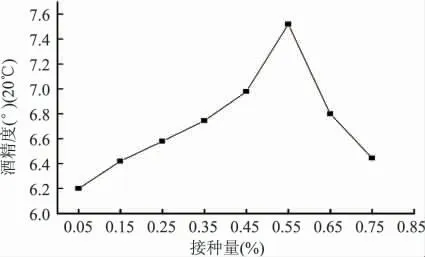
图5 接种量对酒精度的影响Fig.5 Influence of inoculation amount on alcohol content
2.2 响应面法提取条件的优化
2.2.1 响应面实验设计及结果 对猕猴桃酒发酵工艺进行响应面分析,其具体实验方案及结果见表2。
利用Design-Expert8.0 统计软件对该实验数据进行二次多项回归拟合,分别获得酒精度(WA)与总香味物质含量(WB)对自变量初始糖度(X)、初始pH(Y)、接种量(Z)的多元回归方程:

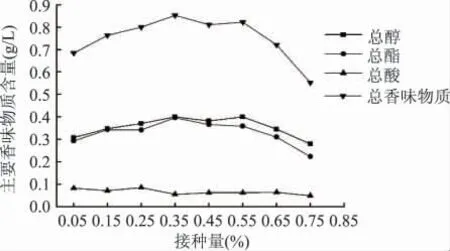
图6 接种量对主要香味物质的影响Fig.6 Influence of inoculation amount on main aroma components content


表2 猕猴桃酒发酵工艺优化实验设计及结果Table 2 Optimization of fermentation conditions design and results of experimental design
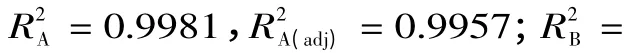
由表3、表4 可知,方程(1)中除XY 与YZ 项无显著影响外,其他项对酒精度的影响达到显著水平(p <0.05),其中一次项X、Y,交互项XZ 与二次项X、Y、Z 对酒精度的影响达到极显著(p <0.01);方程(2)中除X 项和YZ 项无显著影响外,其他项对总香味物质含量的影响达到显著水平(p <0.05),其中一次项Y、Z,交互项XZ 与二次项X、Y、Z 对总香味物质含量的影响达到非常显著(p <0.01)。另外,通过F 值的大小,可以推断在选定的实验范围内各因素对实验结果的重要性,F 值越大,其重要性越大,从表3中可知,各因素对酒精度的影响大小顺序是:初始糖度>初始pH >接种量;从表4 中可知,各因素对主要香味物质的影响大小顺序是:初始pH >接种量>初始糖度。

表3 方差分析结果(酒精度为响应值)Table3 ANOVE of regression analysis(alcoholic content as response value)
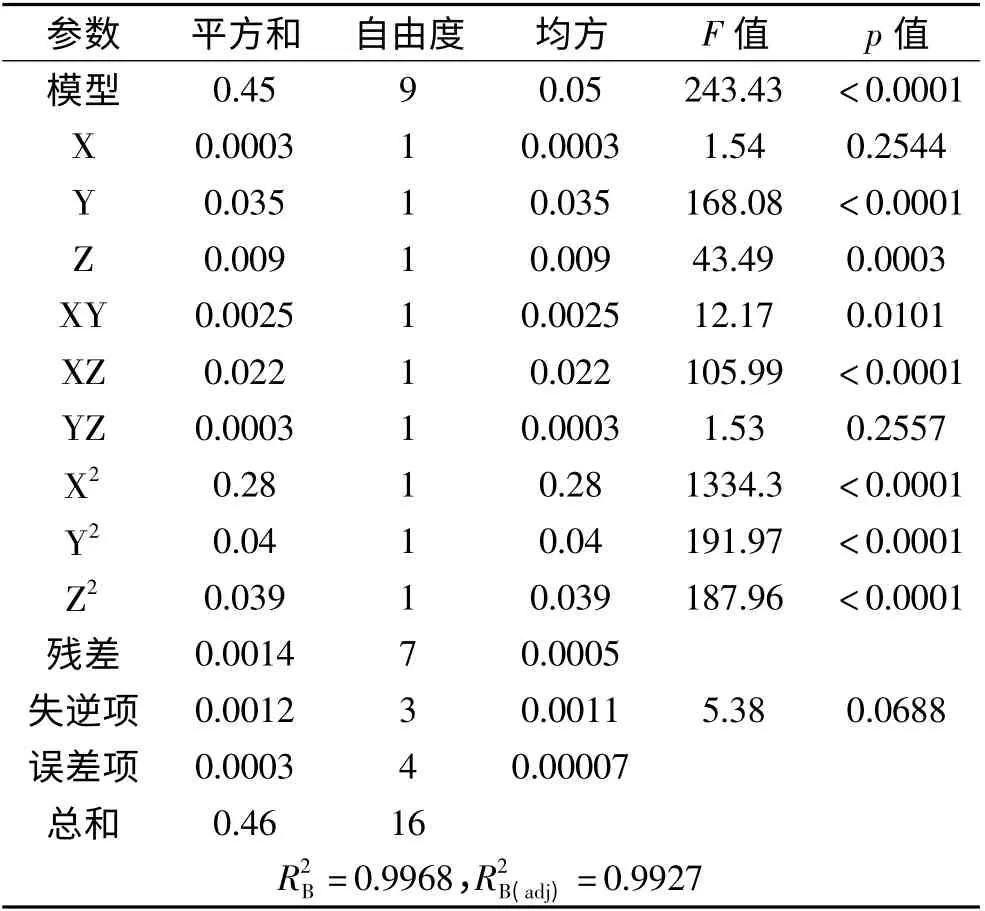
表4 方差分析结果(主要香味物质含量为响应值)Table4 ANOVE of regression analysis(the main aroma components content as response value)
2.2.2 各因素之间的交互作用 为探究3 个因素两两之间的交互作用对猕猴桃原酒发酵的影响,对其响应面曲线及等高线图进行分析,从图中可以直观看出优化区域,从而得到较高的酒精度和总香味物质含量。如图8~图13 所示,椭圆形等高线图表示两两之间的交互作用比较显著。其中图8~图10 表明初始糖度对猕猴桃原酒发酵酒精度的影响非常显著而初始pH 和接种量对猕猴桃酒精度的影响显著性不大,偏高或偏低的初始糖度都会使猕猴桃发酵酒精度降低。图11~图13 初始糖度对猕猴桃原酒发酵总香味物质含量的影响显著性不大而初始pH 和接种量对猕猴桃总香味物质含量的影响非常显著。
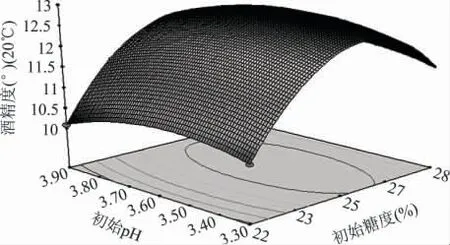
图8 初始糖度和初始pH 对酒精度影响的曲面图Fig.8 Response surface of initial sugar and pH on alcohol content

图9 初始糖度和接种量对酒精度影响的曲面图Fig.9 Response surface of initial sugar and inoculation amount on alcohol content
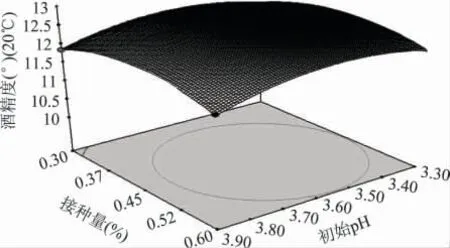
图10 初始pH 和接种量对酒精度影响的曲面图Fig.10 Response surface of initial pH and inoculation amount on alcohol content
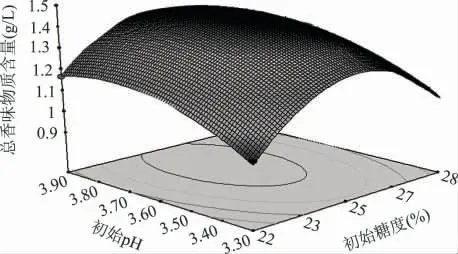
图11 初始糖度和初始pH 对总香味物质含量影响的曲面图Fig.11 Response surface of initial sugar and pH on total aroma components content
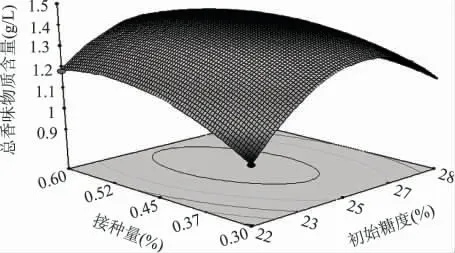
图12 初始糖度和接种量对总香味物质含量影响的曲面图Fig.12 Response surface of initial sugar and inoculation amount on total aroma components content

图13 初始pH 和接种量对总香味物质含量影响的曲面图Fig.13 Response surface of initial pH and inoculation mount on total aroma components content
2.3 猕猴桃原酒发酵工艺条件验证
通过Design-Expert8.0 统计软件联合求解模型方程(1)和(2),得出猕猴桃原酒发酵的最优参数条件:初始糖度25%,初始pH3.65,接种量0.47%。为检验响应面法所得到的结果的可靠性采用上述优化优参数进行猕猴桃原酒发酵,考虑到实际操作的便利,将猕猴桃原酒发酵工艺参数优化为初始糖度25%,初始pH3.6,接种量0.47%。根据此最优参数进行猕猴桃原酒发酵(n =3)以验证响应面法的可行性。实验结果显示,平均酒精度和总香味物质含量分别为12.75° 和1.42386g/L,与预 测值12.80° 和1.45131g/L 相差很小,表明该模型可以较好地反映出猕猴桃原酒发酵工艺条件,从而也证明了Box-Behnken 响应面法(RSM)优化猕猴桃原酒发酵工艺的可行性。
3 结论
本实验在单因素实验的基础上,采用Box-Behnken 响应面法(RSM)对猕猴桃原酒发酵工艺进行优化,得到二次多项式回归模型,探讨各因素间的交互作用,并对实验结果进行数学模拟和预测。最终确定了猕猴桃原酒发酵的最优参数:初始糖度0.25%,初始pH3.6,接种量0.47%,并且根据此条件得到的平均酒精度和总香味物质含量分别为12.75°和1.42386g/L。综合回归模型分析和验证实验,采用响应面优化的猕猴桃原酒发酵参数具有一定的实际应用价值。
[1]王燕.野生猕猴桃原酒发酵原料筛选与最佳配比研究[J].酿酒科技,2011(10):32-34.
[2]王励治,蒋和体.野生猕猴桃干酒酿造工艺[J].食品科学,2010(24):484-487.
[3]甘莆兵,郑永政,帅桂兰,等.猕猴桃酒的生产[J].酿酒,2007(2):64-66.
[4]李加兴,孙金玉,陈双平,等.猕猴桃果醋发酵工艺优化及质量分析[J].食品科学,2011(24):306-310.
[5]李加兴,袁秋红,陈建伏,等.猕猴桃果粒果汁饮料生产工艺及其稳定性研究[J].食品科技,2007(4):148-151.
[6]陈景,黄群,吴竹青,等.猕猴桃果醋运动保健饮料的研制[J].食品科学,2008(9):708-711.
[7]陈云宗,周瑞平,唐代云,等.猕猴桃原酒发酵工艺参数初步研究[J].酿酒科技,2009(10):78-79.
[8]彭帮柱,岳田利,袁亚宏,等.猕猴桃酒酿造工艺参数优化及其香气成分分析[J].农业工程学报,2007(2):229-232.
[9]罗晓妙,陈安均.猕猴桃酒的酿造与质量控制[J].酿酒科技,2004(4):75-77.
[10]贺小贤,孙宏民.液体发酵猕猴桃酒的研究[J].酿酒科技,2003(5):88-89.
[11]Jang SY,Woo SM,Kim OM,et al. Optimum alcohol fermenting conditions for kiwi (Actinidia chinensis)wine spectroscopy[J].Food Science and Biotechnology,2007,16(4):526-530.
[12]周桃英.猕猴桃果酒酿造工艺研究[J].江苏食品与发酵,2008(1):26-30.
[13]赵中胜,韦娜,富维纳,等.猕猴桃酒发酵工艺研究[J].安徽农业科学,2012(6):3548-3550.
[14]张明霞,张秀梅.固定化猕猴桃酒酵母发酵条件的研究[J].酿酒科技,2004(3):68-70.
[15]李加兴,姚茂君,张永康,等.猕猴桃酒生产工艺研究[J].吉首大学学报(自然科学版),1999(3):78-81.
[16]李伟桥,沐万孟,江波,等.响应面优化γ-谷氨酰甲胺酶法合成条件的研究[J].食品工业科技,2011,32(1):215-218.
[17]刘小艺,阚建全,阮志勇,等.应用响应面优化泡菜用微生物的富集培养基[J].食品工业科技,2011,32(5):183-189.
[18]张仁楠,姚磊,富校轶.响应面法优化植酸酶水解大豆分离蛋白的工艺[J].食品工业科技,2011,32(11):292-295.
[19]谢捷,曹铭希,朱兴一,等.响应面法优化闪式提取陈皮中橙皮苷工艺的研究[J].食品工业科技,2010,31(10):285-288.
[20]Sahin Selin,Samli Ruya.Optimization of olive leaf extract obtained by ultrasound-assisted extraction with response surface methodology[J]. Ultrasonics Sonochemistry,2013,20 (1):595-602.
[21]Fan J P,Cao J,Zhang XH,et al.Optimization of ionic liquid based ultrasonic assisted extraction of puerarin from Radix Puerariae Lobatae by response surface methodology[J].Food Chemistry,2012,135(4):2299-2306.
[22]梁新红,赵功玲.猕猴桃干酒香气成分的GC/MS 分析[J].安徽农业科学,2006(19):5022-5023.
