脂肪氧化酶对啤酒抗氧化性能的影响及其特性研究
2013-08-07方贵权李惠萍张五九
李 红,方贵权,李惠萍,李 琳,何 熙,张五九
(1.广州珠江啤酒股份有限公司技术中心,广东广州510308;2.华南理工大学轻工与食品学院,广东广州510640;3.中国食品发酵工业研究院,北京100027)
啤酒的风味稳定性不仅仅与成品啤酒的氧化有关,啤酒生产过程中的氧化反应也会对成品啤酒的风味稳定性产生重要的影响,因此控制啤酒生产过程中的氧化反应对提高啤酒抗氧化性能具有重要的意义。麦芽等啤酒酿造原料中含有较高的脂类物质(见表1)[1],因此脂肪酸的氧化长期以来都被认为是成品啤酒风味在储藏过程中发生劣化的重要途径之一[2]。啤酒酿造过程中的脂肪酸的氧化可以在酶催化的作用下发生,也可以在非酶催化的作用下发生,其中脂肪酸在酶催化下的反应称作脂肪酸的酶促氧化,而非酶催化下的反应称作脂肪酸的自动氧化[3]。要控制脂肪酸的氧化对啤酒的风味稳定性产生危害,一方面要控制原料中脂肪及脂肪酸的含量,另一方面要尽量减少脂肪酸的氧化反应。脂肪氧化酶广泛存在于植物当中[4-5],啤酒大麦中也不例外[6],成品麦芽中也含有较高的脂肪氧化酶活性。控制酿造过程中脂肪氧化酶的活性被认为是控制脂肪酸氧化提高啤酒风味稳定的重要措施之一[7-9],也是啤酒风味稳定性领域内的热点课题之一。
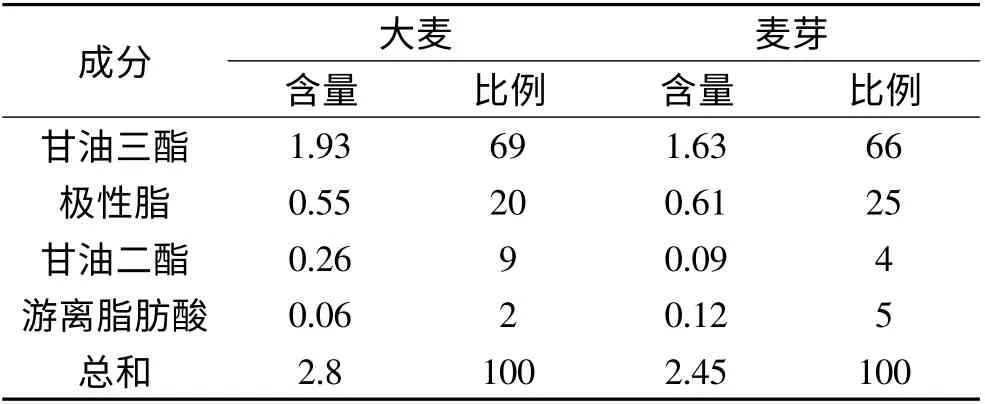
表1 大麦和麦芽的脂类的含量和组成(%)Table 1 Lipids in barley and malt(%)
脂肪氧化酶(英文为lipoxidase)能催化含有顺,顺-1,4-戊二烯残基的脂肪酸(如亚油酸和亚麻酸等)与氧气发生加合反应形成氢过氧化脂肪酸,因此脂肪氧化酶也称为脂肪氧合酶(英文为lipoxygenase,简写为LOX)。啤酒麦芽中的脂肪氧化酶有两种同功酶分别为LOX-1 和LOX-2[10-11],这两种酶的催化产物不同,例如当底物是亚油酸时,在LOX-1 的催化下形成9-LOOH,而在LOX-2 的催化下形成13-LOOH[1,12]。一般认为原大麦中只存在LOX-1,在制麦过程LOX-1 会增加,LOX-2 也会产生[6],但是经过焙焦之后的成品麦芽中也主要含有LOX-1 的酶活[2]。国外对脂肪氧化酶的研究起步较早,据报道丹麦嘉士伯的研究人员已培育出LOX 缺失的大麦,也有研究者选育出低LOX-1 的大麦并申请专利[13]。而国内对脂肪氧化酶的研究还基本处于空白,企业也没有采取相应的控制措施。本研究的主要目的是考察脂肪氧化酶对啤酒风味稳定性的影响,阐明其酶学性质并确定其酿造过程中的变化规律,为更好地控制脂肪酸的氧化,提高啤酒的抗氧化性能提供指导。
1 材料与方法
1.1 材料与仪器
麦芽、大米、酵母 均为国内某企业提供;脂肪氧化酶 生物试剂(460U/mg),Sigma;TBA 纯度≥99%,Merck;其他试剂均为国产分析纯。
DLFU- W23050 型麦芽粉碎机 德国Buhler universal;V3140 型分光光度计 澳大利亚GBC公司。
1.2 实验方法
1.2.1 实验室麦汁制备(模拟大生产工艺)
1.2.1.1 原料配比 麦芽48g(实验采用同一批麦芽),大米30g。
1.2.1.2 糊化 全部大米及1g 麦芽加50℃水90mL,添加耐高温α-淀粉酶0.1mL。糊化温度进程为70℃(5min)→90℃(30min)→100℃(5min)→与蛋白休止结束的糖化醪混合。
1.2.1.3 糖化 麦芽47g,加45℃水180mL。糖化温度进程为45℃(40min)→63℃(30min)→73℃(30min)→78℃(过滤)。过滤后加78℃水,定重至457g,在烧杯中煮沸30min。
1.2.2 300mL 发酵实验 取生产酵母泥适量接入300mL 麦汁中,12℃恒温发酵(带发酵栓)至发酵8d。
1.3 分析方法
1.3.1 麦汁或发酵液氧化程度的评价——TBA 值原理:样品氧化后产生的羰基化合物与TBA 反应生成的化合物在530nm 有吸收峰,在此波长下采用1cm 比色皿测定其吸光值,该吸光值称为TBA 值,可据TBA 值的高低比较样品的氧化程度[14-17]。
基本步骤:取10mL 啤酒在10000r/min 高速下离心到澄清。取上清液5mL,加入2mL 质量浓度为3.3g/L 的TBA 溶液(溶剂是体积分数为50%乙酸溶液),并混合均匀,在60℃水浴中精确加热60min,然后迅速冷却,于530nm 下比色,同时以水为空白,并用空白调零。
结果计算:用吸光值表示TBA 值,TBA 值越大表示氧化程度越严重。
1.3.2 脂肪氧化酶酶活的测定 采用亚油酸氧化法。酶活单位定义为:在室温和pH6.5 的条件下,以每分钟234nm 下吸光值增加1 的酶量为1 个活力单位。比酶活力:每g(固体样品)或每mL(液体样品)样品中所含的酶活单位。主要操作要点如下:
1.3.2.1 麦芽和大麦中酶的提取 取2.0g 麦芽粉碎(EBC 磨细粉)后,加入pH4.0 的0.1mol/L 磷酸缓冲液溶液20mL,震荡30min(室温下,150r/m)后,5000r/min 离心10min,上清液再过滤,低温储藏备用。
1.3.2.2 脂肪氧化酶的测定 在比色皿中加入3mL 0.1mol/L pH6.5 的磷酸缓冲液和0.2mL 5mmol/L 的亚油酸溶液,于234nm 下进行调零,迅速加入50μL酶液,同时开始计时,并进行吸光值扫描。
1.3.2.3 酶活的计算
脂肪氧化酶活力(U/g)=ΔOD234nm×V2/Δt ×V1×D ×V0/W
Δt-反应时间(min);V1-参与反应的酶液体积(mL),这里为0.05mL;V2-反应体系总体积(mL),这里为3.25mL;V0-提取液的体积(mL),这里为20mL;D-提取液的稀释倍数;W-样品的重量,这里为2g。
2 结果与讨论
2.1 麦芽中LOX 的活力
测定了51 个国内主要麦芽厂(包括广州麦芽厂、宁波麦芽厂、宝应麦芽及珠江麦芽厂)生产的普通淡色啤酒麦芽样品的LOX 的酶活,这些麦芽品种是目前国内啤酒企业广泛使用的品种。将检测结果按大麦种植国别进行简单归类,得到图1 所示结果。从图1 可以看出,普通淡色啤酒麦芽的LOX 的酶活在集中在7~20U/g 之间。每个国家种植的大麦制成麦芽之后,所得麦芽的LOX 的酶活均有较大的波动,这主要是因为每个国家种植的大麦品种本身就多样化,而且这些麦芽来自多个不同的麦芽加工企业。
就平均水平来看,澳麦和法麦显示出较低的LOX 酶活,而国产麦芽具有较高的LOX 酶活,而加麦的LOX 的酶活是进口麦芽中最高的。进行方差分析发现(表2),大麦的种植国对麦芽的LOX 的酶活性有统计学上显著影响。
另外还检测了1 个黑麦芽的LOX 的酶活,其酶活仅为2.8U/g,这说明麦芽的焙焦强度对成品麦芽的LOX 的酶活力也有重要的影响。

图1 麦芽中LOX 的酶活力Fig.1 LOX activity in malts
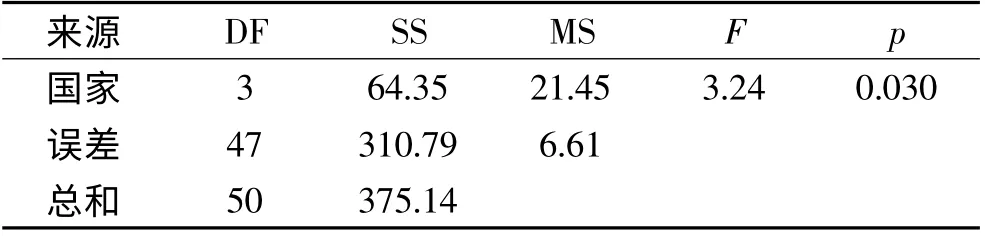
表2 不同国家麦芽LOX 的酶活方差分析结果Table 2 ANOVA of LOX activity in malts from different countries
2.2 LOX 对啤酒抗氧化性能的影响
为了弄清LOX 对啤酒抗氧化能力的影响,在实验室模拟大生产工艺制备13°P 麦汁,在蛋白休止阶段加入一定量的LOX,LOX 的添加量按每g 麦芽1U和5U 计,同时做不加LOX 的空白对照,并将所得麦汁在相同的条件下进行发酵,麦汁及发酵液的相关抗氧化指标见表3。
由表3 可看出,添加LOX 后麦汁的TBA 有较明显的增加,当LOX 的添加量为1U/g 时,麦汁的TBA增加8.2%,而当LOX 的添加量为5U/g 时,麦汁的TBA 的增加幅度达到27%,这说明LOX 在糖化过程的确会引起脂肪酸的氧化,从而导致麦汁的氧化程度加大,抗氧化性能下降。
从表3 还可以看出,LOX 不但对麦汁的TBA 有影响,对发酵之后的发酵液的TBA 也有影响,当LOX的添加量为1U/g 时,成熟发酵液的TBA 和空白相当,但是对LOX 的添加量为5U/g 的实验组来说,其发酵液的TBA 仍然最高,比对照组高12.2%。因此综合而言,麦芽中的LOX 在糖化过程中会引起脂肪酸的氧化,从而导致麦汁和成品啤酒的老化程度增加抗氧化性能下降。

表3 糖化添加LOX 对抗氧化性能的影响Table 3 Effect of LOX added at the start of mashing on antioxidation ability of wort and beer
2.3 麦芽LOX 的主要酶学性质
2.3.1 麦芽LOX 最适pH 为了确定麦芽LOX 的最适催化pH,以麦芽酶提取液作为研究对象,反应温度固定在25℃,在不同的pH 缓冲体系中进行催化反应,以酶活最高点作为基准,算出其他pH 下的LOX酶活的相对大小,结果见图2。从图2 可以看出麦芽中的LOX 在pH4.5~8.5 之内都有一定的酶活性,其中在pH6.5,酶活最高,为麦芽LOX 的最适pH。当pH 小于4 或高于9 时,LOX 几乎完全没有催化活性。
在实际生产的时候,糖化醪液的pH 通常在5.0~5.5左右,该pH 虽然偏离其最适pH6.5,但是在此pH 下LOX 仍有较强的活力,从图2 知在pH5.0 时,催化活性为最适pH 下的72%。

图2 麦芽中LOX 催化活性与pH 的关系Fig.2 Effect of pH on LOX activity of malt
2.3.2 麦芽LOX 的最适温度 为了确定麦芽中LOX的最适催化温度,以麦芽酶提取液作为研究对象,反应体系的pH 固定在6.5,在不同的温度下进行催化反应,以酶活最高点作为基准,算出其他温度下的LOX 的相对活性,所得结果见图3。从图3 可以看出麦芽中的LOX 在不同温度下的催化活性并没呈现出典型的对称的钟罩形,而是在20℃到40℃之间表现出平稳且较强的催化活性。
从图3 还可以看出,当反应温度小于20℃时,LOX 的催化活性急剧下降,例如15℃时酶催化活性仅残留27.9%,而当反应温度高于40℃时,LOX 的催化活性则平稳下降,45、50、55、60℃时,其催化活性残留率分别为58.7%、39.7%、20.1%、8.9%。因此在麦芽质量较好的情况下,糖化时尽量选择高温(50℃以上)下料,这样有利于降低LOX 的危害。

图3 麦芽中LOX 催化活性与温度的关系Fig.3 Effect of temperature on LOX activity of malt
2.3.3 麦芽LOX 的热稳定性 为了探明麦芽LOX的热稳定性,将麦芽的酶提取液分装成5 份,分别在40、50、60、70、80℃下进行保存,每隔一段时间测定LOX 酶活,并计算LOX 酶活残留率,所得结果见图4。从图4 可以看出随着温度的升高,麦芽LOX 的失活速度加快,特别是当温度超过50℃时,失活速度明显加快。在40℃下放置6h 其酶活降低31%,在50℃下放置6h 则降低82%,说明麦芽中的LOX 不耐高温,容易失活。

图4 LOX 的热稳定性Fig.4 Stability of LOX activity of malt
麦芽是大麦经过浸麦、发芽、干燥及焙焦等过程加工而成的,因此掌握制麦过程中LOX 的酶活变化规律对控制成品麦芽中的LOX 具有重要的意义。对50t 规模的大生产制麦过程中主要阶段的样品取样检测其中的LOX 的酶活,所得结果见图5。
从图5 可以看出大麦在浸泡之后,LOX 酶活仅为原大麦的64%左右,明显下降,很多研究者[6,18-19]也发现了类似的现象,究其原因,普遍认为是由于浸麦过程中氧气供应不足造成的。但在此之后的发芽过程中LOX 酶活一直保持较快的增长,直至发芽结束,发芽最后1d 的LOX 的酶活为原大麦的5 倍多。
发芽结束之后进入干燥阶段,此时LOX 的酶活开始下降。从图5 可以看出,在前期的自由水挥发阶段,LOX 酶活力下降缓慢,67℃结束时LOX 活力仅下降18%。干燥温度继续升至72℃时,进入中间干燥阶段,这时麦芽中的LOX 酶活下降幅度变快,当75℃结束时LOX 活力仅剩下32%。焙焦之后LOX活力进一步降低,甚至低于原大麦的LOX 活性。
2.4 制麦过程中LOX 的酶活变化特征
2.5 糖化过程中LOX 的酶活变化特征
糖化是麦芽中LOX 能够发挥催化作用的重要过程,弄清糖化过程中LOX 酶活的变化情况具有重要意义。对工业化大生产规模的啤酒糖化过程中LOX酶活进行跟踪检测,在检测的时候发现一个奇怪的现象,就是煮沸之后的麦汁中仍然能检测出轻微的LOX 酶活,为0.3U/mL 左右,这和LOX 不耐热的结论相矛盾。经查阅文献并研究分析,认为引起这种现象的原因是由LOX 酶活检测方法引起的,因此在分析糖化过程中的LOX 酶活时,均扣除此轻微背景值,并以下料时的酶活为基准,计算糖化各阶段的LOX 酶活相对大小,所得结果见图6。

图5 啤酒大麦制麦过程中LOX 的酶活Fig.5 LOX activity of barley during malting process
从图6 可以看出,麦芽醪液经42℃蛋白休止后,LOX 酶活仅剩32%,当醪液温度升至63℃时,LOX几乎全部失活,和前人的研究结果相似[20]。这些结果表明糖化过程中的麦芽下料、蛋白休止及升温至糖休止等阶段是LOX 氧化脂肪酸的重要过程。因此提高糖化下料温度并缩短糖化下料时间,提高蛋白休止温度有利于控制LOX 的催化氧化作用。

图6 大生产糖化过程中LOX 的酶活Fig.6 Change of LOX activity during brewing on production scale
3 结论
3.1 啤酒麦芽中含有一定的脂肪氧化酶,其活性受麦芽品种和焙焦强度影响,相对而言,澳大利亚和法国大麦制成的麦芽的脂肪氧化酶活性较低,国产大麦制成的麦芽其脂肪氧化酶往往较高,另外,提高焙焦强度可以降低成品麦芽脂肪氧化酶的活性。
3.2 脂肪氧化酶的存在的确会引起脂肪酸的氧化,导致啤酒的老化程度提高,抗氧化性能下降。
3.3 麦芽的脂肪氧化酶在pH4.5~8.5 之间均有一定的活性,其中在pH6.5,酶活最高,为最适pH,当pH小于4 或高于9 时,LOX 的催化活性几乎完全被抑制。麦芽的脂肪氧化酶在20℃到40℃之间表现出平稳且较强的催化活性,但当反应温度小于20℃时,脂肪氧化酶的催化活性急剧下降,而当反应温度高于40℃时,脂肪氧化酶的催化活性则平稳下降,这可能是由于麦芽中含有两种脂肪氧化酶同功酶。麦芽的脂肪氧化酶在50℃以内,表显出较强的热稳定性,但是当温度在60℃及以上时则迅速失活。
3.4 大麦经过浸麦之后,其中的脂肪氧化酶活性下降,但是之后的发芽阶段迅速增加,发芽最后一天酶活为原大麦的5 倍,但是经过焙焦之后,酶活又大幅度下降,甚至低于原大麦的脂肪氧化酶活性。
3.5 在糖化过程中,当醪液的温度低于60℃时,醪液中能检测出脂肪氧化酶的活性,是脂肪氧化酶催化氧化脂肪酸的关键阶段。
[1]Boivin P.Pro-and anti-oxidant enzymatic activity in malt[J].Cerevisia,2001,26(2):109-115.
[2]Vanderhaegen B,Neven H,Verachtert H,et al.The chemistry of beer aging-a critical review[J].Food Chemistry,2006,95(3):357-381.
[3]Bamforth C W.Enzymic and non-enzymic oxidation in the brewhouse:A theoretical consideration[J].Journal of the Institute of Brewing,1999,105(4):237-242.
[4]Pinto Mdel C,Tejeda A,Duque A L,et al.Determination of lipoxygenase activity in plant extracts using a modified ferrous oxidation-xylenol orange assay[J].J Agric Food Chem,2007,55(15):5956-9.
[5]Patui S,Peresson C,Braidot E,et al.Lipoxygenase distribution in coffee(coffea arabica l.)berries[J].J Agric Food Chem,2007,55(20):8223-30.
[6]Baxter E D.Lipoxidases in malting and mashing[J].Journal of the Institute of Brewing,1982,88(6):390-396.
[7]Hirota N,Kuroda H,Takoi K et al.Brewing performance of malted lipoxygenase-1 null barley and effect on the flavor stability of beer[J].Cereal chemistry,2006,83(3):250-254.
[8]Hirota N,Kuroda H,Takoi K,et al.Development of novel barley with improved beer foam and flavor stability-:The impact of lipoxygenase-1- less barley in the brewing industry[J].Technical quarterly-Master Brewers Association of the Americas,2006,43(2):131-135.
[9]Bamforth C,Clarkson S,Large P.The relative importance of polyphenol oxidase,lipoxygenase and peroxidases during wort oxidation[C]. Proceedings of the Congress of the European Brewery Convention,Lisbon,1991:617-624.
[10]Yang G,Schwarz P B.Activity of lipoxygenase isoenzymes during malting and mashing[J].Journal of the American Society of Brewing Chemists,1995,53(2):45-49.
[11]Roberto B d A,Leif-Alexander G,Renate N,et al.Regioand stereoselectivity of malt lipoxygenases lox1 and lox2[J].Journal of the Institute of Brewing,2005,111(3):265-274.
[12]Liégeois C,Meurens N,Badot C,et al.Release of deuterated(e)- 2 - nonenal during beer aging from labeled precursors synthesized before boiling[J].Journal of Agricultural and Food Chemistry,2002,50(26):7634-7638.
[13]Douma A C,Doderer A,Cameron- mills V,et al. Low lipoxygenase 1 barley:US,20030167544A1[P].20030904.
[14]Grigsby J H,Palamand S R.Studies on the staling of beer:The use of 2-thiobarbituric acid in the measurement of beer oxidation[J]. Journal of the American Society of Brewing Chemists,1976,34(2):49-55.
[15]Parsons R,Cope R.The assessment and prediction of beer flavor stability[C].Proceedings of the Congress of the European Brewery Convention,London,1983:279-286.
[16]靳纪培,董建军,刘景,等.啤酒风味老化评价的研究进展[J].食品工业科技,2008,29(7):273-276.
[17]McGivney K.Tba test as an indicator for flavour stability:Thiobarbituric acid index for wort and beer[J].Journal of the American Society of Brewing Chemists,2008,66(4):264-265.
[18]Schwarz P B,Pyler R E.Lipoxygenase and hydroperoxide isomerase activity of malting barley[J].Journal of the American Society of Brewing Chemists,1984,42(2):47-53.
[19]Kaukovirta-Norm A,Laakso S,Reinikainen P,et al.Lipolytic and oxidative changes of barley lipids during malting and mashing[J].Journal of the Institute of Brewing,1993,99(5):395-403.
[20]Frederiksen A M,Festersen R M,Andersen M L.Oxidative reactions during early stages of beer brewing studied by electron spin resonance and spin trapping[J].Journal of Agricultural and Food chemistry,2008,56(18):8514-8520.
