毕赤酵母表达鼠李糖苷酶的甲醇流加方式优化
2013-08-07陈文亮
陈 多,张 湜,* ,陈文亮,严 明
(1.南京工业大学自动化与电气工程学院,江苏南京210000;2.南京工业大学生物与制药工程学院,江苏南京210000)
鼠李糖苷酶在食品、医药、化工等行业有着广泛的应用,在食品工业中,其常被用于去除果汁中柚皮甘的苦味[1]。毕赤酵母(Pichia Pastoris)是一种广泛应用于发酵工程的真菌。已报道的利用毕赤酵母进行分泌表达的外源蛋白(recombinant proteins;rprotein)已达到400 多种[2-3]。经过改造的毕赤酵母可以高效的表达鼠李糖苷酶。毕赤酵母不仅外源蛋白的表达量高,而且目标蛋白的表达纯度也相当的高[4]。毕赤酵母有上述诸多优点,但其碳源甲醇具有较强毒性。过高的甲醇浓度不仅会降低毕赤酵母的表达效率,更有可能造成菌体的大面积死亡[4]。如何控制甲醇流加速率使得毕赤酵母既能正常分泌外源蛋白又不至于被甲醇杀死是目前的实际生产中必须面对的问题。目前常用的的甲醇流加方式有:a.、恒速流加;b.、指数流加[5];c.、变速流加[6]。方法a 实现方式简单,但效率相对较低;方法b 考虑到了菌体的生长特性:指数生长[7];方法c 利用反馈控制实现限制性底物浓度恒定[8],但在实际生产过程中,其实现有很大难度,原因在于很多的中间参数较难在线测得,如:菌体浓度、底物浓度[9]、呼吸商[10]等等。本文提出一种基于模型的最优控制方法。其特点在于:只要有了合理的模型结构,就能求出使得目标函数值最大的控制轨迹。因此,首先需要建立系统结构模型[5,11],而后确定目标函数,最后将最优控制问题化为微分代数方程(DAEs)求解问题。事实证明,此种方法可有效提高目标蛋白产量。
1 材料与方法
1.1 材料与仪器
P.Pastoris Invitrogon 公司GS115 Mut + 甲醇营养型毕赤酵母;培养基 按照文献[12]配制。
New Brunswick Scientific Bio110 型连续补料发酵罐 美国NBS 公司;Eppendorf 5415 R 型冷冻离心机、Eppendorf BioP plus 型酶标仪 德国Eppendorf 公司;UV1700 系列紫外可见分光度仪 上海奥析仪器有限公司。
1.2 实验方法
从琼脂培养基上挑取适量P.Pastoris 菌体接入装有10mL 种子液培养基的50mL 摇管中,置于30℃,800r/min 摇床中,培养16h。
将摇管中的菌液转接入3 个配有100mL YPD 培养基的锥形瓶中,置于30℃,800r/min 摇床中,培养12h。
按照10%的接种量将种子液转接入装有3L 发酵液的5L 发酵罐中。
pH 设定值5.0,氨水调节pH,温度设定30℃,融氧设定值25%并关联转速。
甘油阶段24h,甘油采用指数流加,流加速率为Q =0.39e0.18t(L/h),甘油流加24h 后,饥饿0.5h。
甲醇诱导时间为30h。
甲醇流加曲线的实现在Bio110 型高级发酵罐配套的 Supervisory Control and Data Acquisition(SCADA)software programs 上实现。
1.3 检测方法
诱导过程中每隔2h,取发酵液10mL,8000r/min冷冻离心机离心5min,取上清液。
酶标仪在600nm 处测定鼠李糖苷酶浓度;利用分光度仪在595nm 处根据BradFord 法测定总蛋白量。
2 结果与讨论
2.1 最优化问题的建立
构建以下非线性系统[5,13]:
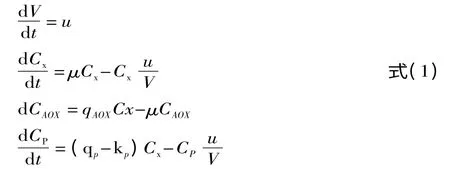
其中,V 为发酵罐总体积,CX为菌体浓度,CAOX为启动子AOX1 浓度,CP为目标蛋白浓度;μ 为菌体比生长速率:

qAOX为启动子AOX1 比生产速率:

qM为甲醇比消耗速率:

qp为产物比生产速率:

方程参数见表1。
令V~x1,CX~x2,CAOX~x3,CP~x4,u~x9
构造非线性泛函并描述最优控制问题如下[13]:
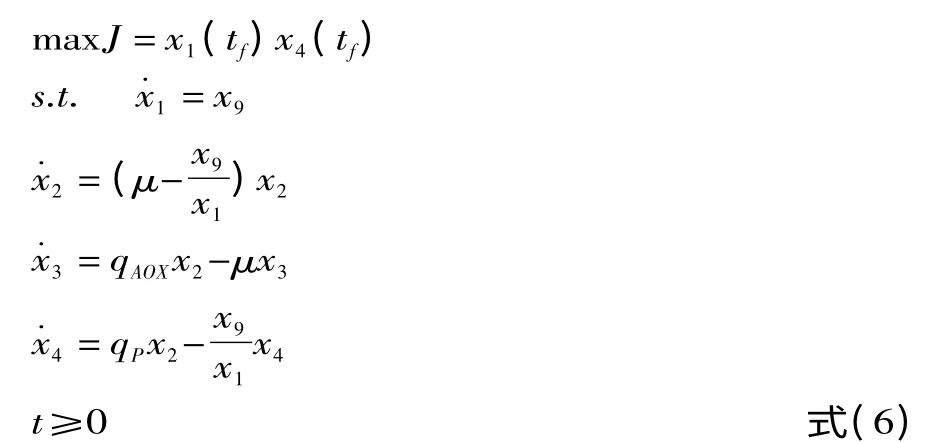
为简化方程起见,x4(产物浓度)方程忽略蛋白的降解对浓度造成的影响,即令原式(1)中蛋白质降解常数kP为0。

表1 模型参数Table 1 Model Parameters
根据泛函求极值及变分法相关定理构建非线性Hamilton 函数为:

根据泛函极值存在条件知[13]:

令λ1、λ2、λ3、λ4为x5、x6、x7、x8,得到如下DAEs(微分代数方程)问题:

此DAE 问题的阶数大于1,直接求解非常困难,故将代数方程进行改写,提取因子x1,构建x9′(即x1″)(x9′结构复杂,此处略去)。
由此,问题转化为λ 初值选取问题。循环调用排列组合表(表2)作为λ 初值,代入ODE45 进行求解。λi(i =1,2,3,4)取值范围为0~10,步长为0.5,编写程序循环求解并比较结果。
2.2 优化的甲醇流加轨迹求取
设置 终 端 时 间 tf= 30h,运 用 Matlab 进行ODE45。

表2 部分λ 取值表Table 2 Partial λValue(Full Length:194481 lines in this paper)
分析结果,x1(tf)x4(tf)的最大值出现在λi(i =1,2,3,4)的初值取(8.5、5、0、10)处,由此所得的甲醇流加曲线如图1 所示。

图1 最优甲醇流加速率曲线Fig.1 Optimal Curve of methanol
利用Origin 对迭代生成的x9离散值进行曲线拟合,R2=0.991。
2.3 实验数据比较
分别用三种不同流加方式进行上罐实验,初始流加速率均为0.02L/h。结果如下:
对比三组实验数据(表3),我们可以看出,恒定流加产量很低;相对于指数流加,最优化算法所得的流加方式使得鼠李糖苷酶产量分别提高了约15%。

图2 三种流加方式的外源蛋白表达浓度Fig.2 r-protein concentration of three strategies

表3 三组实验数据Table 3 Three Practice Data

图3 三种流加策略的外源蛋白表达量Fig.3 r-protein quantity of three strategies
观察3 组实验结果,第三种方法的产量明显高于前两种。
3 结论
本文提出了一种基于最优控制理论来提高P.Pastoris 酵母表达外源蛋白产量的方法,此种方法相比于恒定流加和指数流加都有一定提高。
需要说明的是,此种方法通过循环模拟不同乘子λ 的迭代求解的结果不一定是最优解,需要补充验证。文中只是给出了乘子λ 一段较小的范围:0~10。原因在于随着λ 范围的增大或者步长的缩小,其运算复杂程度大大提高。想要获得更优的控制曲线,需要更大范围的乘子运算;此外,模型的精确性也会直接影响到此方法的实际效果。
[1]李和生,王鸿飞,周石磊,等.柑橘类果汁中的柚皮苷分析[J].农业机械学报,2006,37(4):76-79.
[2]James M.Cregg.389 Pichia Protocols,Second Edition.http://jamesmcregg.blogspot.com
[3]Boris R,Borut S,Dirk B,et al. Jongsma. Expression,Purification,and Characterization of Equistatin in Pichia pastoris[J]. Protein Expression and Purification,2000,19 (3):329-334.
[4]Carmen J,Ian M,Urs V S.Regulation of alcohol oxidase of a recombinant Pichia pastoris Mut + strain in transient continuous culture[J].Journal of Biotechnology,2007,130(3):236-246.
[5]Eda C,Pinar C,Stephen G O A structured kinetic model for recombinant protein production by Mut +strain of Pichia pastoris[J].Chemical Engineering Science,2009,64(6):5028--5035.
[6]Kaoru K,Shinobu K,Tomoshi O,et al.High level Secretion of Recombinant Human Serum Albumin by Fed-Batch Fermentation of the Methylotrophic Yeast,Pichia pastoris,Based on Optimal Methanol Feeding Strategy [J]. Journal of Bioscience and bioengineering,2000,90(3):280-288.
[7]Zheng J,Zhao W,Guo N,et al.Development of an industrial medium and a novel fed-batch strategy for high-level expression of recombinant b-mananase by Pichia pastoris[J].Bioresource Technology,2012,118(7):257-264.
[8]Pınar C,Merve S,Hatice T,et al.Dynamic flux balance analysis for pharmaceutical protein production by Pichia pastoris:Human growth hormone [J].Journal of Biotechnology,2011,48(3):209-216.
[9]Jonas S,Ian W M,Urs V S.A simple method to monitor and control methanol feeding of Pichia pastoris fermentations using mid-IR spectroscopy[J].Journal of Biotechnology,2007,128(2):344-353.
[10]Liang JM,Yuan JQ.Oxygen transfer model in recombinant Pichia pastoris and its application in biomass estimation.Biotechnology Letter,2007,29(1):27-35.
[11]Rena H T,Yuan JQ.Macrokinetic model for methylotrophic Pichia pastoris based on stoichiometric balance [J].Journal of Biotechnology,2003,106(1):53-68.
[12]New Brunswick Scientific Edison.P.pastoris Fermentation using a BioFlo ® 110 Benchtop Fermentor. NJ USA. http//:www.nbsc.com.
[13]吴寿章.最优控制理论与应用[M].北京:机械工业出版社,2008:57-102.
