羟自由基氧化系统对体外模拟体系中NDMA 合成反应的影响
2013-08-07黄宗海孟培培孙卫青朱迎春马俪珍
黄宗海,孟培培,孙卫青,朱迎春,杨 华,王 瑞,马俪珍
(1.天津农学院食品科学系,天津300384;2.山西农业大学食品科学与工程学院,山西太谷030801;3.长江大学生命科学学院,湖北荆州434023;4.天津农学院农业分析中心实验室,天津300384;5.天津市农副产品深加工技术工程中心,天津300384)
在肉品加工中,发色剂亚硝酸盐在一定条件下与胺类物质反应会产生亚硝胺。亚硝胺是毒性和危害作用很强的一类化合物[1-2],所以了解亚硝胺形成的主要影响因素及作用方式并能有效地抑制,是肉类制品质量安全研究的重要课题之一。影响各种亚硝胺形成的因素是多方面的,包括肉基质环境的氧化还原电位、底物浓度、pH、温度、离子强度等[3]。其中最主要的是内环境中的氧化体系。亚硝酸盐作为食品添加剂加入后,存在于肉这个复杂的氧化体系中,参与其中的反应。氧分子通过一个电子的减少,产生超氧阴离子自由基、氢过氧自由基、过氧化氢、羟自由基等,直接或间接参与肉和肉制品的氧化过程[4]。H2O2激活的高铁肌红蛋白和血红蛋白可以氧化一系列的化合物,并导致蛋白质聚合[5]。肌红蛋白和血红蛋白中的Fe2+、Fe3+被H2O2激活,形成一种非常短暂的Fe4+或酮基铁自由基[6]。在羟自由基氧化系统中,Fe3+和抗坏血酸(Asc)反应形成Fe2+,之后再和H2O2反应形成羟自由基,具有强氧化性。由于Asc 的存在,Fe3+不断被还原,使反应持续进行[7]。由于肉品中这些氧化体系的存在,可能会影响到其中亚硝胺的生成。但是,这个氧化系统是如何影响亚硝胺生成的,在所能检索到的国内外文献范围内未见报道。本研究设计羟自由基氧化系统,研究氧化体系的条件改变对二甲基亚硝胺(N -Nitrosodimethylamine,NDMA)形成的影响情况。本文主要研究不同条件的羟自由基氧化系统中,亚硝酸盐和二甲胺(Dimethylamine,DMA)反应生成NDMA的反应情况。实验以二甲胺和亚硝酸钠(NaNO2)为反应底物,考察H2O2浓度、FeCl3浓度、反应时间和反应温度对NDMA 生成量的影响,为进一步研究肉品氧化体系中脂肪氧化、蛋白氧化与亚硝胺形成之间的关系奠定基础。
1 材料与方法
1.1 材料与仪器
磷酸氢二钠、柠檬酸、二氯甲烷 天津市北方天医化学试剂厂;亚硝酸钠(NaNO2)、二甲胺盐酸盐(DMA)、FeCl3、抗坏血酸(ascorbic acid,Asc) 国药集团化学试剂有限公司;H2O2天津市江天化工技术有限公司;氨基磺酸铵 天津基准化学试剂有限公司;丁基羟基茴香醚(BHA)、乙二胺四乙酸(EDTA) Sigma 试剂公司;Trolox 东京化成工业株式会社;硫酸 固安县清远化工厂,以上试剂均为分析纯;配制溶液用水均为超纯水。
GC/MS 气相色谱- 质谱联用仪(Agilent GC7890A/MSD5975C,配7693 自动进样器) 美国Agilent 公司;UPW-50S 型超纯水机 北京市历元电子仪器技贸公司;KQ-500DE 型数控超声波清洗器昆山市超声仪器有限公司;PB-10 酸度计Sartorius;HH 数显恒温水浴锅 江苏金坛市金城国胜实验仪器厂;LAB DANCER S25 漩涡混合器IKA。
1.2 实验方法
1.2.1 体外模拟反应系统的制备 在15mL 的缓冲液(内含50mmol/L 磷酸氢二钠-25mmol/L 柠檬酸的缓冲液,pH3.3)中依次加入8mmol/L NaNO2和DMA(最终浓度)和不同浓度的氧化体系(FeCl3/Asc/H2O2)[8-9],最后用缓冲液定容至25mL,摇匀后倾入100mL 带盖离心管内,放入恒温水浴中进行加热反应(按照实验设计反应的温度和时间),反应结束后取出、冷却、转移到分液漏斗中,立即加入1mmol/L BHA/Trolox/EDTA(三者最终浓度均为1mmol/L,目的是终止氧化反应[10])和3mL 100mmol 氨基磺酸铵溶液和1mL 硫酸溶液(1∶3)(目的是终止NaNO2和DMA 之间的亚硝化反应[11])。最后,在分液漏斗中加入10mL 二氯甲烷(分两次萃取),反复振摇以萃取其中的NDMA,将从分液漏斗收集的2 次二氯甲烷混匀,并用硫酸钠干燥除去其中混有的少量水分,过滤除去硫酸钠,用二氯甲烷冲洗硫酸钠,将冲洗液与二氯甲烷萃取液混合后定容至10mL 容量瓶中。用气相色谱-质谱(GC-MS)联用仪测定其中NDMA 含量。色谱图见图1 所示。
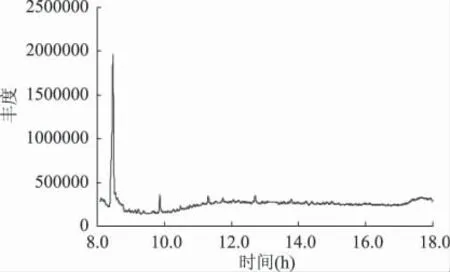
图1 NDMA 标准品的色谱图Fig.1 The GC chromatogram of NDMA standard
1.2.2 过氧化氢/铁/抗坏血酸(H2O2/Fe/Asc)氧化反应系统的制备 该系统可以产生活性氧自由基(reactive oxygen species,ROS),为羟基自由基(·OH)产生的氧化系统(hydroxyl radical-generating system,HRGS),主要由FeCl3、Asc 和H2O2通过铁离子的氧化还原反应而产生。FeCl3、Asc 和H2O2的具体浓度详见表1 所示。
1.2.3 色谱条件 色谱柱:DB-WAX 毛细管色谱柱(30m ×250μm ×0.25μm),美国Agilent 公司;升温程序:初始50℃,保持4min,以10℃· min-1升至120℃,保持7min,后运行180℃,3min;进样口温度:250℃;载气:He;流速:1.1971mL·min-1;进样模式:不分流进样;进样量:1μL。
1.2.4 质谱条件 离子源温度:230℃;四级杆温度:150℃;接口温度:250℃;电离方式:电子轰击离子源;电子能量:70eV;电子倍增器电压:1253V;质量数扫描范围:30~150;溶剂延迟:8min;阈值:0;特征碎片峰:42、43;定量离子:74。
1.3 实验设计
本实验按照以下6 个实验进行设计,同时做试剂空白,详见表1 所示。
1.4 数据统计分析
实验重复3 次,结果取平均值。数据采用Statistix8.1 软件包中Linear Models 程序进行,差异显著性(p <0.05)分析使用Tukey HSD 程序。绘图软件采用SigmaPlot 9.0。
2 结果与分析
2.1 不同FeCl3 浓度下,H2O2 浓度变化对NDMA合成的影响
不同FeCl3浓度下,随着H2O2浓度的变化,NDMA 含量变化情况见图2。

表1 实验设计方案Table 1 The design of the experiment
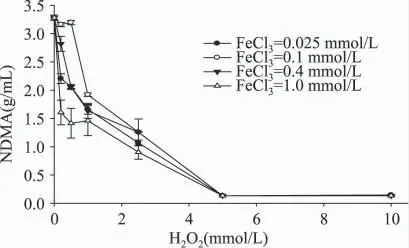
图2 不同FeCl3 浓度下,H2O2 对NDMA 生成量的影响Fig.2 The content of NDMA changes with the H2O2concentration on the FeCl3concentration
由图2 可以看出,体系中四种不同FeCl3浓度下,NDMA 的生成量均随着H2O2浓度的增大而迅速减小,H2O2浓度为0mmol/L 时,NDMA 含量为3.3μg/mL,当H2O2浓度升高至5mmol/L 时,NDMA的量已经降为0.2μg/mL,下降了93.9%,之后随着H2O2浓度的增大,NDMA 的生成量趋于平稳,变化不显著。不同处理组之间,在H2O2浓度较低时(<2.5mmol/L),NDMA 的生成量在不同FeCl3浓度下组间差异显著(p <0.05),在H2O2浓度低于2.5mmol/L时,不同FeCl3浓度的处理组之间,NDMA 生成量组间差异显著(p <0.05),且并非FeCl3浓度越高,NDMA 生成量越少;当H2O2浓度大于2.5mmol/L 时,NDMA 生成量组间差异不显著(p >0.05);当H2O2浓度大于5mmol/L 时,FeCl3浓度变化对NDMA 生成量影响不大。
2.2 不同H2O2 浓度的羟自由基氧化体系中,NDMA 合成量随反应时间变化的变化情况
FeCl3浓度固定(0.4mmol/L),H2O2浓度分别为0.1、1、2mmol/L 时,氧化反应体系中NDMA 生成量随时间变化的结果见图3。

图3 不同H2O2 浓度随反应时间变化对NDMA 生成量的影响Fig.3 The content of NDMA changes with the time on the H2O2concentration
由图3 可以看出,随着氧化反应时间的延长,NDMA 生成量均呈增加的趋势,但增加的幅度不同。反应开始后1~2h,不同H2O2浓度下,NDMA 生成的速度基本相同;2h 以后出现显著变化,H2O2浓度越低,NDMA 生成量越大,且NDMA 合成速度也明显增加。H2O2浓度越大,NDMA 生成量越少,三者差异达显著水平(p <0.05)。5h 时,2mmol/L H2O2的NDMA生成量是0.1mmol/L H2O2时的一半,且H2O2浓度为2mmol/L 时,体系中NDMA 的生成量随反应时间延长增加的趋势逐渐减缓,同时NDMA 生成量明显降低。
2.3 不同FeCl3 浓度的羟自由基反应体系中,NDMA 生成量随反应时间的变化
H2O2浓度固定,FeCl3的量分别为0.1、0.4、1.0mmol/L 时,氧化反应体系中NDMA 生成量随时间变化的结果如图4 所示。
由图4 可以看出,随着反应时间的延长,体系中NDMA 的生成量均呈显著增加趋势。但是不同的FeCl3浓度处理之间,NDMA 的变化情况组间差异不显著。

图4 不同FeCl3 浓度随反应温度变化对NDMA 生成量的影响Fig.4 The content of NDMA changes with the temperature on the FeCl3 concentration
图2 ~图4 结果显示,在固定FeCl3浓度下,NDMA 的合成量随H2O2浓度的升高而降低,可能是因为氧化体系不断地将HNO2氧化为NO3-,使HNO2的浓度大大下降,亚硝化底物的减少使得NDMA 的生成量逐渐降低。与假设结果不同的是,随着氧化体系中FeCl3浓度的增加,NDMA 的合成量并非一直下降。在H2O2浓度低于2.5mmol/L 时,氧化体系中含0.1mmol/L FeCl3反而比0.025 mmol/L 的FeCl3使得NDMA 的生成量还要高。产生这种结果的原因一方面可能是铁在这个氧化体系中可能会发生水解反应(Fe3++3H2O ≒Fe(OH)3+3H+),水解产生H+对亚硝胺的形成有利。根据文献报道[12-14],亚硝酸钠和二甲胺的反应过程可以表示为:

亚硝酸钠和二甲胺的化学计量系数比为1∶1,并且反应需在酸性条件下进行。另一方面,Fe3+和Fe2+的浓度比直接影响到反应的移动,从而可能改变反应的方向,这可能也会造成氧化体系中Fe3+浓度增加,从而Fe3+氧化NO2-,使NO2-减少,抑制NDMA 的形成。反而对NDMA 形成的抑制作用减弱的其中一个主要原因。
2.4 不同H2O2 浓度的羟自由基反应体系中,温度变化对NDMA 生成量的影响
不同H2O2浓度的羟自由基反应体系中,温度变化对NDMA 生成量的影响结果见图5。

图5 不同H2O2 浓度随反应温度变化对NDMA 生成量的影响Fig.5 The content of NDMA changes with the temperature on the H2O2 concentration
图5 显示,模拟反应体系中,当氧化体系中反应温度低于40℃时,NDMA 生成量没有明显变化,而且三个不同H2O2浓度之间的NDMA 生成量差异不显著(p >0.05)。当反应温度高于40℃时,模拟反应体系中三条曲线的变化趋势均明显增大。特别是达到80℃时,不同H2O2浓度之间,0.1mmol/L 的H2O2氧化体系中,NDMA 生成量的极显著增加。随H2O2浓度增大,相同温度下NDMA 的生成量明显下降,而且温度越高下降的幅度越大。
2.5 不同FeCl3 浓度的羟自由基反应体系中,NDMA 生成量随反应温度的变化
不同FeCl3浓度的羟自由基反应体系中,NDMA生成量随反应温度的变化结果见图6。
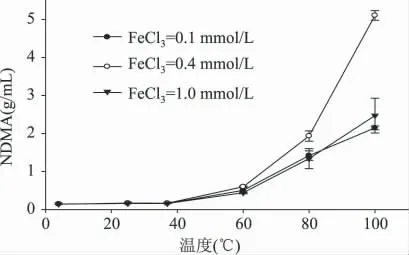
图6 不同FeCl3 浓度随反应温度变化对NDMA 生成量的影响Fig.6 The content of NDMA changes with the temperature on the FeCl3 concentration
图6 表明,当反应温度低于40℃时,不同FeCl3浓度下,NDMA 的生成量变化不显著,高于40℃时NDMA 的生成量逐渐增加,温度达到80℃时,含0.4mmol/L 的FeCl3氧化体系处理组NDMA 的生成量极显著增加,含0.1mmol/L 和1.0mmol/L 的FeCl3氧化体系处理组,组间差异不显著(p >0.05)。
图5、图6 结果表明,NDMA 均是在温度高于40℃才可以形成,而且NDMA 的形成与温度呈明显的正相关关系。温度每升高10℃,NDMA 的生成量仅大约增加0.5~1 倍。依据范霍夫近似规则[15],一般情况下温度每升高10℃,反应速率大约增加2~4倍。可见过氧化氢/铁/抗坏血酸氧化系统确实能够抑制NDMA 的生成。
本体外模拟实验的结果表明,在肉品体系中如果发生过度氧化,产生过量的自由基,则肉品基质中的亚硝酸盐也可能会被氧化,从而亚硝胺的生成量减少。但肉品体系复杂,基质中可能存在各种抗氧化和氧化成分,这可能是肉品中添加抗氧化剂对亚硝胺的抑制作用强弱不同[16-22]的主要原因。
3 结论
亚硝酸钠(NaNO2)和二甲胺(DMA)的反应体系中加入H2O2/FeCl3/Asc 氧化系统可以抑制NDMA 的生成。其中H2O2浓度变化对NDMA 的生成有显著的影响,随着H2O2浓度的增加,NDMA 的生成量逐渐降低,H2O2浓度为5mmol/L 时对NDMA 的抑制率可达97.5%。适当增加FeCl3的浓度,也可抑制NDMA 的生成。随着氧化反应时间的延长,NDMA生成量呈明显的增加趋势。反应温度低于40℃时NDMA 生成量没有明显变化,且氧化体系中H2O2和FeCl3的浓度对NDMA 的生成量没有显著影响,高于60℃时NDMA 生成量开始显著增加。80℃时氧化体系中H2O2和FeCl3的浓度的变化对NDMA 的生成量影响极显著。
[1]李庆杰.N-亚硝基化合物的危害及预防对策[J].泰安师专学报,2001,23(6):74-75.
[2]边丽.危险的致癌物质——亚硝胺[J].兵团教育学院学报,2001,11(1):62-65.
[3]尹立辉,马俪珍.反应条件对N-亚硝基二甲胺生成影响的研究[J].中国农学通报,2011,27(7):457-460.
[4]Kanner J.Oxidative processes in meat and meat products:quality implications[J].Meat Science,1994,36:169-189.
[5]Wakamatsu J,Okui J,Ikeda Y,et al.Establishment of a model experiment system to elucidate the mechanism by which Znprotoporphyrin IX is formed in nitrite-free dry-cured ham[J].Meat Science,2004,68:313-317.
[6]hristina E,Adamsen J,Møller KS,et al. Zn - porphyrin formation in cured meat products:Effect of added salt and nitrite[J].Meat Science,2006,72:672-679.
[7]Harel S,Kanner J.Hydrogen peroxide generation in ground muscle tissue[J].Journal of Agricultural and Food Chemistry,1985,33:5178-5185.
[8]Tooru O,Xiong YL.Biochemical susceptibility of myosin in chicken myofibrils subjected to hydroxyl radical oxidizing systems[J].Agriculture and Food Chemistry,2004,52:4303-4307.
[9]Srinivasan S,Hultin HO.Chemical,physical,and functional properties of cod proteins modified by a nonenzymic free-radical-generating system[J]. Journal of Agricultural and Food Chemistry,1997,45:310-320.
[10]Donkeun P,Xiong YL,Amy L,et al.Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J].Food Chemistry,2006,101:1239-1246.
[11]Narmada RS,Ahmed SU.Choughuley.Inhibitory effect of diet related sulphydryl compounds on the formation of carcinogenic nitrosamines[J].Cancer Letters,1999,65:227-232.
[12]Honikel KO.The use and control of nitrate and nitrite for the processing of meat products[J].Meat Science,2008,78:68-76.
[13]丁之恩.亚硝酸盐和N-亚硝胺在食品中的作用及其机理[J].安徽农业大学学报,1994,21(2):199-205.
[14]孙敬,詹文圆,陆瑞琪.肉制品中亚硝胺的形成机理及其影响因素分析[J].肉类研究,2008,107(1):18-23.
[15]傅献彩,沈文霞,姚天扬.物理化学(下册).第四版[M].北京:高等教育出版社,1990,742-744.
[16]张健斌,马俪珍,孔保华,等.香辛料对二甲基亚硝胺形成的抑制作用[J].食品与机械,2008,24(2):93-96.
[17]袁毅桦,陈忻,陈纯馨,等.柚皮提取物对亚硝化反应抑制作用研究[J].化学世界,2004,1:26-34.
[18]马俪珍,王瑞,熊勇,等.复配香辛料提取物体外阻断N-二甲基亚硝胺生成的效果[J].食品与生物技术学报,2009,28(2):192-196.
[19]张虹,许钢,袁建耀,等.提取液对亚硝化反应的抑制作用[J].郑州粮食学院学报,2000,21(1):50-53.
[20]赵二劳,梁泽,张海容.沙棘叶对亚硝酸盐清除能力的研究[J].食品工业科技,2006,27(3):81-82.
[21]杨华,马俪珍,王永辉.茶多酚和柚子皮等复配对阻断西式火腿中N-亚硝基化合物合成的效果研究[J].肉类工业,2006,5:22-27.
[22]孙艳辉,董英.壳聚糖对亚硝酸盐清除作用的研究食品科学[J].食品科学,2005,26(12):71-73.
