端粒维持基因多态性与膀胱癌易感性的关系
2013-06-07
复旦大学附属肿瘤医院泌尿外科,复旦大学上海医学院肿瘤学系,上海 200032
端粒维持基因多态性与膀胱癌易感性的关系
顾成元 朱耀 综述 叶定伟 审校
复旦大学附属肿瘤医院泌尿外科,复旦大学上海医学院肿瘤学系,上海 200032
端粒维持基因在保持端粒稳定、维护染色体完整方面起重要作用,端粒功能紊乱将会导致肿瘤发生。在维持端粒稳定的基因中,已经发现多种基因存在单核苷酸多态性。随着研究的深入,越来越多的证据表明,个体间端粒稳定性及长度的差异主要取决于端粒维持基因的多态性。端粒维持基因单核苷酸多态性可能是导致端粒长度及稳定性存在个体差异及增加肿瘤易感性的主要因素之一。本文就端粒维持基因多态性与膀胱癌易感性关系的研究进展作一综述。
端粒维持基因;多态性;膀胱癌;易感性
1 端粒与端粒维持基因
端粒位于染色体的末端,是由多重复的非转录序列(TTAGGG)及一些结合蛋白组成的特殊结构[1]。端粒可通过折叠形成t环紧凑结构,或者与端粒保护蛋白结合,从而防止染色体降解、避免末端融合[2],与细胞分化、组织再生、DNA修复、细胞的衰老和死亡以及恶性肿瘤的发生都有密切的关系。
端粒长度在15~50 kB之间,随着年龄的增长而逐渐缩短。端粒长度主要受基因控制[3],存在非常大的个体差异[4-5]。双生子和家族研究显示,白细胞端粒长度的遗传度在44%~88%之间[6]。炎症反应、氧化应激和不健康的生活方式也与端粒缩短有关[7-9]。
在DNA聚合酶的作用下,体细胞中端粒DNA不完全复制,端粒随着有丝分裂逐渐缩短[10]。当端粒长度变得非常短时,由于失去端粒的保护作用,细胞开始衰老,发生细胞凋亡。在染色体末端触发DNA损伤应答,发生双键断裂[10]。但如果能绕开端粒缩短机制,细胞就能避免产生DNA降解。肿瘤细胞就是通过端粒酶的异常激活避免端粒缩短从而实现无限增殖[11]。人类端粒酶是由模板RNA(telomerase RNA component,TERC)、人端粒酶逆转录亚单位(telomerase reverse transcriptase,TERT)和端粒酶相关蛋白1(telomerase-associated protein 1,TEP1)3个亚单位组成。端粒酶在恶性肿瘤发生中的作用是通过引物特异识别位点,以自身核糖核酸(ribonucleic acid,RNA)为模板,在染色体末端合成端粒DNA,使端粒得以延长。正常情况下人类体细胞端粒酶的检测结果是阴性的,但在85%的肿瘤中能检测到端粒酶活性[12]。
除了端粒酶,端粒还通过与一系列蛋白(如Shelterin复合体等)结合或者相互作用来维持完整性,避免端粒降解和错误的DNA修复[13]。许多重要的端粒相关蛋白和复合体会与端粒DNA序列相互作用,包括涉及DNA修复的蛋白如减数分裂重组11同族体A(meiotic recombination 11 homolog A,MRE11A),涉及解旋酶的蛋白如RecQ蛋白(RecQ protein-like,RECQL)等[3]。在染色体末端有大量的蛋白直接或间接地相互作用,调节蛋白-蛋白、蛋白-DNA相互作用,发挥蛋白转运和其他端粒特异功能。
端粒对维持基因组的稳定性和完整性起着至关重要的作用,失去端粒功能和无限增殖会导致细胞发生端端融合、染色体降解、断裂-融合-桥循环和遗传不稳定,导致基因变化的细胞获得进一步生长优势,最终发展成肿瘤细胞[14]。在结肠癌[15]、肺癌[16]、皮肤癌[17]、乳腺癌[18]、骨肉瘤[19]中都已报道上述各种通路中端粒维持基因的多态性会增加肿瘤发生的风险。在表1中按照功能通路分类总结了与端粒稳定相关的基因[3,6,9-11,13]。
2 端粒维持基因多态性与膀胱癌
2.1 TEP1
TEP1是核糖核蛋白复合体的组成部分,与端粒酶结合,被认为是端粒酶活性的调节亚单位。体外实验表明,在端粒替代延长机制(alterative lengthening of telomere,ALT)中,TEP1与布鲁姆蛋白(bloom syndrome protein,BLM)有强烈的相互作用,在端粒DNA解旋的初始阶段影响BLM的解旋酶活性,且不依赖DNA和RNA的调控,能有效将人类端粒RNA与端粒DNA的基质结合起来[20]。Andrew等[21]报道,TEP1基因上的位点rs1760897 A>G的转换与患膀胱癌风险增加相关。后有研究发现,TEP1基因上有7个位点(rs2228041、rs2228026、rs2228026、rs2297615、rs2229101、rs2104978、rs1713440)与患膀胱癌风险有关,其中rs2228041可以显著增加患膀胱癌风险(P=0.0023),碱基A>G的改变很可能影响了蛋白的结构和功能[22]。

表 1 与端粒稳定相关的通路及基因Tab. 1 Genes and pathways associated with telomere stability
2.2 内源性端粒酶抑制基因(PIN2/TERF1 interacting telomerase inhibitor 1,PINX1)
PINX1具有调节端粒酶的功能,直接与TERT结合,与端粒酶的活性调节有关。PINX1的抑制可以增加端粒酶的活性,而PINX1的过度表达可以抑制端粒酶的活性[23]。PINX1蛋白通过与人端粒重复序列结合因子1(telomeric repeat binding factor 1,TRF1)蛋白互相作用附加到端粒上,Soohoo等[24]的研究显示,PINX1的抑制导致异常的端粒酶活化和端粒延长,损害端粒功能从而导致染色体不稳定。表明PINX1通过调节端粒酶活性起到抑制肿瘤的作用。目前发现PINX1基因上有7个位点(rs1469557、rs17152584、rs6995541、rs9657541、rs11250080、rs7826180、rs2409655)是膀胱癌的保护因素,可能与端粒酶活性抑制有关[22]。
2.3 皮层E3泛素蛋白连接酶家族2(pellino E3 ubiquitin protein ligase family member 2,PELI2)
Gu等[25]利用全基因组关联分析(genomewide association study,GWAS)方法发现,位于20q11.22的rs6028466、位于1p34.2的rs621559、位于14q21的rs398652和位于6q22.1的rs654128这4个位点与端粒增长有显著关联,其后在大规模的对照研究中验证这4个位点与膀胱癌的关系,发现位于14q21的rs398652可以显著减少患膀胱癌的风险。距离rs398652最近的是PELI2基因(编码pellino-2蛋白),Moynagh[26]研究发现,在TOLL样受体(toll-likereceptor,TLR)信号转导通路中,Pellino蛋白通过其C端环样结构域激活E3泛素连接酶,催化白介素-1受体激酶1(interleukin-1 receptor-associated kinase 1,IRAK)和其他TOLL样受体信号转导分子多聚泛素化,从而激活依赖TOLL样受体和白介素-1受体的核转录因子κB(nuclear factor kappa B,NF-κB)和分裂酶原蛋白激活酶通路及下游基因。TOLL样受体在固有免疫系统和对外部病原体的初始免疫应答中起着关键作用,超过1/4的肿瘤与慢性炎症有关,慢性炎症会引起端粒损耗加快[27-28],PELI2在炎症反应中的作用可解释rs398652与端粒长度之间关系的生物学合理性。
2.4 TERT
TERT基因结构分为N末端、端粒酶特异区、反转录区和C末端。N末端为被保留的功能区,端粒酶特异区为被保留的端粒酶特异区。在TERT基因的参与下,端粒的延长需要经过成熟、加工、TERC积聚、核转运、TERT转录后的修饰等过程。在正常细胞中TERT启动子无活性,而在肿瘤细胞中却被激活,是端粒酶活性激活的关键步骤和调节位点,在端粒维持和细胞永生上起着关键的作用。此前已经发现TERT基因多态性与结肠癌[15]、肺癌[16]、胶质瘤[29]、宫颈癌[30]等多种肿瘤有关。rs2736098和rs2736100位于TERT基因的内含子区5p15上,rs2736100在中国和高加索人群的对比试验中都呈现出与膀胱癌的显著相关(OR=1.23;95%CI:1.02~1.48),并且这种相关在较年轻的人群中更为显著[31]。
2.5 端锚聚合酶基因(tankyrase,TNKS)
TNKS与NAD-ADP核苷核糖基转移的活性有关,与端粒逆转录酶作用形成端粒逆转录酶复合体。TNKS对维持端粒长度和基因组稳定性起重要作用。Gelmini等[32]研究显示,TNKS是一种ADP核糖聚合酶,通过修饰TERF1来正向调节端粒长度。过程包括解除TERF1抑制、允许端粒酶结合并使端粒DNA序列延长。TNKS的过度表达在癌症启动阶段发挥作用,并且对端粒长度的维持在肿瘤的进展阶段持续体现。在乳腺癌与端粒相关基因关系的研究中发现,TNKS基因上有9个位点与端粒长度有显著的关联[33]。通过对1 606例的对照研究发现,TNKS基因rs7825818、rs10503380处的替代和缺失使膀胱癌相对危险性升高[22]。表2总结了近年来报道的与膀胱癌易感性有关SNP位点[21-22,25,34]。
除了以上单个基因对端粒的影响外,多个不同通路基因多态性可能会产生交互作用。当突变的基因型增加时可观察到非常显著的剂量效应(P<0.01),证实这些与膀胱癌风险相关的位点会产生累积效应。根据携带突变基因的数量将患者分成3组,与患携带野生基因型的个体相比,随着突变位点的增多,患膀胱癌的风险逐渐增加。携带1个突变基因型的OR值为1.2(95%CI:0.92~1.62),携带2~3个突变基因型的OR值为1.64(95%CI:1.22~2.21),而携带4~5个突变基因型的OR值上升到2.57(95%CI:1.62~4.09)[22]。
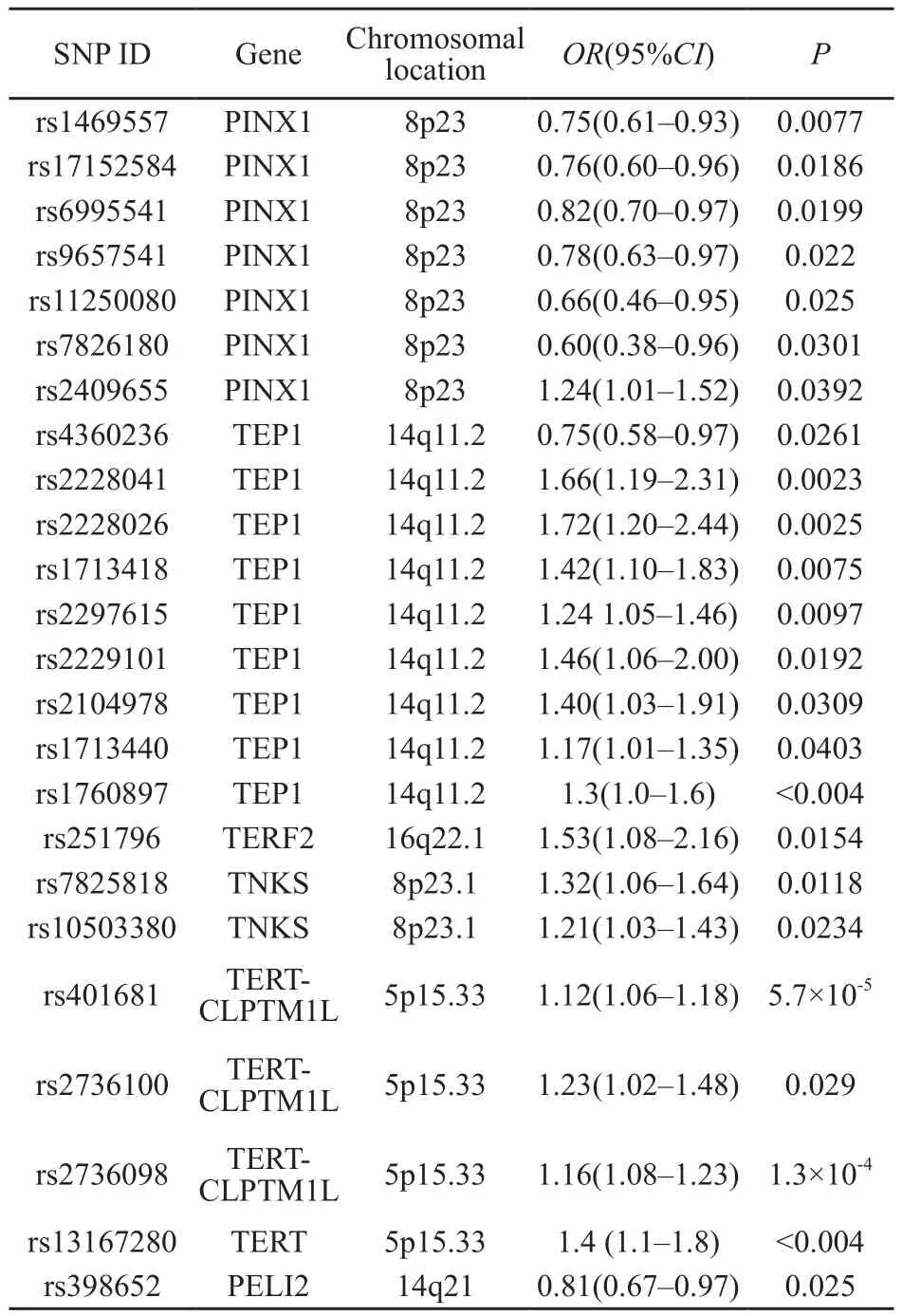
表 2 经证实的与膀胱癌易感性有关联的端粒维持基因SNP位点Tab. 2 SNPs identified in recent association studies and their association with bladder cancer
3 总 结
综上所述,端粒在维持基因组完整性方面起着举足轻重的作用,相关基因所编码产物在维持端粒稳定性中发挥着重要作用,而这些基因多态性可通过对端粒长度、稳定性和活性等的调节而参与膀胱癌的发生、发展。迄今为止的研究证实了端粒维持基因与膀胱癌之间存在明显的相关性,并且涉及多条通路。但目前确定的变异仅仅解释了端粒基因遗传的一小部分,更多的区域有待确认。研究重点有望在端粒维持各个不同通路基因多态性间展开, 分析各通路中不同功能基因多态性单独及联合与膀胱癌易感性的关系。而更完善的序列定位和高通量测序有助于进一步阐明端粒维持基因多态性与膀胱癌的关系及致癌机制,更有望为肿瘤治疗提供有效的靶点。
[1] MOON I K,JARSTFER M B. The human telomere and its relationship to human disease, therapy, and tissue engineering[J]. Front Biosci, 2007, 12: 4595-4620.
[2] GRIFFITH J, COMEAU L, ROSENFIELD S, et al. Mammalian telomeres end in a large duplex loop[J]. Cell, 1999, 97(4):503-514.
[3] AUBERT G, LANSDORP P. Telomeres and aging[J]. Physiol Rev, 2008, 88(2): 557-579.
[4] AVIV A, CHEN W, GARDNER J, et al. Leukocyte telomere dynamics: longitudinal findings among young adults in the Bogalusa Heart Study[J]. Am J Epidemiol, 2009, 169(3):323-329.
[5] NORDFJALL K, SVENSON U, NORRBACK K F, et al. The individual blood cell telomere attrition rate is telomere length dependent[J]. PLoS Genet, 2009, 5(2): e1000375.
[6] NJAJOU O, CAWTHON R, DAMCOTT C, et al. Telomere length is paternally inherited and is associated with parental lifespan[J]. Proc Natl Acad Sci U S A, 2007, 104(29):12135-12139.
[7] MIRABELLO L, HUANG W, WONG J, et al. The association between leukocyte telomere length and cigarette smoking, dietary and physical variables, and risk of prostate cancer[J]. Aging Cell, 2009, 8(4): 405-413.
[8] AMSELLEM V, GARY B G, MARCOS E, et al. Telomere dysfunction causes sustained inflammation in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2011, 184(12): 1358-1366.
[9] BABIZHAYEV M A, SAVELYEVA E L, MOSKVIN S N , et al. Telomere length is a biomarker of cumulative oxidative stress, biologic age, and an independent predictor of survival and therapeutic treatment requirement associated with smoking behavior[J]. Am J Ther, 2011, 18(6): e209-e226.
[10] VERFAILLIE C M, PERA M F, LANSDORP P M. Stem cells:hype and reality[J]. Hematology Am Soc Hematol Educ Program, 2002, 676: 369-391.
[11] HIYAMA E, HIYAMA K. Telomerase as tumor marker[J]. Cancer Lett, 2003, 194(2): 221-233.
[12] GREIDER C W. Telomerase activity, cell proliferation, and cancer[J]. Proc Natl Acad Sci USA, 1998, 95(1): 90-92.
[13] PALM W, LANGE T. How shelterin protects mammaliantelomeres[J]. Annu Rev Genet, 2008, 42: 301-334.
[14] LIN T T, LETSOLO B T, JONES R E, et al. Telomere dysfunction and fusion during the progression of chronic lymphocytic leukemia: evidence for a telomere crisis[J]. Blood, 2010, 116(11): 1899-1907.
[15] JONES A M, BEGGS A D, CARVAJAL C L, et al. TERC polymorphisms are associated both with susceptibility to colorectal cancer and with longer telomeres[J]. Gut, 2012 , 61(2): 248-254.
[16] HOSGOOD H D 3RD, CAWTHON R, HE X, et al. Genetic variation in telomere maintenance genes, telomere length, and lung cancer susceptibility[J]. Lung Cancer, 2009, 66(2):157-161.
[17] NAN H, QURESHI A A, PRESCOTT J, et al. Genetic variants in telomere-maintaining genes and skin cancer risk[J]. Hum Genet, 2011, 129(3): 247-253.
[18] SHENh J, GAMMON M D, TERRY M B, et al. Genetic polymorphisms in telomere pathway genes, telomere length, and breast cancer survival[J]. Breast Cancer Res Treat, 2012, 134(1): 393-400.
[19] MIRABELLO L, RICHARDS E G, DUONG L M, et al. Telomere length and variation in telomere biology genes in individuals with osteosarcoma[J]. Int J Mol Epidemiol Genet, 2011 , 2(1): 19-29.
[20] BHATTACHARYYA S, KEIRSEY J, RUSSELL B, et al. Telomerase-associated protein 1, HSP90, and topoisomerase IIalpha associate directly with the BLM helicase in immortalized cells using ALT and modulate its helicase activity using telomeric DNA substrates[J]. J Biol Chem, 2009, 284(22): 14966-14977.
[21] ANDREW A S, GUI J, SANDERSON A C, et al. Bladder cancer SNP panel predicts susceptibility and survival[J]. Hum Genet, 2009, 125(5-6): 527-539.
[22] CHANG J, DINNEY C P, HUANG M. Genetic variants in telomere-maintenance genes and bladder cancer risk[J]. PLoS One, 2012, 7(2): e30665.
[23] LU K P, ZHOU X Z. The Pin2/TRF1-interacting: Protein PinX1 is a potent telomerase inhibitor[J]. Cell, 2001, 107(3): 347-359.
[24] SOOHOO C Y, SHI R, LEE T H, et al. Telomerase inhibitor PinX1 provides a link between TRF1 and telomerase to prevent telomere elongation[J]. J Biol Chem, 2011, 286(5): 3894-3906.
[25] GU J, CHEN M, SHETE S, et al. A genome-wide association study identifies a locus on chromosome 14q21 as a predictor of leukocyte telomere length and as a marker of susceptibility for bladder cancer [J]. Cancer Prev Res (Phila), 2011, 4(4):514-521.
[26] MOYNAGH P N. The Pellino family: IRAK E3 ligases with emerging roles in innate immune signalling [J]. Trends Immunol, 2009, 30: 33-42.
[27] MASI S, SALPEA K D, LI K, et al. Oxidative stress, chronic inflammation, and telomere length in patients with periodontitis[J]. Free Radic Biol Med, 2011, 50(6): 730-735.
[28] HOUBEN J M, MERCKEN E M, KETELSLEGERS H B, et al. Telomere shortening in chronic obstructive pulmonary disease[J]. Respir Med, 2009, 103: 230-236.
[29] ZHAO Y, CHEN G, ZHAO Y, et al. Fine-mapping of a region of chromosome 5p15.33 (TERT-CLPTM1L) suggests a novel locus in TERT and a CLPTM1L haplotype are associated with glioma susceptibility in a Chinese population[J]. Int J Cancer, 2012, 131(7): 1569-1576.
[30] WANG S, WU J, HU L, et al. Common genetic variants in TERT contribute to risk of cervical cancer in a Chinese population[J]. Mol Carcinog, 2012, 51 (Suppl 1):e118-e122.
[31] GAGO-DOMINGUEZ M, JIANG X, CONTI D V, et al. Genetic variations on chromosomes 5p15 and 15q25 and bladder cancer risk: findings from the Los Angeles-Shanghai bladder case-control study[J]. Carcinogenesis, 2011, 32(2):197-202.
[32] GELMINI S, QUATTRONE S, MALENTACCHI F, et al. Tankyrase-1 mRNA expression in bladder cancer and paired urine sediment: preliminary experience[J]. Clin Chem Lab Med, 2007, 45(7): 862-866.
[33] YANOWSKY K, BARROSO A, OSORIO A, et al. Mutational analysis of telomere genes in BRCA1/2-negative breast cancer families with very short telomeres[J]. Breast Cancer Res Treat, 2012, 134(3): 1337-1343.
[34] RAFNAR T, SULEM P, STACEY SN, et al. Sequence variants at the TERT-CLPTM1L locus associate with many cancer types[J]. Nat Genet, 2009, 41(2): 221-227.
The association of genetic variants in telomere maintenance genes with bladder cancer risk
GU Cheng-yuan, ZHU Yao, YE Ding-wei (Department of Urology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
YE Ding-wei E-mail: dwyeli@yahoo.com.cn
Telomere maintenance genes play an important role in maintaining the integrity of the telomere structure that protects chromosome ends, and telomere dysfunction may lead to tumorigenesis. Genetic variation in telomere maintenance genes has been confirmed. Cumulative evidence shows that the difference of telomere length and stability among the individual depends on the genetic variants of telomere maintenance genes. Genetic variants in telomere maintenance genes may affect telomere length and stability, thus the increased cancer risk. This review intends to summarize the association of genetic variants in telomere maintenance genes with bladder cancer risk.
Telomere maintenance genes; Polymorphism; Bladder cancer; Susceptibility
R737.14
:A
:1007-3639(2013)01-0059-05
2012-07-31
2012-10-28)
叶定伟 E-mail:dwyeli@yahoo.com.cn
DOI: 10.3969/j.issn.1007-3969.2013.01.011
