阿米福汀对大鼠肺放射性肺损伤保护作用的实验研究
2013-06-07梅欣章倩刘迎玫陈佳艺章真郭小毛
梅欣章倩刘迎玫陈佳艺章真郭小毛
1.复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海200032;
2. 复旦大学附属妇产科医院门诊部,上海200032
阿米福汀对大鼠肺放射性肺损伤保护作用的实验研究
梅欣1章倩1刘迎玫2陈佳艺1章真1郭小毛1
1.复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海200032;
2. 复旦大学附属妇产科医院门诊部,上海200032
背景与目的:放射性肺损伤是胸部肿瘤放射治疗后的常见并发症,在放射治疗中如何保护肺组织免受或少受放射性损伤显得非常重要。本研究采用阿米福汀作为放射保护剂,探讨其对采用胸壁切线放射治疗技术照射大鼠肺组织放射性损伤的保护作用。方法:将35只雌性Fish-344大白鼠编号后按随机数字法分为常规照射部分和单次照射部分。常规照射部分:20只给予照射5周,总剂量为50 Gy,共25次。随机分为2组,用药照射组10只(随机照射左侧、右侧各5只);对照照射组10只(随机照射左侧、右侧各5只)。单次照射部分:15只右侧胸部切线单次照射20 Gy,随机分为用药照射组5只,对照照射组5只,空白对照组5只。用药照射组照射前30 min内腹腔注射阿米福汀(140 mg/kg),对照照射组用相同剂量照射。采用60Co治疗机,前后野半野对穿照射。照射结束后记录呼吸频率、体质量,尾静脉取血测转化生长因子-β1(transforming growth factor-β,TGF-β),取大鼠照射侧肺及对照组同侧肺进行TGF-β1免疫组织化学染色。结果:常规照射部分用药照射组在放射后4周呼吸频率达到最高,对照照射组在放射后2周达到最高,差异有统计学意义(P<0.05)。单次照射部分对照照射组升高较用药照射组差异有统计学意义(P<0.05)。常规照射部分及单次照射部分中用药照射组与单纯照射组各段时间内的血清TGF-β1差异无统计学意义(P>0.05)。在常规照射部分,肺组织HE染色和马松染色显示,与正常肺泡壁比较,单纯照射组的肺泡壁明显增厚,其肺泡间质大部分为增生纤维组织和弹力纤维组织。而在照射加药组虽也有肺泡壁增厚和纤维化,但与单纯照射组相比较不甚明显,可见大部分肺泡结构存在,肺泡壁的纤维化增生较单纯照射组减轻。免疫组织化学TGF-β1染色显示正常组织为阴性或弱阳性的表达,单纯照射组的肺组织TGF-β1染色表达多为阳性或中强阳性,照射加药组表达为弱阳性或阳性。在常规照射期间,用药照射组在放疗开始后体质量明显下降,而对照照射组体质量下降不明显,差异有统计学意义(P<0.05),在放疗结束后两组之间的体质量平均值逐渐接近。单次照射部分3组之间体质量差异无统计学意义(P>0.05)。结论:本研究显示,在单次大剂量照射部分和常规照射部分,阿米福汀可以改善大鼠受到照射后引起的肺部症状,改善了照射后肺部肺泡增生和纤维化程度。但是常规照射中连续应用阿米福汀会带来一定的不良反应,在实际应用中造成了大鼠体质量减轻。
阿米福汀;辐射防护剂;辐射损伤;大鼠
放射性肺损伤是胸部肿瘤放射治疗后的常见并发症。与放射性肺损伤的发生、发展密切相关的细胞因子目前报道较多[1],有研究报道,转化生长因子-β(transforming growth factor-β,TGF-β)在放射性肺炎的发病机制中起着关键性作用[2]。由于肺功能下降,会导致治疗后患者的生存质量明显降低。所以,如何保护肺组织免受或少受放射性损伤显得非常重要。
阿米福汀(amifostine,氨磷汀,也称为WR-2721)是一种毒性较小,对放射性损伤具有较大防护的化合物。临床前期的试验证实[3-4],阿米福汀可以保护除中枢神经系统以外的正常组织,却不保护肿瘤组织。
为了评价阿米福汀对肺脏的放射保护作用,本研究采用动物试验,使用常用的前后对穿放射治疗技术,在常规放射治疗的剂量分次模式及单次大剂量的照射模式下,其对大鼠的肺组织急性放射性损伤保护作用的情况。
1 材料和方法
1.1 材料
1.1.1 实验动物与分组
复旦大学实验动物中心饲养35只雌性Fish-344大鼠,编号后按照随机数字法分为常规照射部分(n=20)和单次照射部分(n=15),每部分采用随机数字法分组。常规照射部分采用数字表法随机分为2组:用药照射组10只(随机照射左侧、右侧各5只);对照照射组10只(随机照射左侧、右侧各5只)。单次照射部分采用数字表法随机分为用药照射组5只,对照照射组5只,空白对照组5只。
1.1.2 仪器与试剂
采用60Co治疗机(780-C)的γ射线照射,剂量率:126.5 cGy/min,平均能量:1.25 MeV。采用源皮距(source skin distance,SSD)=80 cm,前后半野对穿照射技术。
放射保护剂采用阿米福汀,每支400 mg (大连美罗大药厂)。用药前用0.9%NaCl溶液稀释为40 mg/mL,根据大鼠体质量按140 mg/kg给予剂量,于照射前30 min内腹腔注射,麻醉后进行放射。对照照射组在麻醉后进行相同剂量的放射。空白对照组不给予麻醉和放射。麻醉采用氯胺酮(0.1 g/0.2 mL),根据大鼠体质量采用0.10 g/kg给予剂量,大鼠后肢肌肉注射。
采用自行设计有机板固定架,使大鼠放射治疗时背部向上,四肢外展,头部向前方固定。
1.2 方法
1.2.1 研究进程总览
整个研究共进行17周,第1周进行常规照射部分各只大鼠的称重和随机分组,并记录各只动物的呼吸频率并采血。第2周开始常规照射,5周后结束照射。第6周进行单次照射部分各只大鼠的称重和随机分组,并记录各只动物的呼吸频率并采血,在常规照射部分照射最后1次的当日进行照射。照射后第1周开始观察和记录各项观察指标,共观察10周。在照射后第10周末将大鼠处死后,解剖取左、右肺,送病理检查。
1.2.2 照射方法
照射时大鼠腹部及背部皮肤用5 mm皮肤补偿物覆盖。照射时光栏大小为4 cm×4 cm,在靠近脊柱的一半射野,采用5 cm厚、大小为6 cm×6 cm挡铅,遮挡得到1个2 cm×4 cm的射野,射野中心距大鼠体中0.5 cm。
常规照射部分给予照射单侧胸部切线常规,每次照射剂量2 Gy,计算深度为1.5 cm,每日照射1次,每周照射5次,照射5周,总剂量为50 Gy,共25次。治疗前用2570/1型 FARMER剂量仪,放置0.6 cc指形电离室于总厚度3 cm有机板,深度1.5 cm,同等大小射野的吸收剂量率为126.5 cGy/min,并由此计算前后野的常规照射时的所需机器治疗时间为0.79 min。
单次照射部分用药照射组和对照照射组均给予单次照射靶区剂量每次20 Gy,每射野照射7.9 min。在常规照射部分最后1次照射当日给予单次照射。照射时体质量为(158±6)g,15周龄。
1.3 观察指标
1.3.1 血清标本
照射结束后每2周从大鼠尾静脉取血并分离得到100~150 μL血浆置于-70 ℃低温冰箱,试验结束后统一送检(结果由上海森雄公司检测),采用双抗体夹心ABC-ELISA法测量血浆TGF-β1浓度。
1.3.2 呼吸频率和体质量测量
常规照射开始前及照射3周后、照射结束后每2周记录1次每只大鼠的呼吸频率,呼吸频率采用人工观察大鼠腹背部由于呼吸引起的运动频率进行记录。照射前及照射后每4周测量1次每只大鼠体质量,照射10周后终止观察。
1.4 病理检查
观察期结束后,取大鼠左、右肺在4%甲醛溶液下固定20 h,脱水固定后切片,分别进行HE、Masson’s和Weigen’s染色,TGF-β1免疫组织化学染色。TGF-β1免疫组织化学染色采用EnVision二步法染色,染色后肺组织镜下根据肺泡间质中染色程度分为阴性(无棕黄色)、弱阳性(浅黄色)、阳性(黄色)、中强阳性(棕黄色)及强阳性(深棕黄色)。用缓冲液代替一抗进行染色作为空白对照组。结果由两名病理科免疫组化专家分别进行评级。
1.5 统计学处理
使用SPSS 11.0统计软件进行数据分析。数值的比较采用方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 存活情况
放射结束时常规照射部分大鼠死亡4只,其中用药照射组3只(左肺照射2只,右肺照射1只),对照照射组1只。单次照射部分无大鼠死亡。
2.2 呼吸频率
2.2.1 常规照射部分
常规照射部分的用药照射组呼吸频率变化在放射后4周达到最高,放射后10周出现第2次升高;对照照射组在放射后2周达到最高,放射后10周也出现第2次升高;对照照射组升高幅度较用药照射组差异有统计学意义(P<0.05,表1)。
2.2.2 单次照射部分
单次照射部分的用药照射组呼吸频率变化在放射后2周升高并达到最高,未出现第2次升高;对照照射组在照射后2周升高,照射后6周出现第2次升高并达到最高水平;对照照射组升高幅度较用药照射组差异有统计学意义(P<0.05)。空白对照组未见呼吸频率的明显升高(表2)。
2.3 血清TGF-β1水平
2.3.1 常规照射部分
常规照射部分两组放疗前至放疗后10周内血清TGF-β1的水平差异无统计学意义(P>0.05,表3)。
2.3.2 单次照射部分
单次照射部分TGF-β1水平在用药照射组、单纯照射组与空白对照组在第8周时差异有统计学意义(P<0.05),其他各段时间差异无统计学意义(P>0.05,表4)。
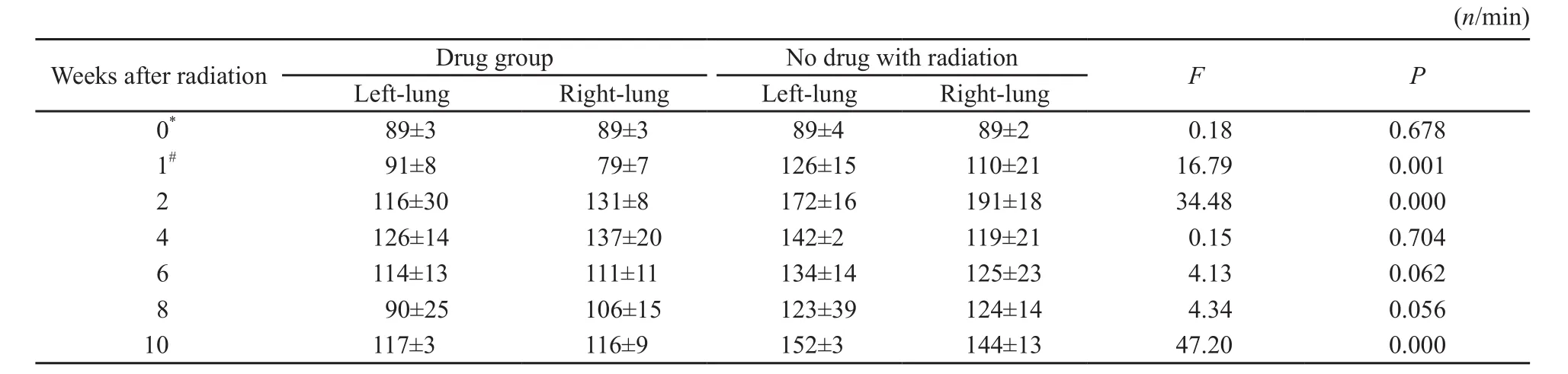
表 1 常规照射部分的呼吸频率Tab. 1 Respiratory frequency of the arm with conventional fractionation radiation

表 2 单次照射部分的呼吸频率Tab.2 Respiratory frequency of the arm with single fractionation radiation
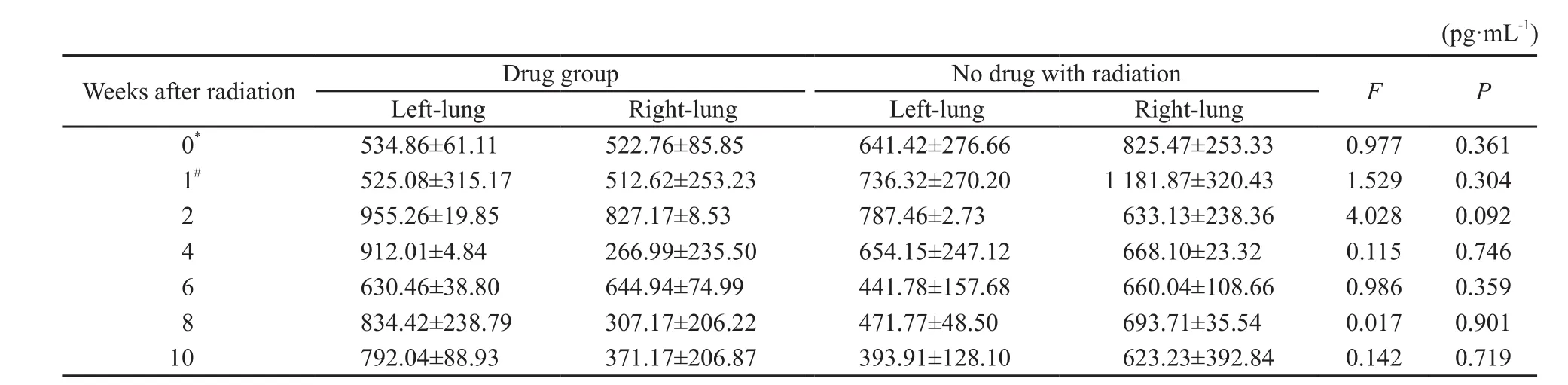
表 3 常规照射部分的血清TGF-β1的结果Tab. 3 TGF-β1 of the arm with conventional fractionation radiation
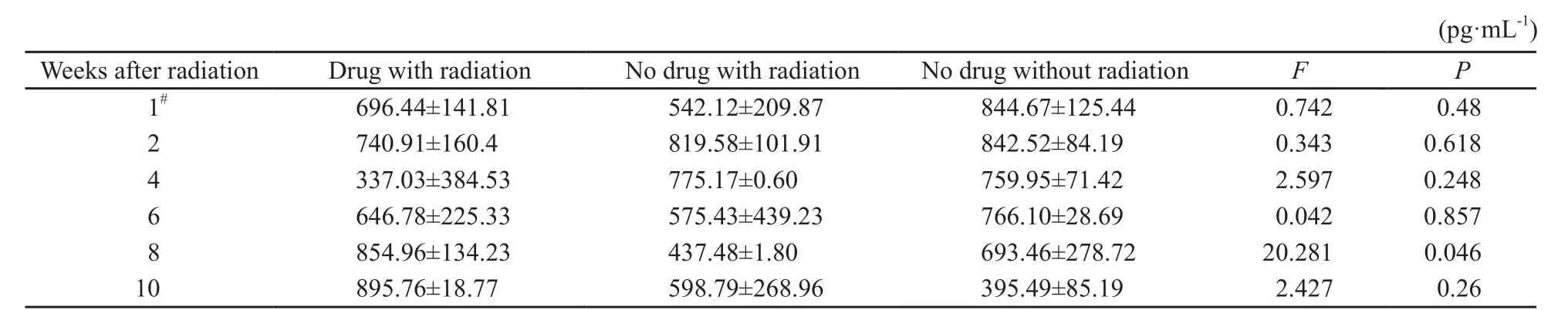
表 4 单次照射部分的血清TGF-β1的结果Tab. 4 TGF-β1 of the arm with single fractionation radiation
2.4 病理变化
2.4.1 常规照射部分
肺组织HE、Masson’s和Weigen’s染色显示,与正常肺泡壁比较,照射对照组的肺泡壁明显增厚,其肺泡间质大部分为增生纤维组织和弹力纤维组织,而在照射加药组虽也有肺泡壁增厚和纤维化,但与单纯照射组相比不太明显,可见大部分肺泡结构存在,肺泡壁的纤维化增生较单纯照射组减轻(图1)。免疫组织化学TGF-β1染色显示正常组织为阴性或弱阳性的表达,单纯照射组的肺组织TGF-β1染色表达多为阳性或中强阳性,照射加药组表达为弱阳性或阳性(图1,表5)。
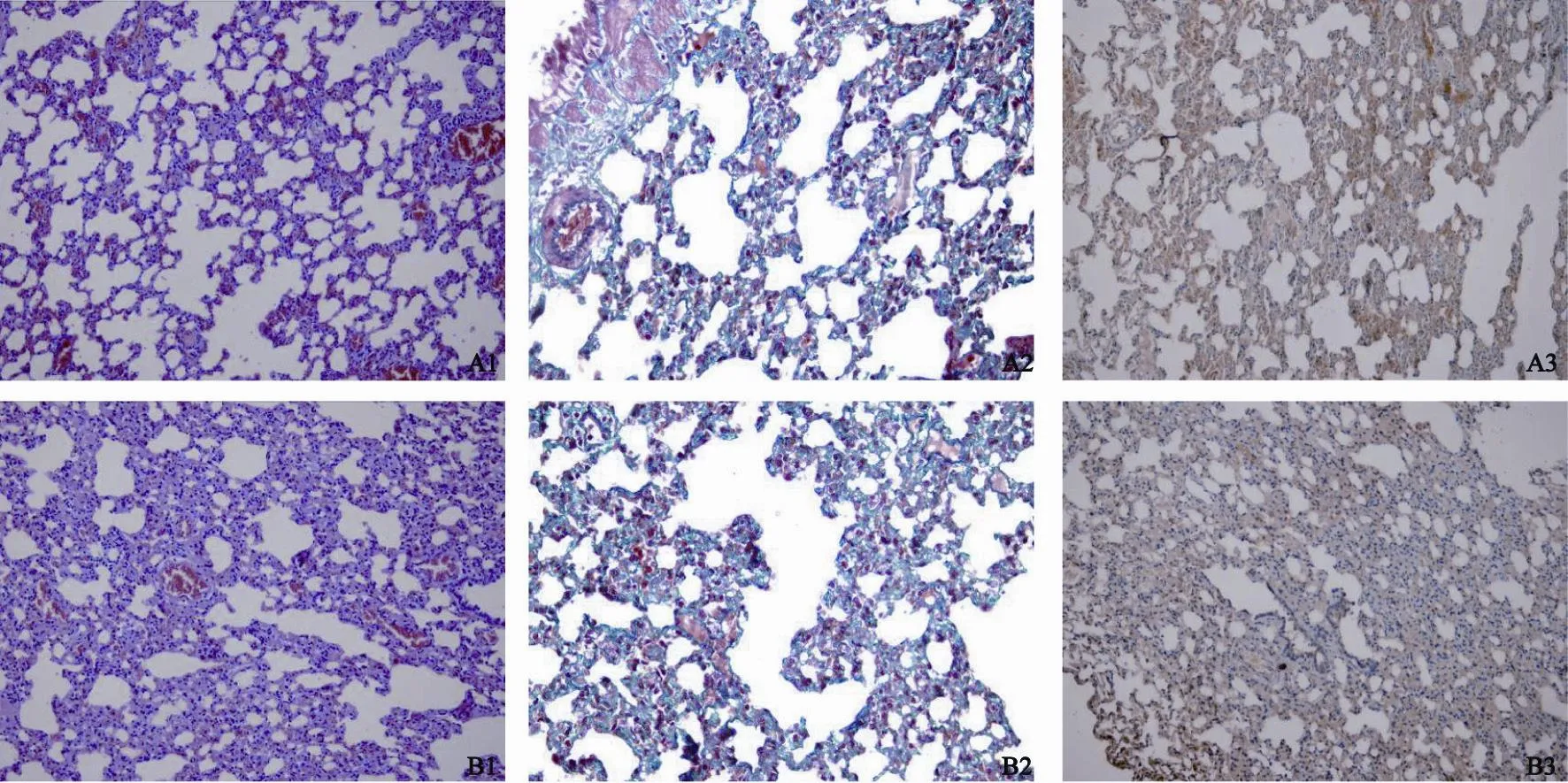
图 1 常规照射后肺组织切片不同染色方法Fig. 1 Lung tissue sections with different staining methods after conventional radiation
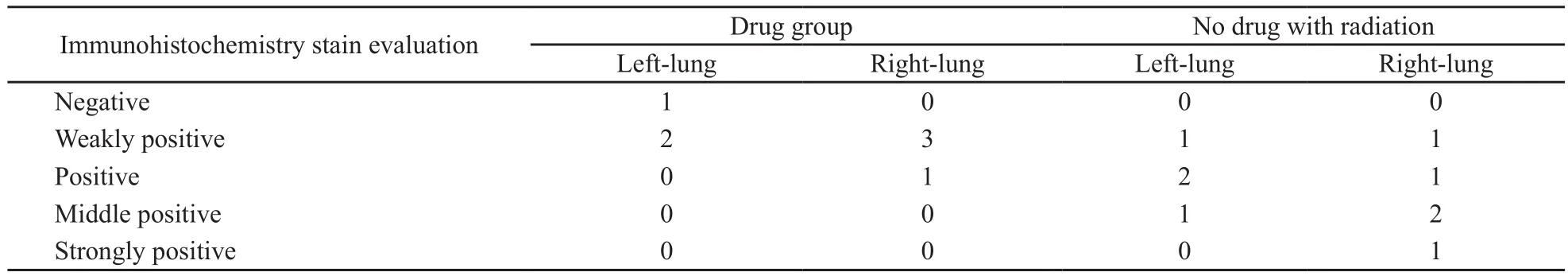
表 5 常规照射部分肺组织TGF-β1染色的结果Tab. 5 TGF-β1 staining of lung tissue in conventional fractionation radiation arm
2.4.2 单次照射部分
肺组织HE、Masson’s和Weigen’s染色显示,单纯照射组的肺泡壁明显增厚,其肺泡间质为增生纤维组织和弹力纤维组织(所谓的肺泡壁纤维化),而在照射加药组有肺泡壁增厚和纤维化,但与单纯照射组相比较度弱,肺泡壁的纤维化增生较单纯照射组减轻(图2)。免疫组织化学TGF-β1染色显示空白对照组为阴性或弱阳性的表达,单纯照射组的肺组织TGF-β1染色表达为阳性或中强阳性,照射加药组表达为弱阳性或阳性,但照射加药组比空白对照组的表达要高(图2,表6)。
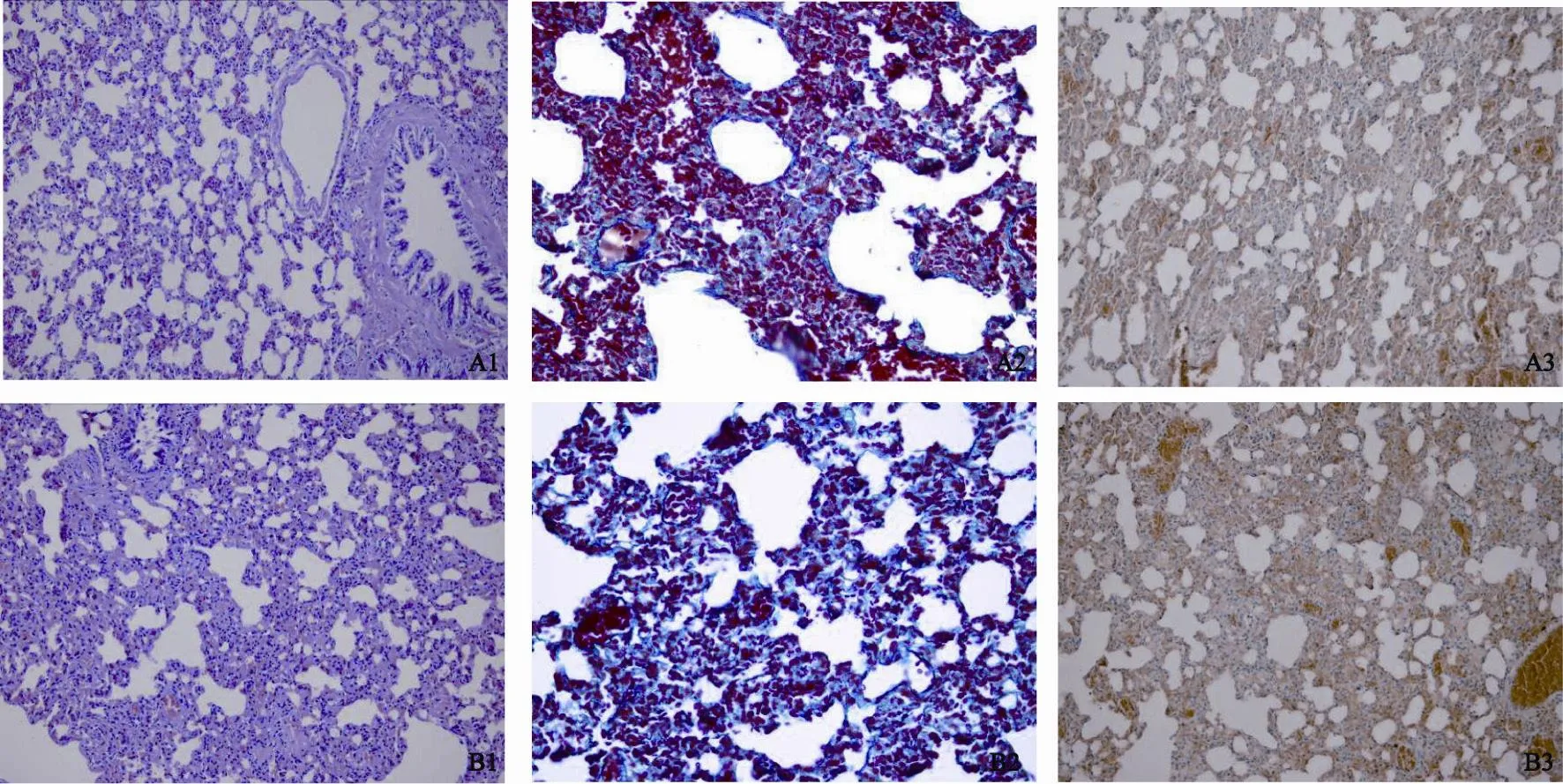
图 2 单次大剂量照射后肺组织切片不同染色方法Fig. 2 Lung tissue sections with different staining methods after single fractionation radiation

表 6 单次照射部分肺组织TGF-β1染色的结果Tab. 6 TGF-β1 staining of lung tissue in single fractionation radiation arm
2.5 体质量变化情况
2.5.1 常规照射部分
统计每两周大鼠的体质量至观察结束。其中在常规照射期间,用药照射组在放疗开始后体质量明显下降,而对照照射组体质量下降不明显,与放射治疗前使用阿米福汀的用药照射组之间体质量变化差异有统计学意义(P<0.05);放射后及放射结束后2周体质量之间差异有统计学意义(P<0.05),在放疗结束后两组之间的体质量平均值接近,差异无统计学意义(P>0.05,表7)。
2.5.2 单次照射部分
3组之间体质量随测量周数增加而逐渐增加,各组之间差异无统计学意义(P>0.05,表8)。
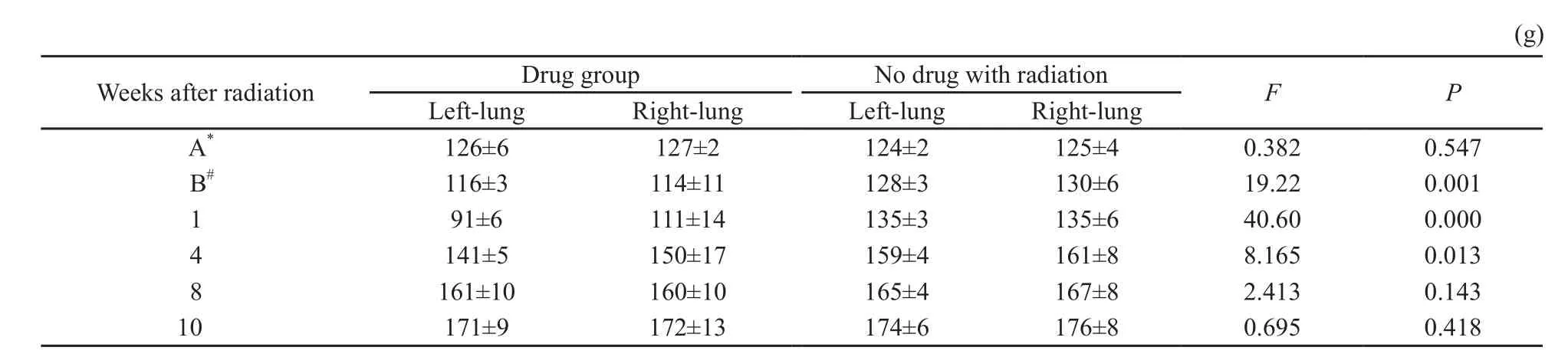
表 7 常规照射部分体质量的变化情况Tab. 7 Weight of the arm with conventional fractionation radiation

表 8 单次照射部分体质量的变化情况Tab. 8 Weight of the arm with single fractionation radiation
3 讨 论
放射性肺损伤在肺部放射治疗中的发生率为6%~20%[3-5]。肺部早期放射损伤主要由于放射引起基因激活的影响,其中包括细胞和组织功能障碍,随之导致血管通透性增加,组织水肿,成纤维细胞、内皮细胞和化学性趋向的巨噬细胞和白细胞产生生长因子和细胞因子,导致辐射炎症。是早期一系列反应的结果,包括炎症基因的激活、血管通透性、血管生成及凋亡的抑制和其他因素的影响[6-7]。放射治疗后放射性肺损伤的发病机制目前主要有细胞因子、靶细胞理论和自由基等几种学说[8],认为其靶细胞为肺泡组织,包括直接损伤和间接损伤,后者起重要作用。Rubin等[9]认为放射性损伤并非单一细胞作用,而是多细胞通过细胞因子的复杂作用引起的,即“细胞因子瀑布”学说。肺受到照射后产生一个前炎症细胞因子和前纤维化因子连锁反应,刺激成纤维细胞增生,促进胶原基因启动,从而形成纤维化病变。基础和临床研究[1]证实,与放射性肺损伤的发生、发展密切相关的细胞因子主要包括促进成纤维细胞增殖分化、调节细胞外基质代谢的TGF-β、血小板衍化生长因子(plateletderived growth factor,PDGF)、成纤维细胞生长因子(fibroblast growth factor,FGFs)、胰岛素样生长因子(insulin-like growth factor,IGFs) 和介导炎性反应为主的肿瘤坏死因子(tumor necrosis factor,TNF)、白介素-1、白介素-6及单核细胞趋化肽(monocyte chemoattractant protein,MCP)等。Anscher等[10]报道TGF-β在放射性肺炎的发病机制中起着关键性作用。TGF-β可促使成纤维细胞分化,在体内,肺组织发生纤维化时,TGF-β及其mRNA增加最显著。目前TGF-β被认为促进胶原产生和沉积的主要细胞因子。肺受放射后纤维组织内的TGF-β增加并刺激成纤维细胞向损伤部位移动、增生、胶原合成增加[10]。Vujaskovic等[11]认为,TGF-β水平的高低反映了放射性肺损伤发生风险的高低,照射后随着时间延长,TGF-β在肺组织中的表达亦逐渐增强。肺Ⅱ型上皮细胞是肺组织细胞中对射线最敏感的细胞之一,在肺受放射后最早出现形态学变化,并在放射后6个月内持续存在损伤变化。大鼠在接受胸部单次大剂量射线照射后可出现放射性肺损伤,研究发现大鼠在接受16~20 Gy的60Co或X射线照射后1个月至半年内,呼吸频率、血清TGF-β1的检测及CT图像上表现出明显变化,提示发生肺纤维化的变化[12-15]。
阿米福汀是由美国Walter Reed陆军研究所在50年代从4 400多种化合物中筛选出来的,最初是作为辐射防护剂[16],是一种毒性更小,对放射性损伤有较大防护的化合物。阿米福汀在体内碱性磷酸酶作用下生成其活性成分:巯基化合物WR-1065,然后在体内可以继续被氧化生成二巯基化合物。用药后,阿米福汀的分布和清除半衰期都很短。在体内迅速磷酸化成为其代谢物WR-1065,分布于全身组织。动物试验表明[17],注射阿米福汀后5~15 min内WR-1065就达到了最高组织浓度,摄取最多的是肾、唾液腺、小肠黏膜、肝、肺组织。阿米福汀是细胞毒性保护剂,能够通过抑制放射线产生的过氧化物的作用而减轻肺损伤,这在临床前期与临床研究中均已显示出其对肺放射性损伤的保护作用。阿米福汀对急性肺放射损伤的保护作用机理目前认为包括:对巨噬细胞活性及血纤维蛋白溶酶原细胞因子激活的减少;是氧自由基有效清除剂,可以减少放射治疗产生的氧自由基,提供修复DNA 损伤所需的氢;降低放射治疗引起的DNA 损伤及凋亡,防护辐射所致的基因突变和癌变等。Vujaskovic等[18]发现阿米福汀可以减少巨噬细胞活性及血纤维蛋白溶酶原细胞因子激活。阿米福汀也能减少TGF-β1的含量与表达。在巨噬细胞的聚积和肺组织TGF-β1的表达和激活中,事先给予阿米福汀也可降低上述过程的发生。Travis等[19]对阿米福汀的放射性肺损伤的保护作用进行了研究观察,发现阿米福汀对大鼠的急性放射性肺损伤产生放射性肺炎和肺纤维化均有明显的保护作用。冯勤付等[20]报道,在用4 MV X射线、总剂量为35 Gy照射右全肺5 d(共5次)时,阿米福汀能增加肺组织对放射性损伤的耐受,对肿瘤无保护作用,不良反应轻。在用4 MV X射线、单次剂量28 Gy照射右全肺时,也能增加肺组织对放射性损伤的耐受,减少了TGF-β1的含量与表达[21]。
本次研究采用了常规照射下,照射大鼠单侧部分肺组织,并随机对比使用阿米福汀和未采用放射保护剂时两组大鼠的肺部病理和呼吸频率、血清TGF-β1等变化。同时也观察了同等治疗条件下,单次大剂量照射在使用阿米福汀和未使用时大鼠肺部的变化情况。研究发现,常规照射组和单次照射组均在照射后出现呼吸频率的增加,其中未用药组频率增加较用药组明显。在常规照射时,用药照射组与单纯照射组在照射结束后2周都出现呼吸频率的增加,其中未使用阿米福汀的大鼠增加程度较使用药物的大鼠呼吸增加明显,呼吸频率增加高峰也比用药组出现的时间提前,持续时间延长,提示对照照射组较用药照射组出现了明显的呼吸功能的损伤。在单次照射部分中,用药照射组与对照照射组也在照射结束后2周出现呼吸频率的增加,其中未使用阿米福汀的大鼠增加程度明显;用药照射组呼吸频率在照射后4周逐渐降低,而未用药组仍波动在较高水平。以上结果均提示阿米福汀在常规照射和单次照射中均减少了放射性肺损伤导致的呼吸症状的发生。在肺部病理切片和TGF-β1免疫组化染色显示,照射区内单次照射部分中对照照射组的肺纤维化明显,其肺纤维化程度明显高于照射加药组。在常规照射部分也显示对照照射组肺放射性损伤程度高于照射加药组。结果显示在放射后10周,大鼠肺部病理损伤处在纤维增生阶段,其中使用阿米福汀的大鼠肺纤维增生程度弱,提示对放射性病理损伤变化也有一定的保护作用。血清TGF-β1的检测也显示在常规照射后用药照射组与单纯照射组都出现血清TGF-β1水平的增加,未用药组出现水平高峰的时间提前,但差异无统计学意义(P>0.05)。而在单次照射部分中,用药照射组与对照照射组也在照射结束后TGF-β1水平增加,但差异无统计学意义(P>0.05)。由于本次研究条件所限,在测量呼吸频率时采用人工测量,未采用机器测量可能会造成测量存在一定误差。
在本实验结果中,阿米福汀显示了对放射性肺损伤的保护作用;然而在常规照射加阿米福汀组,大鼠在照射期间出现体质量比单纯照射组明显下降,治疗结束后体质量才逐渐恢复。由于阿米福汀存在一定的胃肠道反应,所以在常规照射组中使用阿米福汀影响了大鼠的进食造成了体质量下降。说明阿米福汀在保护正常组织免受或少受放射伤害的同时,也存在一定的不良反应。
本研究显示,在单次大剂量照射部分和常规照射部分,阿米福汀可以改善大鼠受到照射后引起的肺部症状,改善了照射后肺部肺泡增生和纤维化程度,但是常规照射中连续应用阿米福汀会带来一定的不良反应,在实际应用中造成了大鼠体质量减轻。
[1] ANSCHER M S, KONG F M, JIRTLE R L, et al. The relevance of transforming growth factor beta 1 in pulmonary injury after radiation therapy[J]. Lung Cancer, 1998, 19(2): 109-120.
[2] FRANKO A J, SHARPLIN J, GHAHARY A, et al. Immunohistochemical localization of transforming growth factorβand tumor necrosis factor α in the lung fibrosis prone and ‘non-fibrosing’ mice during the latent period and early phase after irrradiation[J]. Radiati Res, 1997, 147(2): 245-256.
[3] SCHUCHTER L M, GLICK J. The current status of WR-2721 (Amifostine): A chemotherapy and radiation therapy protector[J]. Biologic Ther Cancer, 1993(3): 1-10.
[4] COLEMAN N, BUMP E, KRAMER R. Chemical modifiers of cancer treatment[J]. J Clin Oncol, 1988, 6(4): 709-733.
[5] 邓涤, 周云峰, 戈伟. 肺癌放射治疗致放射性肺炎的临床分析[J]. 中国肿瘤临床, 2002, 29(12): 866-868.
[6] BOERMA M, VAN DER WEES C G, VRIELING H, et al. Microarray analysis of gene expression profiles of cardiac myocytes and fibroblasts after mechanical stress, ionising or ultraviolet radiation[J]. BMC Genomics, 2005, 6: 6.
[7] TSOUTSOU P G, KOUKOURAKIS M I. Radiation pneumonitis and fibrosis: mechanisms underlying its pathogenesis and implications for future research[J]. Int J Radiat Oncol Biol Phys, 2006, 66: 1281-1293.
[8] 白蕴红, 王德文. 放射性间质性肺炎的自由基生物学机理的探讨[J]. 中华放射医学与防护杂志, 1994, 14(4): 253-255.
[9] RUBIN P, JOHNSTON C J, WILLIAMS J P, et al. A perpetual cascade of cytokines postirradiation leads to pulmonary fibrosis[J]. Int J Radiat Oncol Biol Phys, 1995, 33 (1): 99-109.
[10] ANSCHER M S, KONG F M, MARKS L B, et al. Changes in plasma transforming growth factor beta during radiotherapy and the risk of symptomatic radiation-induced pneumonitis[J]. Int J Radiat Oncol Biol Phys, 1997, 37(2): 253-258.
[11] VUJASKOVIC Z, BRADLEY A, THRASHER I L, et al. Radioprotective effects of amifostine on acute and chronic esophageal injury in rodents [J]. Int J Radiat Oncol Biol Phys, 2007, 69(2): 543-540.
[12] 白蕴红, 王德文, 刘毅, 等. 胸部60Coγ射线照后肺损伤的定量研究[J]. 中华放射医学与防护杂志, 1994, 14(3):173-175.
[13] 李绍东, 徐凯, 程广军, 等. 大鼠放射性肺损伤模型制作及影像学评价[J]. 中国医学影像技术, 2004, 20(7): 1003-1005.
[14] 刘纯杰, 王德文, 高亚兵, 等. 放射性肺纤维化大鼠动物模型的建立及其病变规律[J]. 中国兽医学报, 2000, 20(6):576-579.
[15] 曹珍山, 叶常青, 袁丽珍, 等. 大鼠胸部受到20 Gyγ线照射后肺组织的形态计量学改变[J]. 中华放射医学与防护杂志, 1996, 16(3): 167-169.
[16] SCHUCHTER L M, LUGINBUHL W E, MEROPOL N J. The current status of toxicity protectants in cancer therapy[J]. Seminars Oncol, 1992, 19(6): 742-751.
[17] UTLEY J F, MARLOWE C, WADDELL W J. Distribution of 35S-labeled WR-2721 in normal and malignant tissues of the mouse[J]. Radiat Res, 1976, 68: 284-291.
[18] VUJASKOVIC Z, FENG Q F, RABBANI Z N, et al. Radioprotection of lungs by amifostine is associated with reduction in profibrogenic cytokine activity[J]. Radiat Res, 2002, 157(6): 656-660.
[19] TRAVIS E L, PARKINS C S, HOLMES S J, et al. WR-2721 protection of pneumonitis and fibrosis in mouse lung after single doses of X rays[J]. Int J Radiat Oncol Biol Phys, 1984, 10(2): 243-251.
[20] 冯勤付, VUJASKOVIC Z, BRIZEL D M, 等. 阿米福汀对放射性肺损伤保护作用的实验研究[J]. 中华放射肿瘤学杂志, 2001, 10(4): 250-254.
[21] 冯勤付, VUJASKOVIC Z, BRIZEL D M, 等. 阿米福汀对单次肺照射的保护作用及TGF-β1活性的影响[J]. 中华放射肿瘤学杂志, 2004, 13(3): 222-225.
Assessment research of the protective effect of Amifostine on radiation- induced lung injury of rats
MEI Xin1, ZHANG Qian1, LIU Ying-mei2, CHEN Jia-yi1, ZHANG Zhen1, GUO Xiao-mao1(1. Department of Radiotherapy, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2. Department of Out-patient Clinic, Obstetrics and Gynecology Hospital of Fudan University, Shanghai 200032, China)
GUO Xiao-mao E-mail: guoxm1800@126.com
Background and purpose:Radiation-induced lung injury is a common complication in thoracic tumor after radiation therapy. How to protect the lung tissues from radiation injury is very important during radiotherapy. As a kind of radiation-protective agents, this study aimed to assess the protective effects of amifostine on acute lung tissues’ radiation-induced injury in the rats by radiated with chest wall tangent technology. Methods:Thirty-five female Fish-344 rats were randomized into 2 arms of 2 different fraction schedule: Conventional fraction, 20 rats were irradiated in 50 Gy per 25 fractions in 25 days. They were further randomized into 2 subgroups: 10 with amifostine and 10 rats radiation alone without drug. Single fraction, 15 rats irradiated with 20 Gy in one fraction to the right lung. Three subgroups were randomized as: 5 rats in irradiation plus amifostine; 5 rats irradiation alone and 5 in control subgroup. Amifostine (140 mg/kg) was given intraperitoneally 30 minutes before irradiation. Breathing rate, weight variation and plasmas of transforming growth factor-β (TGF-β) 1 levels were recorded after irradiation. The lung tissue of irradiated side and the same side of control group were processed for hematoxylin and eosin staining, Masson’s and Weigen’s staining and TGF-β1 immunohistochemistry staining. Results:In both arms, breathing rate increased in rats got irradiated, however, the coming time of fastest breathing rate delayed in rats with amifostine. There is no difference among all subgroups of TGF-β1 level in the plasma. Hematoxylin and eosin staining and Masson’s and Weigen’s staining revealed alveolar wall became thicker and the pulmonary tissue fibrosis in irradiation alone group. However, in the radiation with amifostine group, no matter what schedule of fractionation, much more of the lung architecture was preserved and fibrosis was lessened. Immunohistochemistry staining was expressed positive to strongly positive in irradiation alone groups, but weakly positive to positive in irradiation with amifostine groups. In arm of conventional fraction group, compared with radiation alone group, weight loss in rats with amifostine used group was much more and had significant difference right after radiation initiated, but became closer when radiation finished. In arm of single fraction group, there was no significant difference of weight loss among 3 groups. Conclusion:This preclinical research showed amifostine can improve radiation-induced pneumonias symptoms, pulmonary alveoli hyperplasia and the pulmonary tissue fibrosis in rats either with conventional or single dose fractionation irradiation. Weight loss in rats with conventional fractionation may related to the side effect of amifostine with continuous apply.
Amifostine; Radiation-protective agents; Radiation injuries; Rats
R730.55
:A
:1007-3639(2013)01-0001-09
2012-07-01
2012-12-20)
上海市科委课题资助项目(No:4119709)。
郭小毛 E-mail:guoxm1800@126.com
DOI: 10.3969/j.issn.1007-3969.2013.01.001
