可见光催化剂ZnWO4-CdS的合成及其光催化性质
2013-05-23鲜开诚赵绍娟李海照宋继梅
鲜开诚,赵绍娟,钱 程,李海照,宋继梅
(安徽大学化学化工学院,功能无机材料化学安徽省重点实验室,安徽 合肥 230601)
染料以废水的形式排放到生态系统中引起了水体的富营养化影响了水生生物的生长,导致环境破坏[1]。半导体光催化氧化作为一种新型的废水处理技术,在环保等领域具有广阔的应用价值[2-6],光催化降解有机污染物在环境净化方面发挥了巨大的作用[7-11]。作为一种重要的光催化剂,ZnWO4已被广泛应用于紫外光下裂解水及矿化有机污染物等[12-13]。然而紫外光能量高、耗能大,且太阳光中仅包含约5%的紫外光[14],太阳光的利用率低,限制了ZnWO4在工业生产中的应用[15]。因此,将Zn-WO4改性使其在可见光下具有光催化活性是目前研究的热点之一。
迄今为止,有多种手段能够提高和改善半导体的光催化活性,比如控制产物的形貌、提高结晶度、进行离子掺杂以及与其他半导体复合等[13,16-20]。在各种改性方法中,半导体材料复合可以有效提高光生电子与空穴的分离,降低光生电子和空穴的复合率,提高半导体的光催化活性。Kezhen Lv等[14]通过水热法合成了WO3/TiO2纳米复合物,在紫外光下催化降解次甲基蓝的效果明显高于TiO2;朱永法等[21]用水热方法合成了F-ZnWO4,表明F的掺杂有利于 ZnWO4光催化活性的提高;He Dongqing[22]等合成了 Bi2WO6/ZnWO4复合物,研究了其光催化降解罗丹明B及电子转移的性质,结果表明复合光催化剂在紫外光的照射80 min下降解效果比ZnWO4高很多;由于WO3易光腐蚀而很难获得稳定的光催化性能,本实验组[23]将MoO3掺入到WO3粉体中,提高了WO3的光催化活性;将WO3与Cu2O进行复合[24],复合物对阳离子染料次甲基蓝的光催化活性明显高于纯的Cu2O。CdS是一种重要的半导体材料,因其具有独特的电学和光学特性,被广泛应用于太阳能转换和异质光催化中。本文通过简单的水热方法将窄帯隙的CdS纳米颗粒负载到ZnWO4纳米棒表面制备可见光响应的Zn-WO4—CdS催化剂,研究其光催化降解次甲基蓝的活性及溶液pH、CdS的复合量等对降解效果的影响,提出了可能的催化反应机理。
1 实验部分
1.1 主要仪器和试剂
钨酸钠(Na2WO4·2H2O),硝酸锌(Zn(NO3)2·6H2O),氢氧化钠(NaOH),硫酸镉(CdSO4),硫化钠(Na2S),无水乙醇(CH3CH2OH)。所有试剂均为分析纯,未进行进一步纯化,实验用水为蒸馏水。
901-2型恒温磁力搅拌器(上海沪西仪器有限公司);电子天平(FA1054N,上海精密科学仪器有限公司);台式离心机(TAL80-2B,上海安亭科学仪器厂);电热恒温鼓风干燥箱(DH5G-9053A,上海一恒科学仪器有限公司);X射线衍射仪(Philips X’Pert Pro Super,日本岛津公司);紫外-可见分光光度计(SP-752,上海光谱仪器有限公司);透射电子显微镜(J-2100,日本日立公司);氙灯(PLS-SEX300/300UV,北京泊菲莱科技有限公司)。
1.2 催化剂的制备
将2 mmol Na2WO4·2H2O和2 mmol Zn(NO3)6·6H2O分别溶于20 mL蒸馏水中。在剧烈搅拌下,将上述两种溶液混合,立即产生白色沉淀,用1 mol/L NaOH溶液调悬浮液酸度使pH=8。然后,将新制备的CdS按照一定的比例(CdS与Zn-WO4的摩尔比分别为 0,0.025,0.05,0.1,0.2,0.3,0.4)加入到上述悬浮液中,继续搅拌0.5 h,转移至60 mL Teflon内胆的不锈钢反应釜内,140℃下反应48 h。反应完成后,自然冷却至室温,离心过滤,用蒸馏水和无水乙醇洗涤数次,60℃真空干燥5 h,得到淡黄色粉末。产物分别标记为M0,M0.025,M0.05,M0.1,M0.2,M0.3,M0.4。
1.3 结构和性能表征
产物的物相用 Philips X’Pert Pro Super型X射线衍射(XRD)仪 (Cu Kα射线,λ=0.154178 nm,石墨单色器,管电压40 kV,管电流50 mA,扫描范围10~90°)测定;粒子的形貌用透射电子显微镜(J-2100型,日本电子,工作电压200 kV)观测;紫外可见吸收光谱通过紫外光谱仪(UV-3600,日本)进行测定;可见光来源于氙灯(PLS-SEX300/300UV,工作电流为15 A);zata电位通过微电泳仪(JS94H)来测定;降解后次甲基蓝的吸光度用可见分光光度计(型号722,上海天祥光学仪器有限公司)测定。
1.4 光催化性能测试
取10 mg/L次甲基蓝溶液100 mL,加入适量催化剂粉末,搅拌、避光放置30 min,使催化剂达到吸附解吸平衡。然后在可见光的辐照下,每隔20 min取5 mL反应液离心分离,保留上清液用可见分光光度计测定其吸光度。在实验所选用的浓度范围内,次甲基蓝溶液的吸光度与其浓度成正比。光催化降解率D,通过公式D=(C0-C)/C0进行计算,C0为次甲基蓝原溶液的浓度,C为降解后次甲基蓝溶液的浓度。
2 结果与讨论
2.1 产物的表征
2.1.1 物相表征
图1给出了合成产物的XRD衍射花样,M0所有衍射峰均与标准卡片(JCPDS 15-0774)单斜相ZnWO4相吻合,没有杂质峰出现,表明合成的产物是纯ZnWO4。随着CdS复合量的增加,ZnWO4的一部分衍射峰逐渐变宽、强度减弱甚至消失,而在2θ=28°处的衍射峰慢慢出现且强度逐渐变大,说明CdS的复合对ZnWO4晶相有一定影响。为了进一步确认2θ=28°处出现的衍射峰,将CdS复合量最大的样品M0.4的衍射花样与CdS的衍射花样进行对比(如图2),从图中看出,ZnWO4在2θ=28°处没有衍射峰,而CdS有强烈的衍射峰,表2θ=28°处的衍射峰归属于为 CdS。综上,本实验进行了成功的CdS复合。
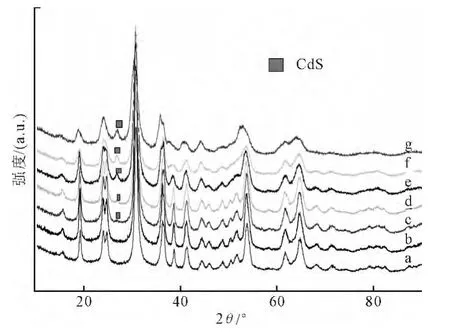
图1 合成产物的XRD衍射花样
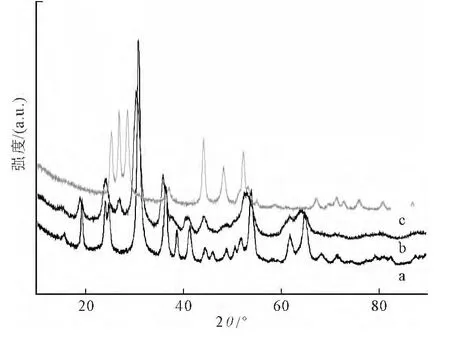
图2 合成样品的XRD花样
2.1.2 形貌表征
为了观测合成产物的形貌和大小,我们拍摄了M0(即ZnWO4)和M0.3样品的透射电子显微镜照片(图3)。从图3a中可以观察到未复合的纯ZnWO4为长约150 nm,直径约10 nm的纳米棒;从图3b可知,在ZnWO4纳米棒的表面分布着约20 nm大小的纳米颗粒,初步推断此纳米颗粒为CdS。

图3 合成样品的透射电镜照片
2.1.3 紫外-可见吸收光谱表征
图4为系列合成样品的紫外可见吸收光谱。从图可见:ZnWO4(M0)的吸收光谱延伸约至340 nm,吸光范围较窄;CdS的吸收光谱延伸约至570 nm,有很宽的光响应范围;而复合物ZnWO4—CdS的吸收边缘约在550 nm,相对于ZnWO4来说,吸收边发生明显“红移”。众所周知,对于半导体晶体,在能带附近的光吸收符合公式 αhν=A(hν-Eg)n/2。公式中α,ν,Eg和A分别表示吸收系数,光的频率,能带和常数。根据图4和上述公式可以计算得到样品的带隙能(Eg)。合成产物ZnWO4和M0.3的带隙能分别是3.47 eV和2.69 eV,表明半导体CdS的复合的确减小了复合催化剂的带隙。可以推断,Zn-WO4—CdS吸收边的“红移”是由于复合了窄帯隙的CdS所致。Duliang He[22]也有相似的报道。ZnWO4-CdS复合物的带隙变窄,意味着其不仅能够吸收紫外光而且能够吸收可见光,为有效地利用太阳光提供了可能性。
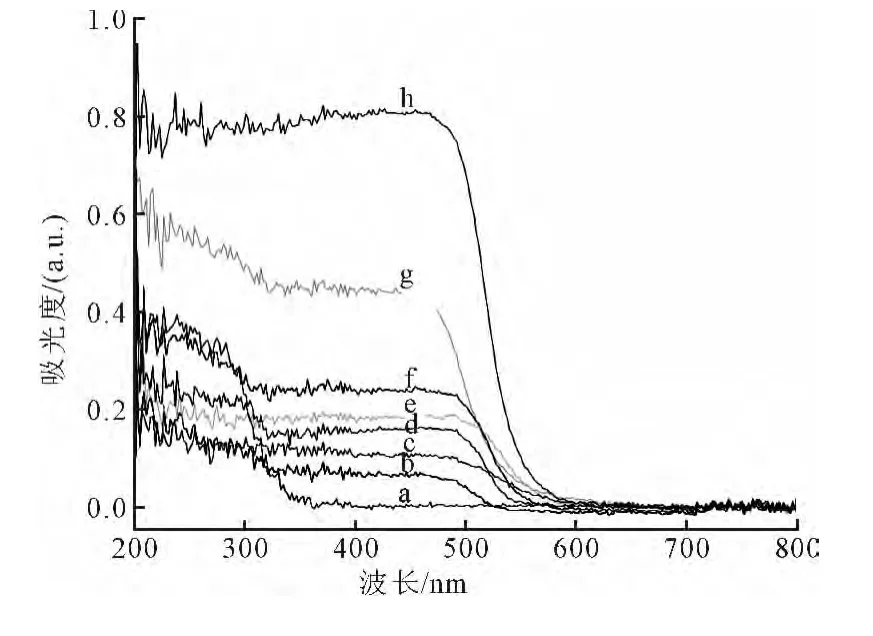
图4 产物的紫外-可见吸收光谱
2.2 光催化性质
2.2.1 CdS 复合量的影响
图5给出了不同CdS复合量的ZnWO4-CdS在可见光下催化降解次甲基蓝的效果。由图可知,样品 M0,M0.025,M0.05,M0.1,M0.2,M0.3,M0.4对次甲基蓝的降解率分别为:9.4%,59.7%,60.3%,63.1%,66.1%,74%,65.6%。显然,ZnWO4- CdS 复合物的催化明显高于纯的ZnWO4。也就是说,复合改善了催化剂的催化活性。另外,ZnWO4-CdS复合物的光催化活性不是随着CdS复合量的增加而线性增大,当CdS与ZnWO4的摩尔比为0.3时,其光催化效率最高。当复合少量的CdS后,因纯ZnWO4在可见光下不能被激发,而CdS能够被可见光激发产生电子,所以光催化活性得到提高。但是,当CdS的复合量过多时,过量的CdS会成为电子和空穴的复合中心,增加了光生电子和空穴的复合率,从而降低复合物的光催化活性。因此,并非复合CdS的量越多,对ZnWO4的改性效果越好。合适的CdS的复合量有利于提高ZnWO4-CdS的光催化降解次甲基蓝的效率。
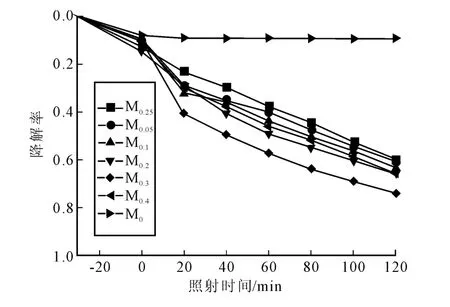
图5 不同比例的ZnWO4-CdS复合物对MB降解率的影响
2.2.2 溶液pH的影响
图6给出了ZnWO4-CdS(M0.3)在不同的 pH条件下对次甲基蓝的降解情况。从图中可以看出,样品M0.3在碱性条件下的光催化效果较好,优于酸性环境和中性环境。为了解释这一现象,测定了样品M0.3的Zeta电位,结果如表1。从表中可以看出,样品 M0.3的 Zeta 电位均为负值,说明样品 M0.3表面带负电荷。次甲基蓝本身为阳离子染料,表面带正电荷,容易被吸附在催化剂的表面。催化剂的Zeta电位越低,静电吸附作用越强,吸附效果越好,说明样品与染料之间为静电吸引作用。据文献报导[25],Zeta电位绝对值越大,分散体系就越稳定。当pH为9时,Zeta电位的绝对值最大(表1),样品分散的越好,与次甲基蓝接触点的越多,吸附效率会更好。众所周知,吸附在光催化反应中扮演者至关重要的角色,有机污染物只有被吸附在催化剂的表面才能与光生电子和空穴作用,从而发生氧化还原反应,所以样品M0.3在碱性条件下的光催化效果优于中性和酸性介质。
表1 不同pH下黑暗中样品M0.3对次甲基蓝的脱色率和Zeta电位
图6 M0.3对次甲基蓝在不同的pH下的催化降解率
2.2.3 染料种类的影响
为了进一步证实光催化剂M0.3与染料之间的相互静电吸附作用,在可见光下使用M0.3为催化剂,分别观测了其对阳离子染料次甲基蓝和阴离子染料甲基橙的吸附和降解情况,结果如图7。从图中可以看出M0.3对次甲基蓝的吸附和光催化效果明显优于甲基橙,在可见光下照射120 min,对次甲基蓝的降解率D为74%,对甲基橙的降解率D仅为26%,可见M0.3与染料之间确为静电相互作用。
图7 M0.3对不同种类染料的催化降解率
2.2.4 光催化机理
半导体的能带结构和带隙对于催化降解有机染料具有重要的作用,不同的价带(VB)和导带(CB)氧化还原能级的两个相互接触的半导体有利于提高光生电荷的分离和有效的界面电荷转移[26]。一般来说,半导体异质结接触面的带边位置是有效转移光生电荷的重要因素。据文献报道[22,26],ZnWO4-CdS复合物的能带结构如图8。当可见光照射到ZnWO4-CdS复合物的表面,由于CdS的带隙较窄而被激发,光生电子将从CdS的价带(VB)跃迁到其导带(CB)。因为CdS的导带位置高于ZnWO4,一部分电子将会从CdS的导带迁移到的ZnWO4导带;而ZnWO4的价带位置低于CdS,导致部分光生空穴由ZnWO4向CdS迁移,从而使光生电子和空穴得到有效的分离,避免了它们的复合。光生电子和空穴可以在ZnWO4和CdS之间定向转移,增加了光生载流子的寿命,致使光生电子和空穴得到有效的分离,降低了电子空穴对的复合率,提高了催化剂ZnWO4-CdS的光量子效率。同时,ZnWO4与CdS之间的界面又阻碍了光生电子的复合(图9),所以复合催化剂改善了光催化降解亚甲基蓝的催化活性。
图8 ZnWO4及CdS的能带示意图
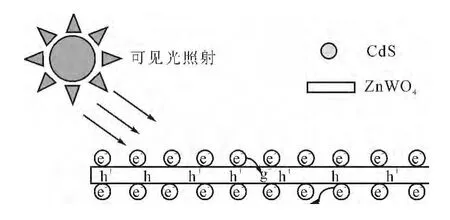
图9 ZnWO4-CdS在可见光辐照下的氧化还原示意图
众所周知,光催化过程中存在多种的活性物质,如:光生电子、空穴、羟基自由基(·OH)等。为了更进一步探索ZnWO4-CdS降解次甲基蓝光催化过程中起主要作用的活性物质,在降解过程中加入了不同的活性物质捕获剂,实验结果如表2。数据表明加入捕获剂后光催化降解性能明显的降低,且加入3种不同的捕获剂后,降解效率都有所降低,但降低幅度没有非常明显的差别。说明在本实验的过程中,光生电子、空穴、羟基自由基(·OH)共同起作用。此外,催化剂循环使用3次,降解率分别为74%、73%和73%,催化活性并无明显改变,表明ZnWO4-CdS在光催化过程中性能稳定。

表2 加入不同活性物质捕获剂后的MB降解率 %
3 结论
通过简单的低温水热法,制备了纳米级可见光催化剂ZnWO4-CdS,对 ZnWO4进行了成功的改性。当CdS与ZnWO4的摩尔比为0.3时,光催化活性最高。ZnWO4-CdS在碱性环境中显示了高的催化活性,这或许与ZnWO4-CdS的表面所带的负电荷有关。在光催化降解次甲基蓝的过程中,光生电子、空穴、羟基自由基共同起作用。催化剂循环使用3次过后,催化活性无明显降低。
[1]Fu,H.;Pan,C.;Yao,W.;Zhu,Y.,Visible - light-induced degradation of rhodamine B by nanosized Bi2WO6[J].The Journal of physical chemistry B,2005,109(47):22432-22439.
[2]HONDA,A.F.K.,Electrochemical Photolysis of Water at a Semiconductor Electrode[J].Nature,1972,238(5358):37-38.
[3]Zhang,L.;Xu,T.;Zhao,X.;Zhu,Y.,Controllable synthesis of Bi2MoO6and effect of morphology and variation in local structure on photocatalytic activities[J].Applied Catalysis B:Environmental,2010,98(3-4):138-146.
[4]Li,D.;Pan,C.;Shi,R.;Zhu,Y.,Controllable synthesis of Fe5(PO4)4(OH)3·2H2O as a highly efficient heterogeneous Fenton - like catalyst[J].CrystEngComm,2011,13(22):6688-6693.
[5]Shi,R.;Wang,Y.;Zhou,F.;Zhu,Y.,Zn3V2O7(OH)2(H2O)2and Zn3V2O8nanostructures:controlled fabrication and photocatalytic performance[J].Journal of Materials Chemistry,2011,21(17):6313 -6320.
[6]Yu,J.;Hai,Y.;Cheng,B.,Enhanced Photocatalytic H2-Production Activity of TiO2by Ni(OH)2Cluster Modification[J].The Journal of Physical Chemistry C,2011,115(11):4953-4958.
[7]Li,D.;Zhu,Y.,Synthesis of CdMoO4microspheres by self- assembly and photocatalytic performances[J].CrystEngComm,2012,14(3):1128-1134.
[8]Pan,C.;Zhu,Y.,Size- controlled synthesis of BiPO4nanocrystals for enhanced photocatalytic performance[J].Journal of Materials Chemistry,2011,21(12):4235-4241.
[9]Shi,R.;Lin,J.;Wang,Y.J.;Xu,J.;Zhu,Y.F.,Visible-Light Photocatalytic Degradation of BiTaO4Photocatalyst and Mechanism of Photocorrosion Suppression[J].The Journal of physical chemistry C,2010,114(14):6472-6477.
[10]Xu,T.;Zhang,L.;Cheng,H.;Zhu,Y.,Significantly enhanced photocatalytic performance of ZnO via graphene hybridization and the mechanism study[J].Applied Catalysis B:Environmental,2011,101(3 -4):382-387.
[11]Lin,J.;Zong,R.;Zhou,M.;Zhu,Y.,Photoelectric catalytic degradation of methylene blue by C60-modified TiO2nanotube array[J].Applied Catalysis B:Environmental,2009,89(3-4):425-431.
[12]Shi,R.;Wang,Y.;Li,D.;Xu,J.;Zhu,Y.,Synthesis of ZnWO4nanorods with[100]orientation and enhanced photocatalytic properties[J].Applied Catalysis B:Environmental,2010,100(1-2):173-178.
[13]Lin,J.;Zhu,Y.,Controlled synthesis of the ZnWO4nanostructure and effects on the photocatalytic performance[J].Inorganic chemistry,2007,46(20):8372 -8378.
[14]Lv,K.;Li,J.;Qing,X.;Li,W.;Chen,Q.,Synthesis and photo-degradation application of WO3/TiO2hollow spheres[J].Journal of hazardous materials,2011,189(1-2):329-35.
[15]Song,J.;Wang,H.;Hu,G.;Zhao,S.;Hu,H.;Jin,B.,ZnWO4–Cu system with enhanced photocatalytic activity by photo-Fenton-like synergistic reaction[J].Materials Research Bulletin,2012,47(11):3296-3300.
[16]Huang,G.;Zhu,Y.,Synthesis and photocatalytic performance of ZnWO4catalyst[J].Materials Science and Engineering:B,2007,139(2-3):201-208.
[17]Guo,P.;Liu,C.;Gao,M.;Wang,X.;Guo,H.,Effect of ZSM-5 Crystal Size on Properties of Supported TiO2Photocatalyst[J].Chinese Journal of Catalysis(Chinese Version),2010,31(5):573-578.
[18]蒋引珊,金为群,张 军,等.TiO2/沸石复合物结构与光催化性能[J].无机材料学报,2002,17(6):1301-1305.
[19]李 莉,陆 丹,计 远,等.纳米复合材料 Ag/TiO2-ZrO2的制备及其微波增强光催化降解甲基橙[J].物理化学学报,2010,26(5):1323 -1329.
[20]刘兴平,蒋荣英,柳 松.TiO2/Mo-TiO2的制备、表征和光催化活性[J].催化学报,2010,31(11):1381-1387.
[21]Guangli,H.;Shicheng,Z.;Tongguang,X.;Yongfa,Z.,Fluorination of ZnWO4Photocatalyst and Influence on the Degradation Mechanism for 4 - Chloropheno[J].Environmental Science and Technology,2008,42:8516-8521.
[22]He,D.;Wang,L.;Xu,D.;Zhai,J.;Wang,D.;Xie,T.,Investigation of photocatalytic activities over Bi2WO6/ZnWO4composite under UV light and its photoinduced charge transfer properties[J].ACS applied materials& interfaces,2011,3(8):3167-3171.
[23]宋 娟,宋继梅,胡 媛,等.MoO3掺杂WO3催化剂的制备及其光催化性能[J].环境化学,2008,27(6):721-725.
[24]宋继梅,王 红,张小霞,等.Cu2O-WO3复合物的制备及其光催化性质研究[J].功能材料,2012,43(1):28-35.
[25]魏俊峰,陈泉水.Zeta电位测试数据稳定性的检验[J].江西地质,1997,33(1):76-79.
[26]Ge,L.;Liu,J.,Efficient visible light- induced photocatalytic degradation of methyl orange by QDs sensitized CdS - Bi2WO6[J].Applied Catalysis B:Environmental,2011,105(3-4):289-297.
