双孢菇废弃物菇柄多糖提取工艺研究
2013-05-15侯传伟王安建李顺峰魏书信
侯传伟,王安建,李顺峰,沈 琪,2,魏书信
(1.河南省农科院农副产品加工研究所,河南郑州450002;2.河南农业大学食品科学技术学院,河南郑州450002)
多糖具有多种生物活性,可提高免疫力、降血糖、抗肿瘤、抗病毒等,由于其功能独特,并且毒性较低,因此在抗衰老、抗病毒和肿瘤、糖尿病治疗等方面有良好的应用前景[1]。同时多糖还可以改善食品的食用品质、加工特性和外观特性,可用于抑制脂质氧化[2],稳定酸性饮料[3],作为乳化剂[4]等,在食品中的用途十分广泛。双孢菇(Agaricus Bisporus)属伞菌目蘑菇科蘑菇属大型真菌,具有较高的营养价值和药用价值,享有“素中之王”的美称,是我国目前出口量最大、创汇最高的一种食用真菌[5-7]。双孢菇不仅是一种味道鲜美,营养齐全的菇类蔬菜,而且是具有保健作用的健康食品,含有多种有效药物成分,其中多糖是重要成分之一[8]。然而,在双孢菇收获和加工过程中大量的菇柄作为废弃物被丢弃,既污染环境又造成了资源的浪费。因此,从双孢菇废弃物菇柄中提取有效功能成分,不仅可以减少对环境的污染,还可以提高菇农和蘑菇生产加工企业的经济效益,对双孢菇废弃物菇柄进行合理的开发和利用具有重要的现实意义。本实验采用单因素和正交实验法[9-10]对水提醇沉法[11]提取双孢菇菇柄多糖的条件进行优化研究,以确定最佳的提取工艺,为双孢菇废弃物菇柄多糖产品的开发提供理论依据和技术支持。
1 材料与方法
1.1 材料与仪器
双孢菇菇柄 采自河南省驻马店西平县食用菌培养基地;葡萄糖(105℃干燥至恒重)、98%浓硫酸、重蒸苯酚、无水乙醇等 均为国产分析纯;实验用水 均为蒸馏水。
GZX-9140MBE型数显鼓风干燥箱 上海博迅实业有限公司医疗设备厂;万能粉碎机 上海金刚电器厂;精密电子天平 常州万泰天平仪器有限公司;HZ-B水浴恒温振荡器 上海博远实业有限公司医疗设备厂;H2050R型高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;UV-2802型紫外可见分光光度计 上海尤尼柯仪器有限公司。
1.2 实验方法
1.2.1 多糖含量测定 采用硫酸-苯酚法测定多糖含量[12-13]。分别精确吸取浓度为100mg/L的葡萄糖标准溶液0、0.1、0.2、0.4、0.6、0.8、1.0mL 置于 25mL 比色管中,加水至2.0mL,再分别加入5%重蒸苯酚溶液1.0mL和浓硫酸5.0mL,摇匀放置10min后,置于20~30℃水浴中保温15min。然后在490nm波长处测定吸光值,以葡萄糖含量(mg/mL)为横坐标,吸光值为纵坐标,绘制标准曲线(图1),回归方程为y=7.8389x+0.0034(R2=0.9997)。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
1.2.2 双孢菇菇柄多糖提取方法 本实验采取水提醇沉的方法提取双孢菇菇柄中的多糖,提取方法[14]如下:双孢菇菇柄40℃烘干后粉碎过60目筛,准确称取干粉2.00g,加适量水,在一定温度下水浴一段时间后4000r/min离心10min,上清液定容至50mL。取定容后上清液10mL,加入适量乙醇,混匀,置4℃冰箱中醇析沉淀多糖1h,4000r/min离心10min,弃上清液,所得沉淀用水溶解后定容至50mL。吸取上述溶液0.5mL,按1.2.1步骤测定多糖含量。每组实验重复3次,取其平均值。依据标准曲线,计算多糖得率。
多糖得率(%)=多糖量/双孢菇菇柄量×100
1.2.3 双孢菇菇柄多糖提取正交实验设计 依据单因素实验结果,采用L9(34)正交实验设计对双孢菇菇柄多糖提取进行优化。正交实验因素与水平设计见表1。

表1 正交因素水平Table 1 Factor levels of orthogonal test
2 结果与分析
2.1 单因素实验
2.1.1 浸提温度对多糖得率的影响 在液固比15∶1的条件下,控制浸提温度为 50、60、70、80、90℃的恒温水浴中提取60min,提取一次,测定结果如图2。随着浸提温度的升高,多糖得率也增加,故选90℃较好。有研究报道,温度升高可增加多糖的扩散系数和溶解性,有利于多糖从材料介质中进入提取溶剂内,从而可提高多糖的得率[15-16]。

图2 浸提温度对双孢菇菇柄多糖得率的影响Fig.2 Effect of extraction temperature on the yield of polysaccharides from Agaricus bisporus waste stipe
2.1.2 液固比对多糖得率的影响 按液固比5∶1、10∶1、15∶1、20 ∶1、25 ∶1,在 90℃ 恒温水浴中浸提60min,提取一次,测定结果如图3。由图可知:随着液固比的增加,多糖得率也逐渐增加,但在液固比达到15∶1时再增加水溶液的比例,其多糖得率的增加不明显,液固比为 25∶1时仅比 15∶1时增加了0.14%,考虑后续工作和节约溶剂用量等综合因素,故选择液固比15∶1为宜。张民等[17]报道水体积的增加有利于多糖物质的运输,从而可以提高多糖的提取率,但超过一定比例后影响并不显著。

图3 液固比对双孢菇菇柄多糖得率的影响Fig.3 Effect of ratio of liquid to solid on the yield of polysaccharides from Agaricus bisporus waste stipe
2.1.3 浸提时间对多糖得率的影响 在液固比15∶1,浸提温度为90℃的恒温水浴中分别浸提30、60、90、120、150、180min,提取一次,测定结果如图 4 所示。由图4可以看出,在浸提时间为30~60min时,多糖得率由3.50%增加到4.00%,继续延长浸提时间,多糖得率不再增加反而下降,故选较优浸提时间为60min。
2.1.4 提取次数对多糖得率的影响 在液固比15∶1,浸提时间60min,浸提温度为90℃的恒温水浴中分别浸提1、2、3次,测定结果如表2。由表2可知,随着提取次数的增加,多糖得率逐渐增加,但提取3次与提取2次结果相差不多,综合考虑产率、能耗等因素,选择提取2次为好。

图4 提取时间对双孢菇菇柄多糖得率的影响Fig.4 Effect of extraction time on the yield of polysaccharides from Agaricus bisporus waste stipe

表2 提取次数对双孢菇菇柄多糖得率的影响Table 2 Effect of extraction times on the yield of polysaccharides from Agaricus bisporus waste stipe
2.1.5 乙醇用量对多糖得率的影响 按液固比15∶1,在90℃恒温水浴中浸提60min的条件下,分别加入1、2、3、4倍量的无水乙醇,置冰箱醇析 1h。测定结果如图5,在实验范围内,随乙醇用量的增加多糖得率随之增加,乙醇用量达2倍体积后多糖得率增加不显著,故选2倍乙醇用量沉淀多糖较合适。

图5 乙醇用量对双孢菇菇柄多糖得率的影响Fig.5 Effect of volume of ethanol to extract for precipitation on the yield of polysaccharides from Agaricus bisporus waste stipe
2.1.6 醇沉时间对多糖得率的影响 按液固比15∶1,在90℃恒温水浴中浸提60min的条件下,加入2倍量的无水乙醇,分别置冰箱醇析 0.5、1、2、3、4h。测定结果如图6。由图可明显看出,醇析2h时多糖得率最高,而在醇沉时间为3h和4h时,多糖得率与醇析2h无显著差异,故选2h醇析为好。
2.2 正交实验结果
以多糖提取得率为指标,对双孢菇菇柄多糖的提取条件进行优化。正交实验结果及方差分析见表3、表4。
从表3中的极差R可看出,对多糖得率的影响依次为D>B>A>C,即影响多糖提取的最主要因素是提取次数,其它依次为浸提时间,浸提温度,液固比。由表4可见,提取次数的F值达到显著水平(p<0.05),即提取次数对多糖得率的影响显著。由表3中的k值可以看出,用热水浸提多糖的最佳工艺组合为 A2B3C2D3,即浸提温度 85℃、浸提时间90min、液固比15∶1、提取3次,经测定多糖提取得率为5.50%。
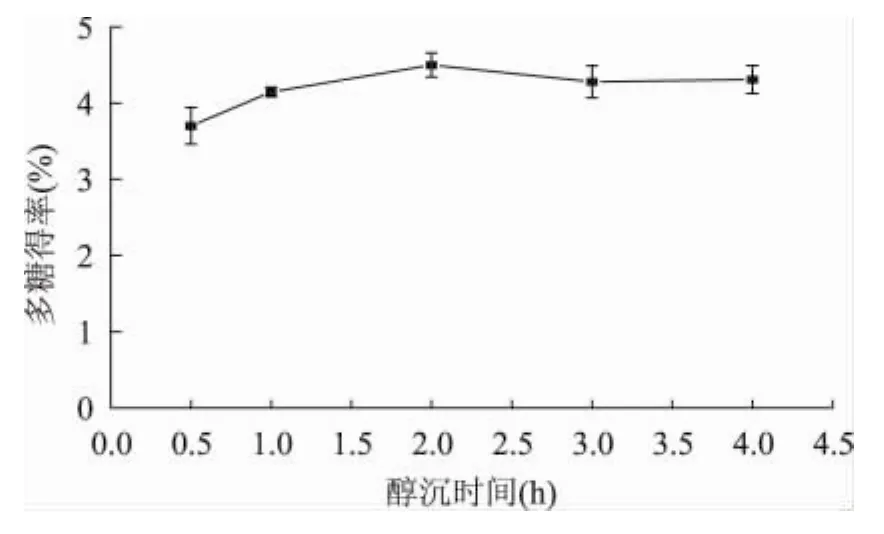
图6 醇沉时间对双孢菇菇柄多糖得率的影响Fig.6 Effect of ethanol precipitation time on the yield of polysaccharides from Agaricus bisporus waste stipe
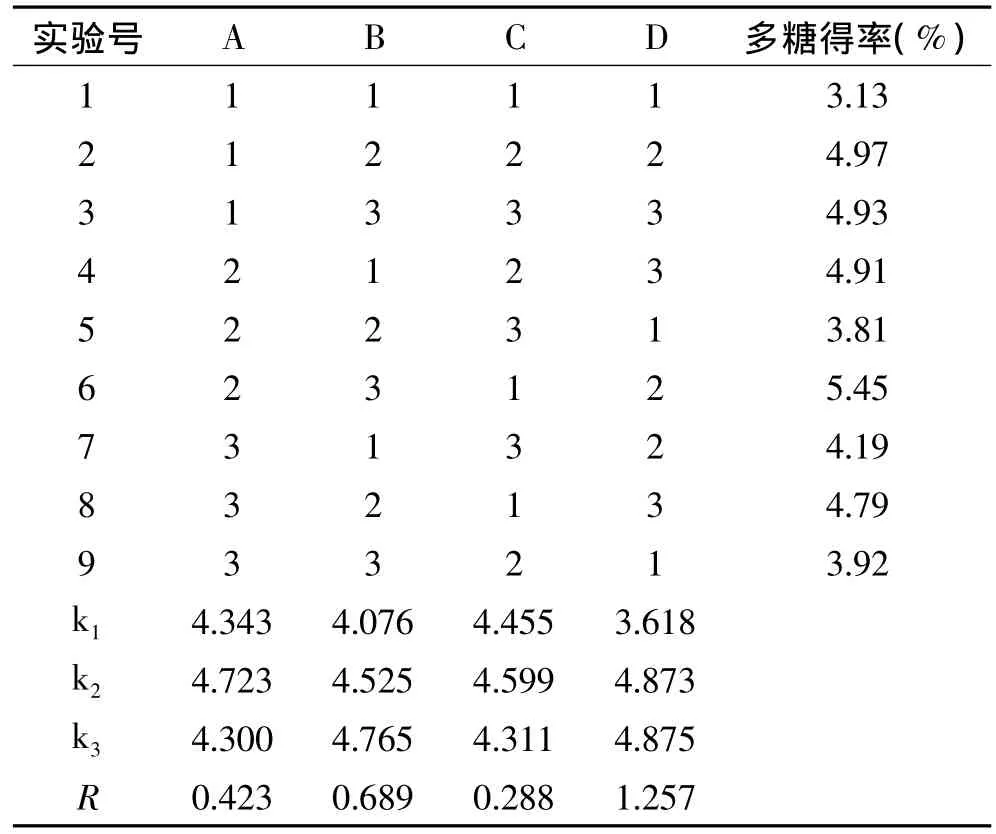
表3 正交实验设计及结果Table 3 Design and results of orthogonal test

表4 方差分析结果Table 4 Results of variance of analysis
3 结论
通过单因素实验和正交实验表明,在热水浸提双孢菇废弃物菇柄多糖的过程中,影响多糖得率的主要因素依次为提取次数、浸提时间、浸提温度、液固比。通过正交实验分析优化,在乙醇用量为2倍体积,醇析时间为2h时,最佳提取工艺参数为浸提温度85℃、浸提时间90min、液固比为15∶1、提取次数为3次,此时多糖得率可达5.50%。
[1]尹艳,高文宏,于淑娟.多糖提取技术的研究进展[J].食品工业科技,2007,28(2):248-250.
[2]Matsumura Y,Egami M,Satake C,et al.Inhibitory effects of peptide-bound polysaccharides on lipid oxidation in emulsions[J].Food Chemistry,2003,83(1):107-119.
[3]Akihiro N,Hitoshi F,Masayoshi K,et al.Effect of soybean soluble polysaccharides on the stability of milk protein under acidic conditions[J].Food Hydrocolloids,2003,17(3):333-343.
[4]Akihiro N,Taro T,Ryuji Y,et al.Emulsifying properties of soybean soluble polysaccharide[J].Food Hydrocolloids,2004,18(5):795-803.
[5]徐朝晖,姜世明,付培武.双孢蘑菇子实体多糖的提取及其对癌细胞的抑制[J].中国食用菌,1997,6(4):5-7.
[6]孙娅,李志强,王毓宁,等.采后钙处理对双孢菇贮藏生理的影响[J].食品工业科技,2013,34(2):322-326.
[7]王春丽,张琳,祖元刚,等.双孢菇水提物抗疲劳作用研究[J].食品工业科技,2011,32(5):379-380,417.
[8]吴疆,班立桐.应用双水相萃取技术提取双孢蘑菇多糖的研究[J].食品研究与开发,2011,32(7):4-7.
[9]熊泽,邵伟,黄艺.双孢磨菇多糖提取工艺优化研究[J].三峡大学学报:自然科学版,2007,29(4):367-370.
[10]王钦德,杨坚.食品实验设计与统计分析[M].北京:中国农业大学出版社,2003:331-367.
[11]吴疆,班立桐.应用双水相萃取技术提取双孢蘑菇多糖的研究[J].食品研究与开发,2011,32(7):4-7.
[12]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999.
[13]Dubios M,Gilles K A,Hamilton J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[14]李顺峰,刘兴华,张丽华,等.真姬菇子实体多糖的提取工艺优化[J].农业工程学报,2008,24(2):281-284.
[15]CaiW,Gu X,Tang J.Extraction,purification,and characterization of the polysaccharides from Opuntia milpa alta[J].Carbohydrate Polymers,2008,71(3):403-410.
[16]杨咏洁,梁成云,崔福顺.荠菜多糖的超声波提取工艺及其抑菌活性的研究[J].食品工业科技,2010,31(4):146-149.
[17]张民,秦培军,陈倩娟.大蒜多糖提取分离工艺及分子量分布[J].食品与发酵工业,2009,35(7):160-163.
