超声波辅助提取黄秋葵多酚和多糖的工艺研究
2013-05-15刘怡彤段振华马华林李婧怡
刘怡彤,段振华,2,* ,马华林,李 霜,张 雄,李婧怡
(1.海南大学食品学院,海南海口570228;2.海南大学热带生物资源教育部重点实验室,海南海口570228)
黄秋葵(Abelmoschus esculentus(L.)Moench),为锦葵科秋葵属一年生草本植物,别名秋葵夹、羊角豆等,原产于非洲,现在全国各地均有栽培[1]。黄秋葵含有丰富的蛋白质、游离氨基酸、矿物质、多糖、黄酮和多酚类化合物等多种生物活性成分[2-4]。丰富的生物活性物质使得黄秋葵具有抗疲劳[5]、提高机体免疫力、减少肺损伤和抗癌等作用[6-7],临床上已经应用于治疗皮肤癌[8]、烫烧伤等疾病的治疗。有研究表明[9]黄秋葵多糖具有体外结合胆酸的能力。多酚具有较强的清除自由基、抗氧化活性、抗肿瘤、抗辐射以及保护心血管系统等重要的生物活性功能[10],但关于黄秋葵多酚的研究却鲜有报道。因此开发研究黄秋葵多糖和多酚,对于黄秋葵资源的充分利用具有积极意义。超声波辅助提取技术利用机械及热力学特征产生极大的冲击力与剪切力,产生空化作用,使细胞破碎,通过提高破碎速度来提高提取效率[11]。利用超声波技术辅助提取植物中活性物质具有减少溶剂用量,减少提取时间,降低提取温度等优点[12-14]。本实验以新鲜黄秋葵为原料,采用超声波辅助提取技术,对黄秋葵水提液中多酚和多糖进行研究,通过单因素和正交实验确定黄秋葵中多酚和多糖水提取的最佳工艺条件,以期为黄秋葵的产品研发和有效开发利用提供科学依据。
1 材料与方法
1.1 材料与仪器
黄秋葵新鲜嫩果 海口市南国超市;没食子酸分析标准品(纯度>99%) 阿拉丁试剂公司;福林酚(FC)、碳酸钠、无水葡萄糖、苯酚、浓硫酸 均为国产分析纯。
KS-300E超声波清洗机 宁波科生仪器厂;101-2型电热鼓风恒温干燥箱 常州市华普达教学仪器有限公司;7200可见分光光度计 尤尼柯(上海)仪器有限公司;IKA A11 basic分析用研磨机 德国仪科;HH-S26S电热恒温水浴锅 金坛市大地自动化仪器厂;BS124S电子天平 Sartorius公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;TDZ5-WS多管架自动平衡离心机 湖南湘仪实验室仪器开发有限公司。
1.2 实验方法
1.2.1 提取工艺流程 新鲜黄秋葵→蒸馏水清洗→去蒂→打浆→加入一定量蒸馏水→搅拌均匀→超声处理→抽滤→滤液离心→提取液
1.2.2 多酚的测定 标准曲线的测定:采用福林-酚法[15]。精密称取20mg没食子酸标准品,蒸馏水溶解并定容至 200mL,分别吸取 0.0、0.1、0.2、0.3、0.4、0.5mL标准品溶液,各补水至0.5mL。然后加入10%FC试剂2.5mL,充分摇匀。反应5min后加入7.5%Na2CO3溶液5mL,50℃水浴锅中反应5min。室温避光保存1h。于波长760nm处测定吸光度。标准曲线回归方程结果为:Y=5.3986X+0.0202,R2=0.9954,其中Y:吸光度;X:没食子酸质量浓度(mg/mL)。
样品测定:吸取提取液0.5mL,按上述步骤操作测定吸光度,以标准曲线回归方程和料液比计算黄秋葵多酚得率。
1.2.3 多酚含量的计算 根据公式计算多酚得率:多酚含量(mg/g)=黄秋葵多酚质量(mg)/黄秋葵质量(g)。
1.2.4 多糖的测定 标准曲线的测定:采用苯酚-硫酸法[16]。精密称取100mg干燥至恒重的葡萄糖,蒸馏水溶解并定容至1000mL,分别吸取0.0、0.2、0.4、0.6、0.8、1.0mL葡萄糖溶液,各补水至1.0mL。然后加入6%苯酚溶液1mL,充分摇匀后加入浓硫酸5mL,迅速摇匀后室温放置30min,于波长490nm处测定吸光度。标准曲线回归方程结果为:Y=9.5871X+0.0065,R2=0.9983,其中 Y:吸光度;X:葡萄糖质量浓度(mg/mL)。
样品测定:量取一定量提取液,加入三倍量95%乙醇,于4℃冰箱过夜保存。抽滤取沉淀后复溶于水。取1mL复溶液,按上述步骤操作测定吸光度,以标准曲线回归方程和料液比计算黄秋葵多糖得率。
1.2.5 多糖含量的计算 多糖含量(mg/g)=黄秋葵多糖质量(mg)/黄秋葵质量(g)
1.2.6 单因素实验 选定超声时间、料液比、超声温度和超声功率四个因素作单因素实验,在其他因素不变的情况下,考察各个单因素对黄秋葵多酚和多糖得率的影响。
1.2.7 正交实验 根据单因素实验结果,以超声时间、料液比、超声温度和超声功率为考察因素,设计4因素3水平的正交实验,对超声提取黄秋葵水溶液多酚和多糖的工艺进行优化。因素水平设计见表1。
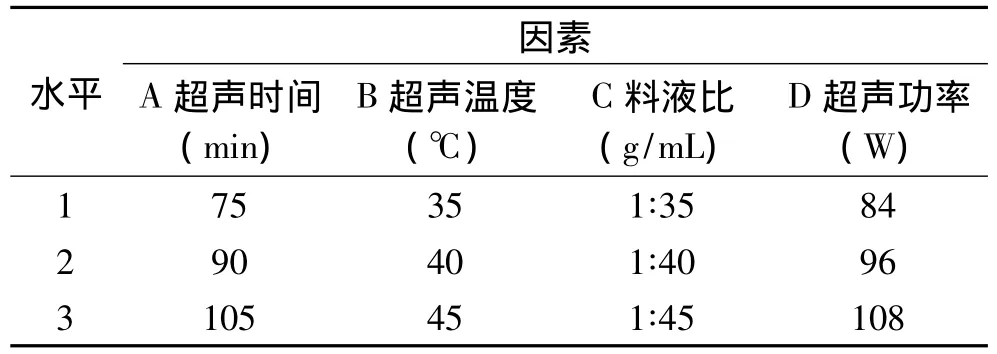
表1 工艺优化L9(34)正交实验因素水平表Table 1 Factors and their levels in L9(34)orthogonal array design
2 结果与分析
2.1 超声时间对黄秋葵多酚和多糖含量的影响
固定料液比为1∶40,超声温度为50℃,超声功率为120W,改变超声时间为 30、60、90、120、150min。考察超声时间对黄秋葵多酚和多糖含量的影响。结果如图1所示。

图1 超声时间对含量的影响Fig.1 Effect of ultrasound treatment time on yield
由图1可以看出,随着超声时间的增加,多酚和多糖的含量先明显增大,当时间增加至90min时,随着时间的继续增加,得率又出现减小的趋势。这可能是因为长时间的超声处理破坏了产物结构,加剧了多酚物质的氧化,导致多酚含量下降;同时使得大分子多糖的糖苷键断裂,从而导致多糖含量下降[17]。
2.2 料液比对黄秋葵多酚和多糖含量的影响
固定超声时间为90min,超声温度为50℃,超声功率为 120W,改变料液比为 1∶10、1∶20、1∶30、1∶40、1∶50。考察料液比对黄秋葵多酚和多糖含量的影响。结果如图2所示。
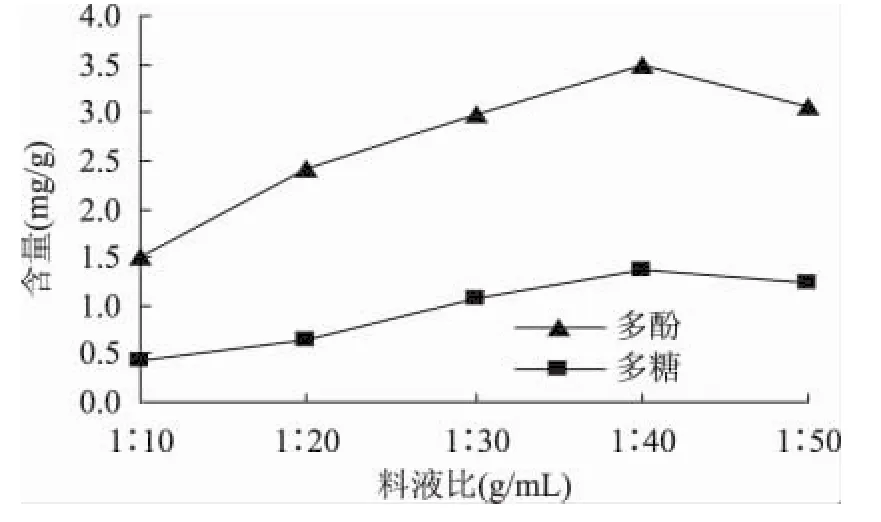
图2 料液比对含量的影响Fig.2 Effect of material/liquid ratio on yield
由图2可以看出,随着料液比的增大,多酚含量呈现明显增加趋势,在1∶40料液比时出现最大值,随后减小。多糖增加趋势较为平缓,也在1∶40出现最大值。这可能是因为随着料液比的增大,细胞壁内外的物质浓度差增大,增大了扩散速度,从而促进物质溶出。而当料液比增加到一定程度之后,水分子分散了超声波对有效成分的作用,导致细胞破碎不完全,从而降低得率[18]。
2.3 超声温度对黄秋葵多酚和多糖含量的影响
固定超声时间 90min,料液比1∶40,超声功率120W,改变超声温度为 30、40、50、60、70℃。考察超声温度对黄秋葵多酚和多糖含量的影响。结果如图3所示。
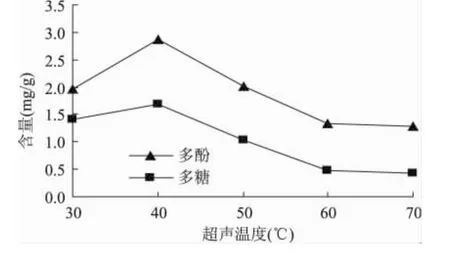
图3 超声温度对含量的影响Fig.3 Effect of ultrasound temperature on yield
由图3可以看出,在30~40℃时,多酚和多糖含量都有所增加,40℃之后,随着温度增加,两者得率均持续减小,在60℃之后变化平缓。因为黄秋葵酚类化合物在较高的温度下容易发生氧化,所以温度的升高会导致多酚含量下降;提取温度过高也会引起水溶性多糖分子结构的破坏[19]。随后含量变化平缓,这可能是因为大部分多酚与多糖已被高温破坏,只有少量结构稳定的酚类与多糖未被破坏,溶解于提取液中。因此提取温度选在40℃。
2.4 超声功率对黄秋葵多酚和多糖含量的影响
固定超声时间为90min,料液比为1∶40,超声温度为 40℃,改变超声功率为 48、72、96、120、144W。考察超声功率对黄秋葵多酚和多糖得率的影响。结果如图4所示。

图4 超声功率对含量的影响Fig.4 Effect of ultrasound power on yield
由图4可以看出,在超声功率低于96W时,随功率增大多酚含量明显增大,当超声功率超过96W时,随功率增大多酚含量逐渐减小。多糖在72W时出现最大值,72W与96W含量略有减小,但相差不大,因此考虑到多酚在96W出现最大值,超声功率选在96W。多酚与多糖含量均先增大后减小可能是因为随着功率增大,超声波空化作用更剧烈,分子扩散就越剧烈。而当超声波功率达到一定值时会对多酚和多糖产生破坏作用,引起多酚和多糖物质的分解[14,20]。
2.5 正交实验结果与分析
根据表1正交实验设计表进行四因素三水平正交实验,实验结果见表2。
由表2可以看出,影响黄秋葵多酚含量的因素次序为A>C>B>D,最优组合为A2B3C3D2,影响黄秋葵多糖得率的因素次序为C>A>D>B,最优组合为A2B3C3D1。黄秋葵多酚与多糖的最优组合仅仅在D功率因素上存在差异。考虑到在多酚和多糖两种物质中,目前对黄秋葵的研究主要集中在黄秋葵多糖,有大量研究表明黄秋葵多糖具有很多功能活性[9,21-23],故选择多糖的最优组合 A2B3C3D1为最佳工艺条件即超声时间90min,超声温度45℃,料液比1∶45,超声功率84W。
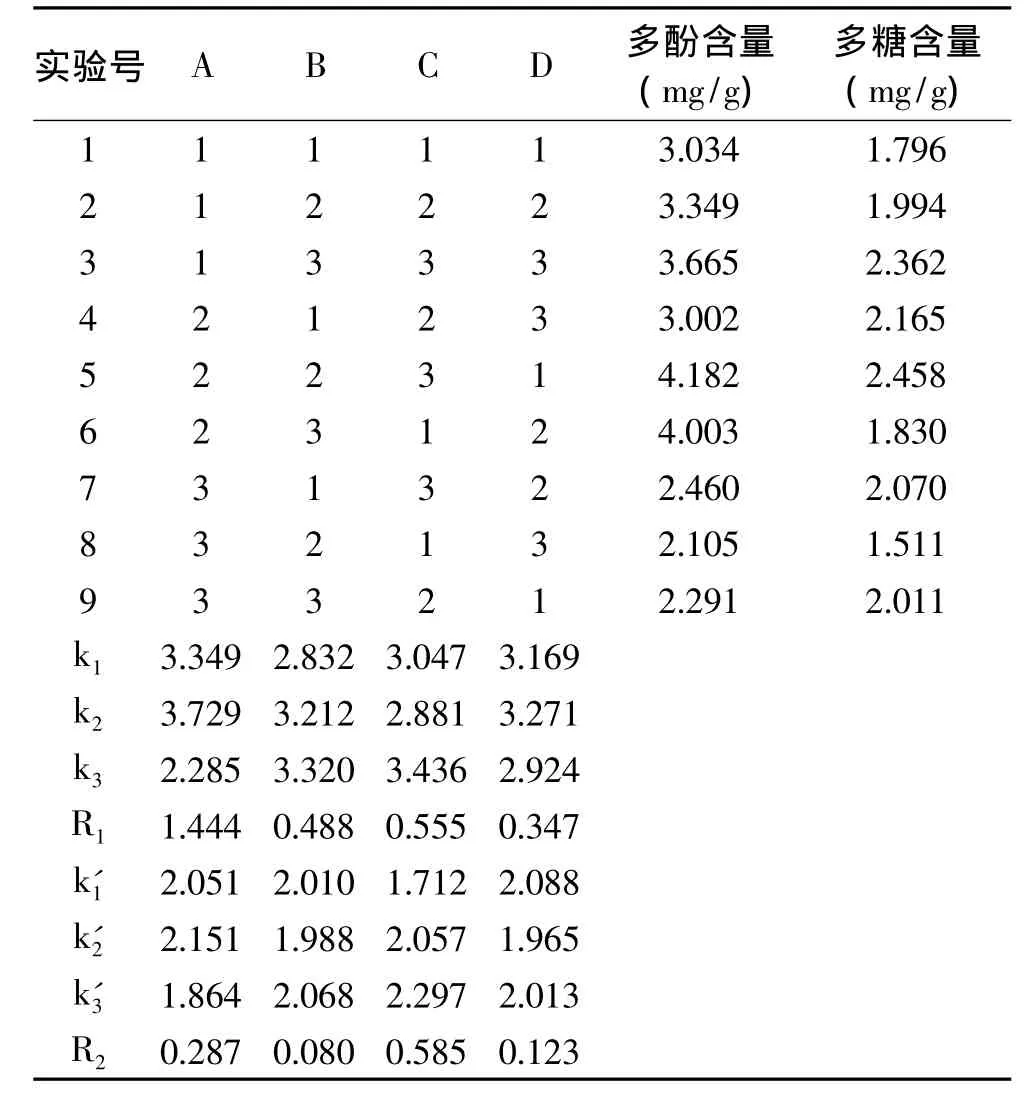
表2 正交实验结果Table 2 Results of orthogonal test
选取超声时间90min,超声温度45℃,料液比1∶45,超声功率84W进行三次平行实验,实验结果平均值为:多酚含量为 4.207mg/g,多糖含量为2.671mg/g。均高于正交实验结果,说明该工艺条件稳定可行。
3 结论
超声波辅助水提取黄秋葵多酚和多糖的最佳工艺条件为超声时间90min,超声温度45℃,料液比1∶45,超声功率84W,其中超声时间是影响多酚和多糖得率的最主要因素。在该条件下水提取黄秋葵多酚和多糖的含量分别为4.207、2.671mg/g。
[1]钟惠宏,郑向红,李振山.秋葵属的种及其资源的搜集研究和利用[J].中国蔬菜,1996(2):49-51.
[2]Savello P A,Martins F,Hull W.Nutrition composition of okra seed meals[J].Journal of Agricultural and Food Chemistry,1980,28(6):1163-1166.
[3]Shui Guanghou,Peng Leonglai.An improved method for the analysis of major antioxidants of Hibiscus esculentus Linn[J].Journal of Chromatography A1,2004,1048(1):17-24.
[4]陈思远,赵文若,李银范,等.三个黄秋葵品种开花结果生物学性状的调查[J].吉林蔬菜,2005(4):40-42.
[5]李建华,陈珊.黄秋葵水提液抗疲劳的药效学观察[J].中国运动医药学杂志,2004,23(2):196-197.
[6]吴春燕,谢金鲜.黄秋葵的研究进展[J].中医药学刊,2005,23(10):113-114.
[7]吕美云,郭孟萍.食用秋6种微量元素测定及药用价值初探[J].微量元素与健康研究,2000,17(1):46-47.
[8]金忠浇,林建龙.治疗皮肤癌的苗头中草药--秋葵[J].中华实用中西医杂志,2001,29(10):2256.
[9]任丹丹,陈谷.黄秋葵多糖的提取、分离及其体外结合胆酸盐能力的分析[J].食品科学,2010,31(13):110-113.
[10]郭新竹,宁正祥.天然酚类化合物及其保健作用[J].食品工业,2002(3):28-29.
[11]成长玉,段振华,樊洁,等.响应面法优化罗非鱼下脚料硫酸软骨素提取工艺的研究[J].食品科技,2011,36(3):213-217.
[12]田应娟,朱良,陈建,等.超声强化提取橄榄黄酮类物质及其抗氧化活性研究[J].食品研究与开发,2011,32(1):17-22.
[13]李鹏婧,柳旭光,龙海荣,等.超声波辅助提取菱角壳总黄酮及抗氧化性研究[J].食品科技,2011,36(1):167-171.
[14]Duan Zhenhua,Li Yanlan,Wang Julan.Study on the technology of extraction protein of fish swim bladder with ultrasonic treatment[J].Advanced Materials Research,2012,396-398:1413-1416.
[15]徐辉艳,孙晓东,张佩君,等.红枣汁中总酚含量的福林法测定[J].食品研究与开发,2009,30(3):126-128.
[16]高丽君,王汉忠,崔建华,等.白首乌可溶性多糖提取工艺研究[J].食品科学,2004,25(10):178-180.
[17]徐建国,田呈瑞,胡庆平,等.响应面法优化槐花水溶性多糖的超声波辅助提取工艺[J].食品科学,2011,32(4):112-116.
[18]吕明生,王淑军,房耀维,等.超声波提取雪莲薯多糖工艺优化及其对羟自由基的清除[J].食品科学,2011,32(2):24-27.
[19]王晓阳,唐琳,赵垒.响应面法优化刺槐花多酚的超声提取工艺[J].食品科学,2011,32(2):66-70.
[20]蒋丽,王雪梅,王学军,等.不同提取方法对茶多酚理化性质的影响[J].食品科学,2012,31(14):136-139.
[21]黄阿根,陈学好,高云中,等.黄秋葵的成分测定与分析[J].食品科学,2007,28(10):451-455.
[22]赵焕焕,贾陆,裴迎新.黄秋葵粗多糖体外抗氧化活性测定[J].郑州大学学报,2012,47(1):40-43.
[23]任丹丹,陈谷.黄秋葵多糖组分对人体肿瘤细胞增殖的抑制作用[J].食品科学,2010,31(21):353-356.
