新疆蒙古族和哈萨克族传统乳制品中乳酸菌多样性的比较
2013-05-15董晓婉李宝坤李开雄卢世玲郭素娟彭小丽
董晓婉,李宝坤,李开雄,卢世玲,郭素娟,彭小丽
(石河子大学食品学院,新疆石河子832003)
新疆是个多民族居住的地区,在这里的少数民族一直都有食用自制发酵乳制品的习惯。这种传统发酵乳制品风味独特,营养价值高,具有较好的益生作用[1],同时富含了当地自然环境中丰富的微生物资源,乳酸菌是其中微生物的重要组成部分。它具有维持肠道菌群的生态平衡,降低血清胆固醇、抗氧化、防癌和抗癌等作用[2-4]。有研究发现[5],从传统奶制品中分离到的乳酸菌具有强烈的抑菌特性,可以在发酵过程中抑制其他有害于奶制品生产和风味的细菌的生长。新疆的地理位置非常独特,北有阿尔泰山,中有天山,南有昆仑山,其间夹有两个大盆地-准噶尔盆地和塔里木盆地。其气候属温带大陆性干旱气候,它的年温差、日温差极大,降水和气温的地区差异和垂直差异也非常显著[6]。这种独特的地理和气候条件对传统乳制品中微生物菌群结构和种类也产生了一定的影响。目前,国内外学者对传统乳制品中乳酸菌的研究虽然比较全面,但是其大多采用传统分离鉴定方法或现代分子生物学方法,而将两种方法相结合对其进行研究的还不是很多,本文通过革兰氏染色、过氧化氢酶实验等传统分离方法对新疆准噶尔盆地西北部和布克赛尔县的17份哈萨克族酸奶样品及8份蒙古族酸奶样品中的乳酸菌进行了分离鉴定,同时选取代表菌株进行16S rDNA基因序列分析,并将两种方法的结果相结合,确定菌株类型及不同样品中菌株的差异,对菌株进行较为全面、准确的鉴定,为新疆传统乳制品中乳酸菌的多样性及不同民族传统酸奶中乳酸菌的差异性研究提供理论依据。
1 材料与方法
1.1 材料与仪器
25份酸奶样品 采集自新疆和布克赛尔县传统工艺制造酸奶的牧民家庭,其中哈萨克族为17份,蒙古族为8份。采集的酸奶装于灭菌的离心管内,封严后放入车载冰箱于4℃运至实验室,即进行后续实验;Lb.plantarum(植物乳杆菌)、Lactococcus lactis(乳酸乳球菌) 均为实验室保存菌种。
电热恒温培养箱(DNP-9272) 上海精宏实验设备公司;高速冷冻离心机(5417R)Eppendorf公司;PCR扩增仪(TC-512)Techne公司;荧光电子显微镜(DM3000) Lecia公司;电热蒸汽灭菌器(LD2X-40II) 上海申安医疗器械厂。
MRS培养,硝酸盐还原实验培养基、明胶液化实验、H2S实验、葡萄糖产气实验等培养基参照东秀株等编著的《常见细菌系统鉴定手册》和凌代文编著的《乳酸细菌分类鉴定及实验方法》中所介绍的方法配制。
1.2 乳酸菌的分离纯化
将酸奶样品用0.9%灭菌生理盐水做10倍递增稀释,取 10-2、10-3、10-4三个稀释度,分别吸取200μL于MRS平板培养上涂布,置于培养箱中37℃培养36~48h。根据菌落的颜色、大小、光泽、透明程度等,挑取单菌落,分别在MRS固体培养基上反复划线分离,直至菌落较纯。进行革兰氏染色,镜检观察菌体大小、形状、排列方式,同时进行过氧化氢酶实验,将革兰氏染色阳性、过氧化氢酶阴性的菌株初步认定为乳酸菌[7]。将纯菌进行斜面保藏用于近期实验。同时用40%甘油保菌,置于-20℃冰箱中保存备用。
1.3 属种的鉴定实验
将初步确定为乳酸菌的菌株按照图1的鉴定程序区分不同的乳酸菌菌属,再通过分离菌株对碳水化合物的发酵产酸实验,即利用细菌微量生化反应管,将活化好的菌液离心后,用生理盐水重新悬浮,注入管内,再放入灭菌大试管中,37℃培养一周后观察结果。通过对单糖、二糖、三糖、多糖以及糖苷和糖醇类等碳水化合物的利用情况来对种进行鉴定[8-9]。
1.4 16S rDNA基因序列分析
1.4.1 DNA的提取 应用GenElute TM细菌总DNA提取试剂盒提取样品中所分离出的乳酸菌菌株的总DNA,按说明书操作。
1.4.2 16S rDNA基因序列的测定 应用细菌16S rDNA基因通用引物对细菌16S rDNA的V6~V8区段进行PCR扩增。上游引物为U968(5′-AAC GCG AAG AAC CTT AC-3′);下游引物为 L1401(5′-CGG TGT GTA CAA GAC CC-3′)[10]。PCR 反应体系为25μL,引物各 1μL,1μL 的 DNA 稀释液,预混液12.5μL,补充9.5μL ddH2O 至终体积为25μL。
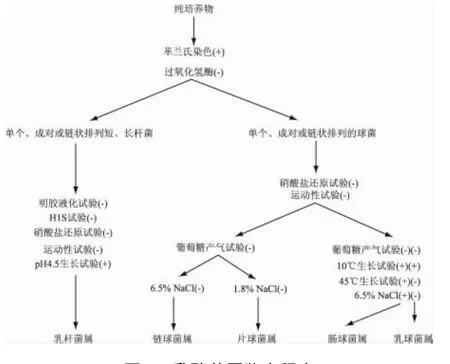
图1 乳酸菌属鉴定程序Fig.1 Identification procedure of Lactobacillus
PCR扩增程序:94℃预变性4min,20个循环(94℃变性30s,退火温度从65℃到55℃,退火30s,72℃延伸30s),再于恒定的退火温度下进行10个循环(94℃变性30s,55℃退火30s,72℃延伸30s),最终72℃延伸10min。
1.4.3 同源性分析 采用MEGA5.0中的邻接法(Neighbour-joining)将测序所得序列及NCBI中获得的参比菌株的16S rDNA基因序列进行系统发育树的构建,自展值(bootstrap)为1000。
2 结果与分析
2.1 分离菌株形态及细胞形态
通过传统培养分离及图1的乳酸菌鉴定表,25份酸奶样品共分离出42株革兰氏染色阳性、过氧化氢酶阴性的杆菌和球菌。分离的菌株菌落多为在培养基表面生长的表面光滑、边缘整齐、中央有凸起或扁平的白色或半透明状菌落,或者边缘不整齐、表面粗糙无光泽和中央有凸起或扁平的乳黄色菌落。分离的杆菌细胞形态为长杆状或短杆状,多数呈链状排列。球菌呈圆形或卵圆形,一般以单个、成对或链状排列(如图2)。

图2 分离菌株的革兰氏染色荧光显微镜图片Fig.2 The images of fluorescence microscope from isolates of gram staining
2.2 乳酸杆菌属、种的鉴定结果
实验以Lb.plantarum(植物乳杆菌)作为对照菌株。把所分离到的14株无芽孢革兰氏染色阳性、接触酶和H2S实验均为阴性、不还原硝酸盐、不液化明胶、不运动的杆菌,鉴定为乳杆菌属(表1)。
14株乳杆菌中有3株不发酵苦杏仁苷、七叶灵、甘露醇、松三糖、鼠李糖、水杨苷和山梨醇与Lb.fermentum(发酵乳杆菌)性质相近,故鉴定为Lb.fermentum(发酵乳杆菌)。
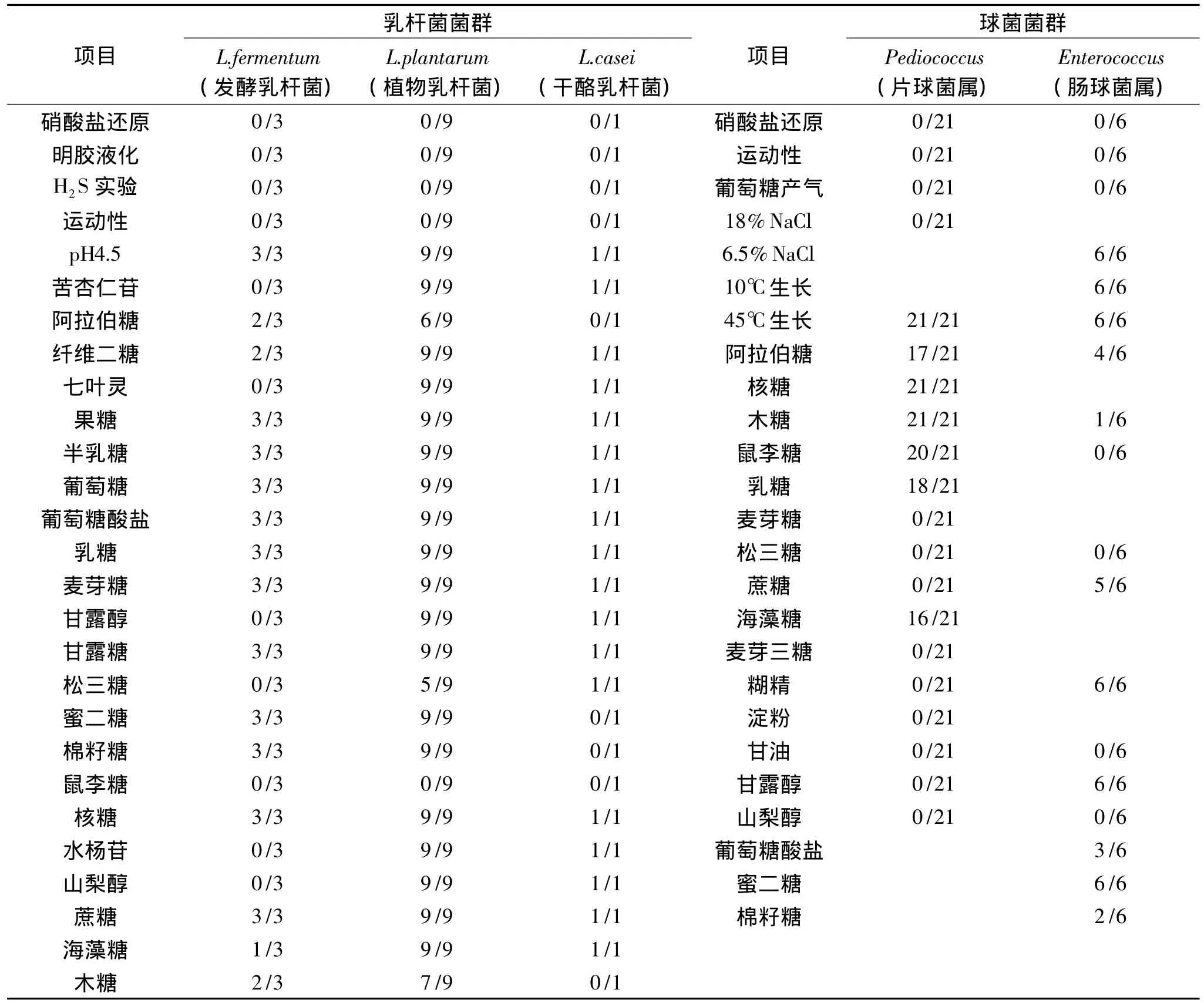
表1 分离自新疆酸奶中的乳酸菌的生理特性Table 1 Physiological characteristics of the lactic acid bacteria isolated from fermented dairy products collected in Xinjiang
9株乳杆菌不能利用鼠李糖,能够发酵苦杏仁苷、纤维二糖、七叶灵、果糖、半乳糖、葡萄糖等大多数糖类,鉴定为Lb.plantarum(植物乳杆菌)。
1株乳杆菌能利用松三糖、水杨苷产酸,不能从阿拉伯糖、木糖、蜜二糖、鼠李糖、棉子糖产酸,与Lactobacillus casei(干酪乳杆菌)的性质相近。
1株未知。
2.3 乳酸球菌属、种的鉴定结果
实验采用Lac.lactis(乳酸乳球菌)作为对照菌株,把分离出的28株无芽孢、革兰氏染色阳性、过氧化氢酶反应阴性的球菌,进行属的鉴定,得到片球菌21株,肠球菌6株,1株未知(表1)。
21株片球菌能够发酵核糖和木糖,不能利用麦芽三糖、松三糖、蔗糖等,且能生长在45℃的环境下,与P.acidilactici(乳酸片球菌)性质相似。
6株肠球菌均能从蜜二糖、甘露醇产酸,不从山梨醇、松三糖产酸,初步确定为Enterococcus faecium(屎肠球菌)。
2.4 序列分析和系统发育树的构建
从蒙古族和哈萨克族酸奶样品中各挑选了9株长势较好,菌落大小、颜色、形态不同的菌株作为代表菌株进行16S rDNA基因序列测定,构建了18乳酸菌和部分相关种模式株16S rDNA基因序列在内的系统发育树(图3),由系统发育树可知18株菌分属于4个属,它们分别是乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)肠球菌属(Enterococcus)、魏斯氏菌属(Weissella)。菌株 H5-1、H5-2、H1-1、H8-1、H2-1、H17-1、M2-2、M4-1、M8-2 隶属于乳杆菌属,其中菌株 H1-1、H8-1与 Lb.fermentium(发酵乳杆菌)系统发育关系最近,菌株 H5-1、H17-1、M2-2、M4-1和M8-2在系统发育上与Lb.plantarum(植物乳杆菌)处于同一分支,菌株 H2-1与Lb.crustorum(面包乳杆菌)的序列同源性为100%,菌株H5-2与Lb.paracasei(类干酪乳杆菌)的序列同源性最高。菌株 M1-1、M6-1、M8-1 和H1-2 与 P.acidilactici(乳酸片球菌)序列相似性最高。菌株M3-1属于魏斯氏属,与 W.cibaria处于同一个分支。M2-3、H13-1、M7-2、H9-2与E.durans(耐久肠球菌)系统发育关系最近。这18株与相关模式菌株的16S rDNA基因序列同源性均高达99%及以上,从而证明各代表菌株与模式菌株为同一种菌。
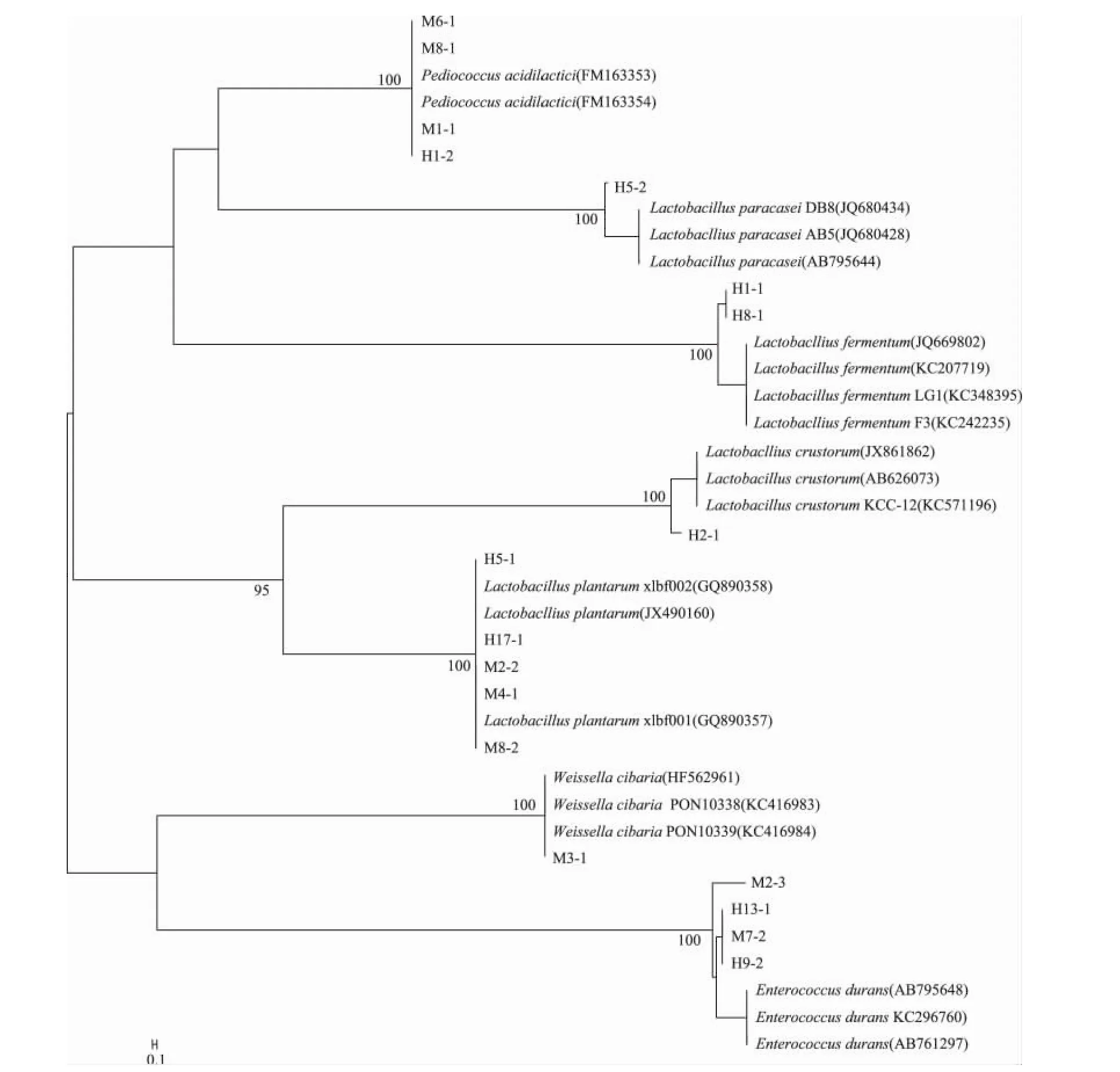
图3 分离乳酸菌菌株和相关菌株16S rDNA基因序列建立的系统发育树Fig.3 Phylogenetic tree establishment of separation Lactobacillus and relation strain 16S rDNA gene sequences
2.5 分离菌株的综合鉴定结果
通过实验结果可以看出,16S rDNA基因序列鉴定结果能够较好地与生理生化结果相吻合,经16S rDNA基因序列鉴定的18株代表菌株中已确定的4株P.acidilactici(乳酸片球菌)、5株 Lb.plantarum(植物乳杆菌)和2株Lb.fermentum(发酵乳杆菌)与生理生化结果相符。经生理生化鉴定得出的1株Lb.casei(干酪乳杆菌)和1株 E.faecium(屎肠球菌),通过16S rDNA基因序列鉴定结果分别为Lb.paracasei(类干酪乳杆菌)和E.durans(耐久肠球菌)且同源性在99%以上,故确定为Lb.paracasei(类干酪乳杆菌)和E.durans(耐久肠球菌)。通过生理生化鉴定未确定的2株菌株(1株球菌,1株杆菌),经过16S rDNA基因序列鉴定结果确定为1株W.cibaria(食窦魏斯氏菌),1株Lb.crustorum(面包乳杆菌)。
2.6 新疆同一地区不同民族自制酸奶中乳酸菌的分离情况
通过传统的生理生化实验以及16S rDNA基因序列鉴定结果可以得出从新疆和布克赛尔采集的25份酸奶样品共分离出42株乳酸菌。其中8份蒙古族样品共分离出12株乳酸菌,17份哈萨克样品中共分离出30株乳酸菌(如表2)。
蒙古族酸奶样品分离的乳酸菌有:P.acidilactici(乳酸片球菌)5株、E.durans(耐久肠球菌)3株、Lb.plantarum(植物乳杆菌)3株、W.cibaria(食窦魏斯氏菌)1株,其中P.acidilactici(乳酸片球菌)为优势菌(占总分离的41.7%),其次是 E.durans(耐久肠球菌)和Lb.plantarum(植物乳杆菌)(均占分离菌总数的25%)。
哈萨克酸奶样品分离的乳酸菌有:P.acidilactici(乳酸片球菌)16株、Lb.plantarum(植物乳杆菌)6株、E.durans(耐久肠球菌)3株、Lb.fermentum(发酵乳杆菌)3株、Lb.paracasei(类干酪乳杆菌)1株,Lb.crustorum(面包乳杆菌)1株,其中P.acidilactici(乳酸片球菌)为优势菌(占总分离的50%),其次是L.plantarum(植物乳杆菌)(占总分离的20%)。

表2 新疆和布克赛尔县不同民族传统乳制品中乳酸菌的分离情况Table 2 The separation of lactic acid bacteria in traditional dairy products from different minority in xinjiang
3 结论
从新疆和布克赛尔县采集的25份酸奶样品共分离出42株乳酸菌。其中8份蒙古族样品共分离出12株乳酸菌,17份哈萨克样品中共分离出30株乳酸菌。
如表2所示:新疆和布克赛尔县的蒙古族和哈萨克族传统酸奶分离出的乳酸菌构成比例相差不大,优势菌群均为P.acidilactici(乳酸片球菌),且都分离出了E.durans(耐久肠球菌)和Lb.plantarum(植物乳杆菌)。但是两种民族酸奶样品中的乳酸菌菌群还是有一定的差异性。蒙古族样品分离出的杆菌数量较少(仅占分离总数的25%),且种类单一(只有3株Lb.plantarum(植物乳杆菌)),哈萨克族样品中分离出的Lb.fermentum(发酵乳杆菌)、Lb.paracasei(类干酪乳杆菌)和Lb.crustorum(面包乳杆菌)在蒙古族酸奶样品中并未分离出来,哈萨克族酸奶样品中除了P.acidilactici(乳酸片球菌),其余分离出的菌种数量相差不大,除了W.cibaria(食窦魏斯氏菌)未被分离出外,蒙古族酸奶样品中分离的所有菌种,均在哈萨克族酸奶样品中分离出来。
赵蕊、霍贵成曾研究了新疆伊犁酸马奶中乳酸菌的多样性[11],发现 Lactobacillus helveticus(瑞士乳杆菌)为优势菌群,并且也分离出了Lb.plantarum(植物乳杆菌)、Lb.fermentum(发酵乳杆菌)和E.durans(耐久肠球菌);刘洁洁、李开雄等研究了新疆阿勒泰地区哈族传统乳制品的多样性[12],分离出了Lb.Helveticus(瑞士乳杆菌)、Lb.casei(干酪乳杆菌)、Lb.fermentum(发酵乳杆菌)和 E.durans(耐久肠球菌)。其中Lb.Helveticus(瑞士乳杆菌)为优势菌群。通过比较发现虽然优势菌群不同,但菌群多样性相似,Lb.plantarum(植物乳杆菌)、Lb.fermentum(发酵乳杆菌)和E.durans(耐久肠球菌)都曾被分离出来。
通过分析可以看出,同一地区不同民族酸奶样品中菌群种类和数量略有差异,产生差异性的原因可能是:虽然生活在同一地区,但蒙古族和哈萨克族牧民长期形成的不同生活习惯和饮食偏好习惯以及传统乳制品制造工艺不同造成的。也正是这种差异性丰富了我国乳酸菌菌质资源。
本实验对同一地区采集的不同民族酸奶样品中分离纯化的42株乳酸菌,进行了种属的鉴定,对其生理生化特征作了初步研究,为新疆同一地区不同民族传统乳制品中乳酸菌的多样性提供了理论依据。
[1]余焕玲,晏萍.乳酸菌的生理功能及在食品中的应用[J].饮料工业,2000,3(4):10-12.
[2]郭宇星,陈庆森.微生物发酵法制备乳源性ACE抑制肽的研究新进展[J].食品科技,2006(3):12-16.
[3]张书文,孟和毕力格,吕加平,等.乳酸菌清除自由基能力的研究概况[J].中国乳品工业,2008,36(4):44-47.
[4]Kazuhiro Hirayama Joseph Rafter.The role of lactic acid bacteria in colon cancer prevention mechanistic considerations[J].Antonie van Leeuwenhoek,1999,76:391-394.
[5]Randazzo C L,Akkermans A D.Diversity.dynamics and activity of bacterial communities during production of an Artisanal Sicilian cheese as evaluated by 16S rDNA analysis[M].Appl Environ Microbiol,2002.68:1882-1992.
[6]倪慧娟.新疆地区和青海地区传统发酵乳制品中酵母菌的生物多样性[D].呼和浩特:内蒙古农业大学,2009.
[7]Zhang J C,Liu W J,Sun Z H,et al.Diversity of lactic acid bacteria and yeasts in traditional sourdoughs collected from western region in Inner Mongolia of China[J].Food Control,2011,22(5):767-774.
[8]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[9]凌代文.乳酸菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:1-25.
[10]Pelt- Verkuil,Elizabeth van,Belkum,et al.Principles and TechnicalAspects ofPCR Amplification[M].Springer Netherlands,2008:63-90.
[11]赵蕊,霍贵成.新疆酸奶子中乳酸菌多样性分析[J].山东大学学报,2008,43(7):19-22.
[12]刘洁洁,李开雄,倪永清,等.哈族传统乳制品中乳酸菌多样性及抑菌性研究[J].食品工业,2012,33(4):109-111.
