微波消融术应用于原发性肝癌的研究进展
2013-01-10张本华
张 娴 张本华
(泰山医学院,山东 泰安 271016)
据2011年统计资料显示,在全球每年死于原发性肝癌的人数约695,900[1],其中,我国每年大约12~14万人死于肝癌。手术切除是治疗原发性肝癌的主要手段之一,但适合手术者不到30%[2]。自20世纪70年代,介入栓塞治疗成为非手术治疗原发性肝癌的主要手段,但是介入治疗后肿瘤完全坏死率仅在20%~50%[3],5年生存率不到30%[4]。近十年来,随着医学技术和生物医学的发展,原发性肝癌的治疗模式发生了深刻变革。以影像引导的局部消融术凸显出其优势和应用潜力,其中微波消融术研究最多、发展最快[5]。本文通过回顾分析近二十年来微波消融术治疗原发性肝癌的研究进展,做一综述如下。
1 微波消融术(microwave ablation, MWA)
1.1 概 述
MWA是借助医学影像技术的引导对肿瘤靶区进行定位,将微波输入局部使肿瘤组织发生凝固性坏死,达到原位灭活肿瘤的一种治疗手段。在临床中应用最多的是经皮微波凝固治疗(percutaneous microwave coagulation therapy,PMCT)。这是20世纪90年代发展起来的一项新技术,具有创伤小、安全性高等特点[6]。20年来,国内外学者在MWA的原理、设备更新、动物实验、临床应用方面做了大量研究,目前,已成为我国卫生部指定的第三类医疗技术之一。
1.2 作用机理
微波消融系统是由微波发生器、同轴电缆及微波天线三个基本部件组成。微波发生器内的磁控管产生微波并控制频率,同轴电缆连接天线和微波发生器,将微波传输至靶区[7]。当局部温度迅速升高达有效治疗温度54 ℃或60 ℃以上时细胞即刻发生凝固坏死[8-9]。目前,医用微波频率主要是915 MHz和2450 MHz[8]。因后者热效率高,为国内最常用[7]。
产生微波热效应有两种机制:一是水、蛋白质等极性分子为适应微波电场的变化,不断运动磨擦生热,局部高温环境直接导致细胞凝固坏死;另一机制是,带电离子在微波电场中不断振动碰撞,摩擦生热[10]。此外,局部高温除了引起肿瘤直接损伤外,还引起微血管破坏、缺血—再灌注损伤、诱导细胞凋亡、激活免疫细胞、改变细胞因子的表达、调节正向免疫应答,这些间接作用促进了肿瘤细胞的死亡[11]。
1.3 技术改进
1979年发明微波治疗仪,最初是在肝切除术中用来止血[12]。首次报道MWA治疗肝癌是在1994年,由日本学者Seki T开展,功率60 W,时间120 s,能形成(1.6±0.3)cm×(2.4±0.4)cm的“纺锤形”凝固体[6]。由于凝固范围有限,开始只适用于治疗直径<2 cm的肿瘤,也因受不良反应如术中疼痛、皮肤灼伤、凝固灶拖尾、杆温的限制而无法满足临床治疗需要。
1996年董宝玮等[13]研究人员探索找到了能产生类球形凝固灶的技术条件:改变电极芯线的材料、裸露长度和改进微波治疗仪,使电极的组织匹配性、抗粘性、耐高温性及机械强度指标大大改进,产生的凝固灶体积明显增大。这一微波系统在60 W 300 s 条件下作用于狗的肝脏,形成稳定的3.7 cm×2.0 cm×2.0 cm的凝固体;猪活体肝脏40 W 40 min条件下形成6.0 cm×4.0 cm×4.0 cm的凝固体[14]。1997年梁萍等[15]通过技术改进首次实现了US引导下对直径>3 cm肿瘤的原位灭活,再次推动了这一技术的临床应用。
此后,水冷天线的发明有效降低了杆温;天线内置温度传感器,可方便测量肿瘤边缘温度,提高治疗的安全性和准确度;同时双极、多极和环行电极的开发应用,明显增大了消融范围,凝固形态更接近圆球体;目前还加入了实时能量调控和温度监测系统[14],提高了天线的防粘性能,减少了组织气化和碳化;从总体上增大了凝固范围,使凝固灶更近似椭球体甚至球体。
2 实验研究
2.1 大体观察
肝脏行MWA后,即刻沿着针道切开被消融组织,从针道由内向外依次有明显的三个带[16]:焦化带(电极穿过形成的腔道),消融带(完全凝固坏死区),移行带(正常存活组织过渡到完全坏死的交界区,表现为水肿出血)。
2.2 光镜组织细胞学观察
H-E染色后,光镜下可见沿针道细胞间有明显的空化现象,固化的细胞轻度萎缩,胞浆中颗粒更细微,细胞核变深染。但是,由于MWA和甲醛具有同样的快速固定蛋白质的作用,仅经H-E染色,光镜下在细胞水平正常组织和消融组织没有明显的区别,而且大体观察到的四个带很难再区分,即大体标本上所看到的清晰的分界线不再明显[17]。NADH(nicotinamide adenine dinucleotide)黄递酶是一种线粒体酶,染色后可判断细胞活性,经NADH黄递酶染色呈黑染的表示细胞有活性,未被染色的表示细胞无活性[17-18]。该组织化学染色冰冻切片分析显示,由无活性区域的边缘过渡到有活性区域(即移行带)跨越的距离大约为1mm[17]。
2.3 透射电镜观察
MWA在亚细胞水平有明显的变化,如细胞器中断,细胞核扭曲,核膜表面不规则,核内容物、胞浆内容物聚集,Yamaguchi等人[17]还发现白色区域中红细胞被破坏,可作为指示靶区细胞破坏的标志。
2.4 消融范围数学模型的建立和分析
何年安等[19]对功率、时间与消融范围的关系进行过深入研究,认为两个变量均与消融灶横径有高度近似的线性相关。二元线性回归分析,其消融灶横径公式为SD=10.71+1.44T+ 0.19P(T为时间,P为功率,单位cm)。从公式看,时间的系数比功率的系数大,因此延长时间比增大功率对消融范围的贡献大。但时间饱和后,单纯延长时间,凝固灶横径不再增大,即消融灶横径的增加呈“时间饱和”的特点,即达到一定时间后,消融灶横径不再随时间延长而增大。随着功率的增加,饱和时间后移,30~40 W时饱和时间为14 min,50~55 W时为19 min。这个特点使消融范围出现了“瓶颈”现象,限制了单次消融范围的扩大[20]。
2.5 消融范围与功率和时间的关系
Ming Kuang等[21]应用2.45GHz微波治疗仪,14号微波天线消融离体、活体猪肝(大体观察见表1)数据显示,①随着时间或功率的增加,凝固区的长径和短径呈大体增加的趋势;②相同时间下,随着功率增加,长径增加的幅度大于短径;③相同条件时,活体组织消融范围明显小于离体组织;④相同时间功率下,双极消融范围大于单极。

表1 2450 MHz微波治疗仪-14号冷循环微波天线消融肝脏组织直径
Brace CL等[22]在利用活体猪肝探索三轴天线同时消融和单极天线消融的实验中,用2.45 GHz的微波治疗仪,17号单极天线,功率55 W,间隔2.5 cm的三轴天线、间隔3.0 cm的三轴天线各消融10 min,消融灶平均大小(cm)为:3.21×2.64,6.42×5.06,7.62×5.34。显然三轴天线是单极天线消融灶的三倍多,从侧面也反映出获得相同大小的消融灶,三轴天线比单极天线可节约67%的时间。
Ping Liang等[23]对活体猪肝行MWA(数据见表2)发现随着功率增加凝固范围呈增大趋势,但输出功率为50 W和60 W的消融灶长径无显著差异(P>0.05),输出功率为60 W,70 W和80 W的消融灶短径无显著差异(P>0.05)。原因可能与功率超过80 W时中心碳化明显增加,凝固范围扩大受限有关。Andrew等[24]研究发现,当功率定为75 W时,90%的凝固灶最大短径在8 min甚至更短时间内形成。
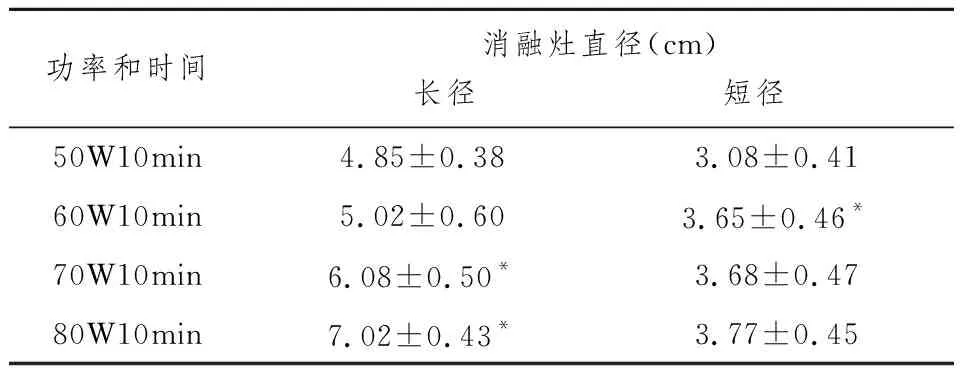
表2 915MHz微波治疗仪-1.9 mm冷循环微波天线消融活体猪肝直径
3 临床应用进展
3.1 适应证和禁忌证:
适应证[25]:单发肿瘤直径≤5 cm;或数量≤3最大径≤3 cm;无血管、胆管癌栓或肝外转移;肿瘤距肝门部肝管的距离≥5 mm;肝功能Child A或B级;无腹水或少量腹水。对于直径>5 cm的单发肿瘤,或最大直径>3 cm的多发肿瘤,只要严格掌握,局部消融可以作为姑息性治疗。
禁忌证[25]:巨大或弥漫型肝癌;合并门脉主干至二级分支或肝静脉癌栓、邻近器官侵犯或远处转移;肝功能Child C级;有食管胃底静脉曲张破裂出血倾向;有严重凝血功能障碍;顽固性腹水;恶液质;合并活动性感染;重要脏器功能衰竭;意识障碍或不能配合等情况。
3.2 基本操作过程:
术前制订初步的消融计划,借助US、CT或MRI设备的引导对肿瘤进行定位,选择最佳穿刺路径、穿刺点、穿刺角度和穿刺深度。严格遵守无菌操作规范。最常经皮穿刺,确定穿刺针尖到位,设置功率和时间(一般40~60 w,5~20 min不等),保证消融范围至少超过病变边缘0.5 cm[25]。
3.3 治疗效果:
2005年,董宝玮等[26]在US引导下对216例HCC(直径≤5.0cm)患者共275个病灶行PMCT,完全灭活率达95.64%,患者l、3、5年累积生存率分别为94.87%、80.44%、68.63%。2007年,Kuang等[21]对90例肝癌患者行PMCT,直径≤3.0 cm、3.1~5.0 cm、5.1~8.0 cm的肿瘤完全消融率分别占94.0% 、91.0% 、92.0%。
Liang Ping等[11]对215例原发性肝癌(直径<6 cm)患者行单纯PMCT,术后1、3、5 年生存率分别为94%,66%,44.4%。殷平等[27]选择41例中晚期原发性肝癌(最大直径<7 cm)患者,其中21例位于特殊部位(肿瘤邻近胆囊、膈肌、心脏、肝门部、大血管等)为治疗组,20例位于普通部位作对照,经PMCT后1个月,治疗组和对照组肿瘤坏死率分别为90.5%、90.0%;治疗组与对照组6个月、1年、3年生存率分别为100.0%、95.0%、71.4%和100.0%、95.0%、80.0%。
3.4 并发症和不良反应
梁萍等[28]对1136例(1928个病灶)行PMCT的肝癌患者做的一项统计显示,共30例出现严重并发症,总发生率为2.6%,需要对症治疗。并发症及不良反应见表3。最常见的不良反应是发热,一般在消融后1~2天出现,体温在37.2 ℃~39.7 ℃之间,持续1~5天;其次是局部疼痛,大多是轻中度疼痛,持续1~3天;均可自行缓解。
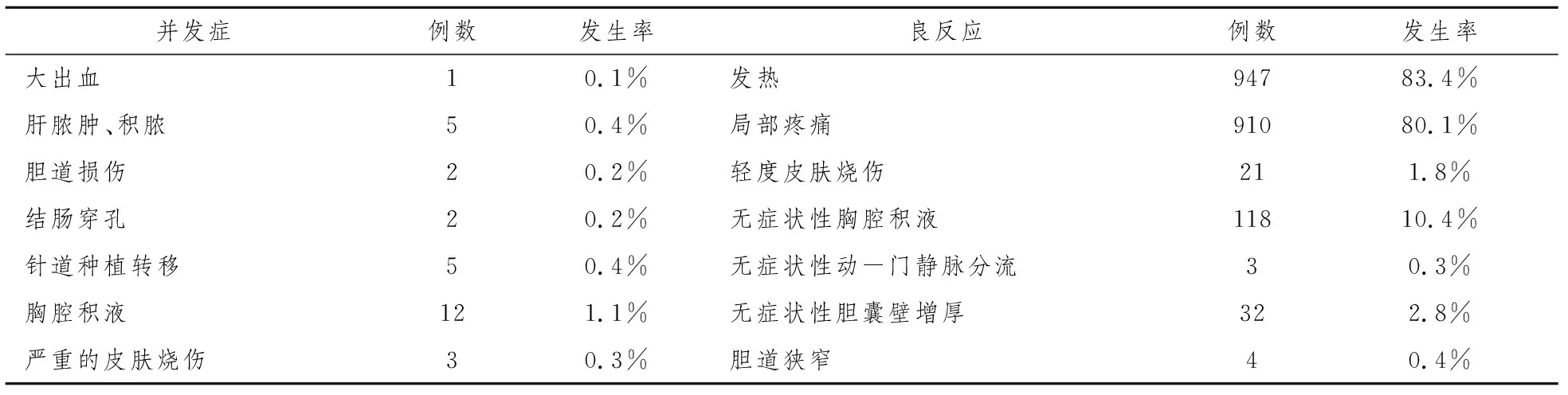
表3 1136例肝癌患者行PMCT后主要并发症、不良反应发生情况
3.5 联合治疗:
3.5.1PMCT联合TACE
导致PMCT凝固范围出现瓶颈的主要原因是热沉降效应(Heat-sink effect)[29],即在消融过程中,周围大血管的血液不断地将热量带走,影响热量聚集,这也是大血管周围有较多残瘤细胞的原因。二者联合治疗的理论依据有[30-31]:一方面,TACE阻断肿瘤血供,使肿瘤缺血缺氧,热敏性增加,从而增强后期微波的杀伤效应;另一方面,阻断血供可以降低Heat-sink effect;此外,栓塞组织由于缺血、炎症反应引起局部水肿,有利于热量的产生和传导。
Wei-Zhu Yang等[32]〗对35个原发性肝癌患者共41个结节(直径≤3 cm)行TACE术,术后1~3周予以PMCT。肿瘤完全性坏死率为82.9%,治疗后10天内25例患者血清AFP恢复正常。随访6~31个月,共2例复发,所有患者都存活。单人锋等[33]将59例原发性肝癌患者随机分为联合组39例,单纯PMCT组20例。治疗后两组的AFP转为正常率分别为87.2%,80%;1、2、3年生存率分别为97.4%、89.7%、82.0%和90.0%、80.0%、70.0%;1、2、3年复发率分别为7.7%、20.5%、30.8%和10.0%、30.0%、40.0%,均有统计学差异。陈刚等[30]的一项临床研究中,联合治疗中晚期肝癌患者1、2年生存率分别为94.6%、78.4%,明显高于对照组74.2%、54.8%。
梁萍等[34]首次对34例直径>5cm的原发性大肝癌患者做单纯TACE和TACE联合PMCT的对比研究,联合组的生存时间、生存率以及AFP降低水平均明显优于单纯组。可以说明二者联合对大肝癌的治疗有广阔的应用前景。
3.5.2PMCT联合经皮无水乙醇注射(PEI)
张亮,范卫君等[35]对125例HCC(最大径<6 cm)患者做临床对照研究,探讨PMCT+PEI联合治疗原发性肝癌的意义,结果联合组(PMCT后对未覆盖区PEI治疗)肿瘤完全坏死率89.9%,高于单纯PMCT组75.0%,初步显示出PMCT联合PEI治疗有一定的优势。Zhou Ping[36]等在探索扩大消融范围时发现,对直径<5cm的HCC,联合组的完全坏死率是58.6%,明显高于单纯PMCT组22.5%。
Qiao Ji等[37]以离体猪肝为研究对象,作单纯PMCT和联合消融的对比,先将5ml >99.7%的乙醇注入猪肝内,后在相同部位行MWA,联合组的大体范围(34.3 ±2.0 cm3)小于单纯组(58.0±6.6 cm3),这与临床发现相反。研究者分析原因可能有几方面:乙醇脱水造成电极周围水分子减少,影响了热量产生;离体猪肝没有血供,乙醇降低Heat-sink effect的作用没有体现;肿瘤和正常肝脏存在生物学差异;消融范围和程度未经病理学证实。
3.5.3PMCT联合免疫治疗
MWA小鼠肝癌后可引起Th2/Th1偏移及NK细胞显著增加;临床研究证明,消融后凝固灶边缘活化的T淋巴细胞、NK细胞、Kupffer细胞增加,它们将保持较高的水平持续一个月[38];外周血中NK细胞、LAK细胞活性及CD3+淋巴细胞比例亦显著增加;MWA还降低可溶性IL-2受体、TGF-β1等免疫抑制因子的水平;此外,高温使HSP70、caspase-3表达上调,加强免疫原性,诱导肿瘤凋亡[16]。这些免疫学变化可能是控制肿瘤复发的重要因素[39]。
另有动物实验研究发现,肝癌行MWA后瘤内注射iDC,可诱导产生特异性CTL杀伤肿瘤细胞[40]。IL-2、GM-CSF可调节、增强抗肿瘤免疫,肝癌局部MWA后,瘤内原位注射这两种细胞因子,比单独MWA和单独注射细胞因子明显增强抗肿瘤免疫反应,也能使未治疗的同源肿瘤消退,动物存活率增加,存活时间延长[41]。
超抗原SEC(Staphylococcal Enterotoxin C)是目前能力最强的T细胞激活剂之一,瘤内注射SEC后肿瘤及周边组织中CD3+、CD56+、CD68+的免疫细胞明显增加,可望杀灭局部的残瘤细胞。Liang Ping等[11]在一项II期临床试验中,将HCC患者分为联合组与单纯PMCT组,联合组PMCT后向凝固灶边缘注入SEC。观察到联合组的1、3、5年生存率为93.3%,2.9%,60.8%,明显高于单纯组94%,66%,44.4%;直径>3cm的肿瘤中,联合组的1、3年DFS率明显高于单纯组。近来,Liang Ping等[42]的一项I期临床试验发现,联合PMCT和过继免疫治疗HCC能改善外周血淋巴细胞的比例,此研究的疗效还需要大样本的随机对照试验和长期的观察进一步证实。
4 结束语
经过近20年的发展,目前MWA已然成为原发性肝癌的主要治疗手段之一。2009年,我国将肿瘤消融治疗纳入第三类医疗技术中,并出台了《肿瘤消融治疗技术管理规范》。同年,我国将MWA加入了《原发性肝癌规范化诊疗专家共识》。然而影响消融疗效的决定因素仍取决于肿瘤直径大小,直径<6 cm时,PMCT的完全消融率在90%~95%[21,26,27],患者5年生存率在44%~51%[26,42]〗,局部复发率为8%左右[26],直径>6cm时,疗效降低。在探索原发性肝癌治疗途中,PMCT与PEI、TACE、免疫联合治疗在不同的作用原理上发挥优势互补,协同抗肿瘤,逐渐成为治疗的亮点,并且具有广阔的应用前景。但是如何根据肿瘤形态在三维空间通过联合治疗既达到适形消融的目的,又减少并发症或减少正常组织的损伤,提高患者生存率,需要下一步进行探索。
[1] Jemal A, Bray F, Center MM, et a1. Global cancer statistics [J].CA Cancer J Clin,2011,61(2):69-90.
[2] Rempp H, Boss A, Helmberger T, et a1. The current role of minimally invasive therapies in the management of liver tumors[J]. Abdom Imaging,2011, 36(6):635-647.
[3] Moreno Planas JM, López Monclús J, Gómez Cruz A, et al. Efficacy of hepatocellular carcinoma locoregional therapies on patients waiting for liver transplantation[J].Transplant Proc,2005, 37(3):1484-1485.
[4] Guimaraes M, Uflacker R. Locoregional therapy for hepatocellular carcinoma[J]. Clin Liver Dis,2011,15(2):395-421.
[5] Cui J, Dong BW, Liang P, et al. Construction and clinical significance of a predictive system for prognosis of hepatocellular carcinoma[J]. World J Gastroenterol,2005, 11(20):3027-3033.
[6] Seki T, Wakabayashi M, Nakagawa T, et al. Ultrasonically guided percutaneous microwave coagulation therapy for small hepatocellular carcinoma[J]. Cancer, 1994,74(3):817-825.
[7] 于杰,梁萍.微波与射频消融的技术现状和肝癌临床治疗对比[J].医学研究杂志,2008,37(10):21-24.
[8] 梁萍,董宝玮.肝癌微波消融治疗合理选择与评价[J].中国实用外科杂志,2008,28(8):615-618.
[9] Dong BW, Liang P, Yu XL, et al.Percutaneous sonographically guided microwave coagulation therapy for hepatocellular carcinoma:results in 234 patients[J].AJR Am J Roentgenol,2003,180:1547-1555.
[10] Brace CL. Microwave ablation technology: what every user should know[J]. Curr Probl Diagn Radiol, 2009,38:61-67.
[11] Zhou P, Liang P, Dong B, et al. Long-term results of a phase II clinical trial of superantigen therapy with staphylococcal enterotoxin C after microwave ablation in hepatocellular carcinoma[J]. Int J Hyperthermia,2011,27(2):132-139.
[12] Tabuse K. A new operative procedure of hepatic surgery using a microwave tissue coagulator[J].Nippon Geka Hokan, 1979,48:160-172.
[13] 董宝玮,梁萍,于小玲等.超声引导下微波治疗肝癌的实验研究及临床初步应用[J].中华医学杂志,1996,76(2):87-91.
[14] Lubner MG, Brace CL, Hinshaw JL, et al. Microwave tumor ablation: mechanism of action,clinical results, and devices[J]. J Vasc Interv Radiol,2010,21(8suppl): 192-203.
[15] 梁萍,董宝玮,于小玲等.超声引导下微波治疗肝癌的临床应用[J].中华肿瘤杂志[J]〗.1997,19(6):448-450.
[16] Gravante G, Ong S L, Metcalfe MS, et al. Hepatic microwave ablation: a review of the histological changes following thermal damage[J]. Liver international, 2008,28(7): 911-921.
[17] Jones RP, Kitteringham NR, Terlizzo M, et al. Microwave ablation of ex vivo human liver and colorectal liver metastases with a novel 14.5 GHz generator[J]. Int J Hyperthermia,2012,28(1):43-54.
[18] Shen P, Geisinger KR, Zagoria R,et al. Pathologic correlation study of microwave coagulation therapy for hepatic malignancies using a three-ring antenna[J]. J Gastrointest Surg, 2007,11:603-611.
[19] 何年安,王文平,季正标等.新型内冷微波天线离体肝组织凝固实验-凝固灶短轴径与时间、功率的关系初探[J].中华超声影像学杂志,2005,14(9):706-708.
[20] 焦德超,张福君.经皮微波固化肝癌扩大消融范围的研究进展[A].中国(第七届)肿瘤微创治疗学术大会暨世界影像导引下肿瘤微创治疗学会成立筹备大会论文汇编[C],2011年.
[21] Kuang M, Lu MD, Xie XY, et al. Liver cancer: increased microwave delivery to ablation zone with cooled-shaft antenna--experimental and clinical studies[J]. Radiology, 2007,242(3):914-924.
[22] Brace CL, Laeseke PF, Sampson LA, et al. Microwave ablation with multiple simultaneously powered small-gauge triaxial antennas: results from an in vivo swine liver model[J]. Radiology,2007 ,244(1):151-156.
[23] Cheng Z, Xiao Q, Wang Y, et al. 915MHz microwave ablation with implanted internal cooled-shaft antenna: initial experimental study in in vivo porcine livers[J]. Eur J Radiol,2011,79(1):131-135.
[24] Hines-Peralta AU, Pirani N, Clegg P, et al. Microwave ablation: results with a 2.45-GHz applicator in ex vivo bovine and in vivo porcine liver[J]. Radiology, 2006,239: 94-102.
[25] 中国抗癌协会肝癌专业委员会,中国抗癌协会临床肿瘤学协作专业委员会,中华医学会肝病学分会肝癌学组.原发性肝癌局部消融治疗的专家共识.临床肿瘤学杂志,2011,16(1):7O-73.
[26] Liang P, Dong BW, Yu XL, et a1. Prognostic factors for survival in patients with hepatocellular carcinoma after percutaneous microwave ablation[J]. Radiology, 2005, 235(1):299-307.
[27] 殷平,蒋天安,牟永华等.B超引导下微波消融术治疗特殊部位中晚期原发性肝癌的临床价值[J].中华危重症医学杂志,2012,5(2):76-81.
[28] Liang P, Wang Y, Yu XL, et al. Malignant liver tumors: Treatment with percutaneous microwave ablation-Complications among a cohort of 1136 patients[J]. Radiology, 2009,251(3):933-940.
[29] Wu PH. The progress of minimally invasive therapy on oncology in the 21th century[J].Medical information (Section of Operative Surgery) 2007, 20 (6): 483-486.
[30] 陈刚,唐晓军,李宏波等.肝动脉化疗栓塞联合经皮微波消融治疗中晚期肝癌的疗效评价[J].临床放射学,2012,31(5):710-713.
[31] 邹勇斌,范卫君,张亮等.肝动脉化疗栓塞联合微波消融治疗巨块型肝癌的疗效分析[J].实用医学杂志,2012,28(16):2759-2761.
[32] Yang WZ, Jiang N, Huang N, et al. Combined therapy with tran-scatheter arterial chemoembolization and percutaneous microwave coagulation for small hepatocellular carcinoma[J].World J Gastro-enterol,2009,15(6):748-752.
[33] 单人锋,彭贵主,周福庆等.经皮穿刺微波凝固联合TACE治疗肝癌[J].实用临床医学杂志,2009,10(2):35-37.
[34] Liu C, Liang P, Liu F, et al. MWA combined with TACE as a combined therapy for unresectable large-sized hepotocellular carcinoma[J]. Int J Hyperthermia, 2011, 27(7):654-662.
[35] 张亮,王立刚,范卫君.微波消融联合无水乙醇瘤体内注射治疗原发性肝癌[J].中山大学学报医学科学版,2009,30(3S):100-103.
[36] Zhou P, Liu X, Li R, et al. Percutaneous coagulation therapy of hepatocellular carcinoma by combining microwave coagulation therapy and ethanol injection[J]. Eur J Radiol, 2009, 71:338-342.
[37] Ji Q, Xu Z, Liu G, et al. Preinjected fluids do not benefit microwave ablation as those in radiofrequency ablation[J]. Acad Radiol,2011,18(9):1151-1158.
[38] 粱惠民.肝癌的局部消融:射频、PEI和微波[J].中国介入放射学,2008,2:67-69.
[39] 匡铭,吕明德,周奇等.原位微波消融为诱导抗肝癌免疫反应提供有效抗原[J].中国病理生理杂志,2008,24(4):640-644.
[40] 周忠信,吕明德,殷晓煜等.小鼠肝癌微波消融后瘤内注射树突状细胞的归巢实验研究[J].中国病理生理杂志,2006,22(2):355-359.
[41] 匡铭,彭宝岗,王晔等.微波消融联合细胞因子微球原位治疗诱导抗肝癌免疫研究[J].中华实验外科杂志,2011,28(1):150.
[42] Zhou P, Liang P, Dong B, et al. Phase I clinical study of combination therapy with microwave ablation and cellular immunotherapy in Hepatocellular carcinoma[J]. Cancer Biol Ther, 2011,11:450-6.
