TrkB-BDNF的三条下游信号传导通路对神经母细胞瘤细胞耐药的影响
2013-01-10刘建英
刘建英
(青岛大学医学院,山东 青岛,266000)
神经母细胞瘤(Neuroblastoma,NB)是儿童最常见的颅外恶性实体肿瘤之一,起源于胚胎发育期未分化成熟的神经嵴细胞[1]。如何提高化疗敏感性,逆转耐药是NB治疗中亟待解决的难题。已有研究发现,TrKB(Tyrosine kinase receptor,TrKB)与BDNF(Brain-derived neurotrophic factor,BDNF)高表达是NB患者预后不良的生物学标记[2]。TrKB与BDNF结合后至少能激活三个重要的信号传导通路,包括丝裂原活化蛋白激酶(MAPK)途径、磷脂酰肌醇-3激酶/丝氨酸-苏氨酸激酶(PI3K/AKT)途径和磷脂酶C(PLC)途径,而这三条通路与细胞增殖及肿瘤发生密切相关[3]。本研究旨在探讨 TrkB-BDNF及其下游信号转导通路的激活是否与 NB 化疗耐药有关;研究阻断该通路可否逆转耐药,试图找到有效的能逆转耐药的药物,为临床治疗NB 提供新的思路和理论依据。
1 材料和方法
1.1 试剂与材料
SH- SY5Y NB 细胞系购自中国医学科学院肿瘤细胞库;全反式维甲酸(美国 sigma 公司);磷脂酶C(PLC)抑制剂 U73122(美国 sigma 公司);丝裂原活化蛋白激酶(MAPK)抑制剂U0126(美国 sigma 公司);磷脂酰肌醇-3激酶( PI3K)抑制剂LY294002(美国 sigma 公司);BDNF(PeproTech,Inc产品);DMEM培养液(Hyclone 公司);McCoy's-5 A无血清培养基(美国 sigma 公司);胎牛血清(Hyclone 公司);顺铂(CDDP,山东齐鲁制药厂);四甲基偶氮唑蓝(MTT,南京凯基生物科技发展有限公司);Annexin—V-FITC试剂盒购自南京凯基生物科技发展有限公司。
1.2 实验方法
1.2.1SH-SY5Y细胞培养 人NB细胞株SH-SY5Y培养于含10%胎牛血清、100 u/ml青霉素和100 u/ml链霉素的DMEM高糖培养液中,培养条件为37 ℃、5%CO2培养箱中。每日在倒置相差显微镜下观察细胞生长情况,当细胞铺满培养瓶底80%以上时,按1∶2比例传代细胞,实验时取对数生长期细胞。
1.2.2MTT检测细胞存活率 实验分6组:均为对数生长期细胞。第1组为对照组;第2组为单用CDDP组;第3组为ATRA+BDNF+CDDP组;第4组为ATRA+BDNF+ LY294002+CDDP组;第5组为ATRA+BDNF+ U73122+CDDP组;第6组为ATRA+BDNF+ U0126+CDDP组.
取对数生长期SH-SY5Y细胞,将细胞浓度调整至1 X 104/ml接种于96孔板中,每孔100 μl,培养24 h后顺铂组及对照组继续用DMEM 培养液,其他组改换含10 nM/L ATRA的DMEM培养液,5 d后再更换McCoy '5无血清培养液24 h后,按分组加药。顺铂处理24 h后,行MTT分析:每孔加入MTT溶液(5 g/L)20 μl,37℃继续培养4 h,小心吸弃孔内培养液,每孔加150 μl DMSO,震荡15 min,于1 h内在酶标仪上分别测出波长570 nm处各孔吸光度(A)值,每组设3个复孔,取3次实验的平均数,计算各组细胞的相对存活率(%)=(实验组吸光度一空白组吸光度/对照组吸光度一空白组吸光度)X100% 。(ATRA应用浓度为10 nM/L,BDNF应用浓度为100ng/mL,CDDP应用浓度为5μg /mL,LY294002应用浓度为10μmol/L,U73122应用浓度为10μmol/L,U0126应用浓度为10μmol/L)。以上所有药物浓度均为终浓度。
1.2.3FCM检测细胞凋亡率 实验分组同MTT分析:取对数生长期SH-SY5Y细胞,将细胞浓度调整至 1X 105/mL接种于6孔板中,每组设2孔,培养24 h后1组及2组继续用DMEM培养液,其他组改换含10 nM/L ATRA的DMEM培养液,5 d后再更换McCoy’5无血清培养液24 h后,按上述分组加药。顺铂处理24 h后细胞以不含EDTA的0.25%胰酶消化,4°C预冷的PBS洗两遍后加binding—bufer 500μL悬浮细胞,再加Annexin—V 5μL、PI5μL,室温避光作用15 min后,于1h内在流式细胞仪上检测。本实验重复3次。
1.3 统计学分析
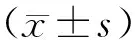
2 结 果
2.1 TrKB-BDNF 的三条下游信号传导通路对顺铂作用下NB细胞存活率的影响
ATRA+BDNF+CDDP组NB细胞的存活率与对照组相比,差异无显著性(P>0.05)。TrKB-BDNF信号通路的下游信号通路PI3K/AKT被阻断后,ATRA +BDNF+LY294002+CDDP组细胞对顺铂的敏感性增加,细胞的存活率明显降低,与ATRA+BDNF+CDDP组相比,差异有显著性(P<0.05),与单用顺铂组比较差异无统计学意义(P>0.05);TrKB-BDNF信号通路的下游信号通路PLC被阻断后,ATRA +BDNF+U73122+CDDP组细胞的存活率与ATRA+BDNF+CDDP组相比,差异无显著性(P>0.05),与单用顺铂组比较差异有统计学意义(P<0.05);TrKB-BDNF信号通路的下游信号通路MAPK被阻断后,ATRA +BDNF+U0126+CDDP组细胞的存活率与ATRA+BDNF+CDDP组相比,差异无显著性(P>0.05),与单用顺铂组比较差异有统计学意义(P<0.05)。(图1)

1:对照组;2:CDDP组;3:ATRA+BDNF+CDDP组;4:ATRA+BDNF+ LY294002+CDDP组;5:ATRA+BDNF+ U73122+CDDP组;6:ATRA+BDNF+ U0126+CDDP组.
2.2 TrKB-BDNF 的三条下游信号传导通路对顺铂作用下NB细胞凋亡率的影响
ATRA+BDNF+CDDP组NB细胞的凋亡率与对照组相比,差异无显著性(P>0.05)。TrKB-BDNF信号通路的下游信号通路PI3K/AKT被阻断后,ATRA +BDNF+LY294002+CDDP组细胞对顺铂的敏感性增加,细胞的凋亡率明显升高,与ATRA+BDNF+CDDP组相比,差异有显著性(P<0.05),与单用顺铂组比较差异无统计学意义(P>0.05);TrKB-BDNF信号通路的下游信号通路PLC被阻断后,ATRA +BDNF+U73122+CDDP组细胞的凋亡率与ATRA+BDNF+CDDP组相比,差异无显著性(P>0.05),与单用顺铂组比较差异有统计学意义(P<0.05);TrKB-BDNF信号通路的下游信号通路MAPK被阻断后,ATRA +BDNF+U0126+CDDP组细胞的凋亡率与ATRA+BDNF+CDDP组相比,差异无显著性(P>0.05),与单用顺铂组比较差异有统计学意义(P<0.05)。(图2)
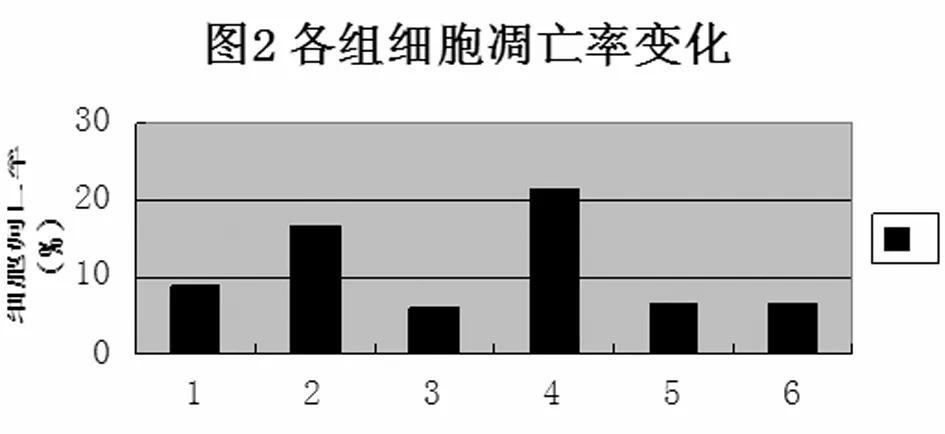
1:对照组;2:CDDP组;3:ATRA+BDNF+CDDP组;4:ATRA+BDNF+ LY294002+CDDP组;5:ATRA+BDNF+ U73122+CDDP组;6:ATRA+BDNF+ U0126+CDDP组.
3 讨 论
神经母细胞瘤是儿童最常见的实体瘤之一,起源于交感神经系统的原始细胞。在哺乳动物中,脑源性神经营养因子(BDNF)、神经生长因子(NGF)、NT-3、NT-4/5等共同组成神经营养因子家族(NTs)。TrK是原癌基因TrK编码的神经营养酪氨酸激酶受体家族成员,包括TrKA、TrKB、TrKC三个亚型[4]。已有学者报道, TrKB受体主要表达于预后不良、伴有N-myc扩增的高分化期NB患儿,而N-myc是预后较差的疾病的可靠标志物之一,TrKB高表达是NB不良预后的生物标记[5]。NTs与TrK选择性结合,BDNF主要与TrKB结合形成TrKB-BDNF信号传导通路,该通路与肿瘤的关系首先是在对神经母细胞瘤的研究中被阐明。TrKB与BDNF结合后能激活多个重要的信号传导通路,包括丝裂原活化蛋白激酶(MAPK)途径、磷脂酰肌醇-3激酶/丝氨酸-苏氨酸激酶(PI3K/AKT)途径和磷脂酶C(PLC)途径,而这三条通路与细胞增殖及肿瘤发生密切相关[3]。已有研究发现小剂量的全反式维甲酸(ATRA)对NB的生长无抑制作用,纳摩尔浓度的ATRA能诱导TrKB表达并加入外源性BDNF的作用下,能够抑制化疗药顺铂的杀伤作用,其阻断作用是通过抑制细胞凋亡而实现的,而且特异性酪氨酸激酶抑制剂K252a能阻断TrKB-BDNF通路,使SY5Y细胞恢复对化疗药顺铂的敏感性,进而杀伤肿瘤细胞[6]。
本实验中我们先用纳摩尔浓度的ATRA诱导TrKB表达,再加BDNF、MAPK抑制剂U0126、PI3K/AKT抑制剂LY294002、PLC抑制剂U73122及化疗药顺铂,检测细胞存活率及凋亡率的变化。实验结果表明,TrKB-BDNF信号传导通路的激活能够抑制顺铂对NB细胞的杀伤作用。两两比较结果显示,ATRA+BDNF+CDDP组与对照组间细胞凋亡率差异无显著性(P>0.05),说明TrKB-BDNF信号传导通路激活后可抑制顺铂对NB细胞的诱导凋亡作用,从而使NB细胞对化疗药耐药;TrKB-BDNF信号通路的下游信号通路PI3K/AKT被阻断后,ATRA +BDNF+LY294002+CDDP组细胞对顺铂的敏感性增加,细胞的凋亡率明显升高,与ATRA+BDNF+CDDP组相比,差异有显著性(P<0.05),说明PI3K/AKT通路被阻断后,顺铂的诱导凋亡作用得以恢复;TrKB-BDNF信号通路的下游信号通路PLC被阻断后,ATRA +BDNF+U73122+CDDP组细胞的凋亡率与ATRA+BDNF+CDDP组相比,差异无显著性(P>0.05),说明PLC通路被阻断后,SH-SY5Y细胞对化疗药顺铂的敏感性未受影响;TrKB-BDNF信号通路的下游信号通路MAPK被阻断后,ATRA +BDNF+U0126+CDDP组细胞的凋亡率与ATRA+BDNF+CDDP组相比,差异无显著性(P>0.05),说明MAPK通路被阻断后,SH-SY5Y细胞对化疗药顺铂的敏感性亦未受影响。以上结果说明TrKB-BDNF信号传导通路的下游PI3K/AKT信号传导通路可能参与NB细胞的增殖及化疗耐药,阻断该下游信号传导通路可逆转NB细胞耐药,恢复对化疗药顺铂的敏感性,而MAPK和PLC信号传导通路对NB的化疗敏感性无影响。
综上所述,TrKB-BDNF信号传导通路的激活可能导致NB患者的不良预后,TrKB-BDNF信号传导通路已成为抗肿瘤治疗的新靶点,另外治疗目标可选择该通路的下游信号通路中的关键细胞间调节分子,如PI3K抑制剂等[7]。TrKB-BDNF信号传导通路作为抗肿瘤治疗的新靶点,其确切机制还需要进一步深入地研究,为临床治疗提供新的理论依据。
[1] Nevo I, Sagi-Assif O, Edry Botzer L, et al.Generation and characterization of novel local and metastatic human neuroblastoma variants[J].Neoplasia, 2008 ,10(8):816-27.
[2] D'Angelo B, Benedetti E, Di Loreto S,et al.Signal transduction pathways involved in PPARβ/δ-induced neuronal differentiation[J].J Cell Physiol,2011,226(8):2170-80.
[3] Z Li,J Zhang,Z Liu,C-W Woo and CJ Thiele.Downregulation of Bim by brain-derived neurotrophic factor activation of TrKB protects neuroblastoma cells from paclitaxel but not etoposide or cisplatin-induced cell death[J].Cell death and differentiation, 2007, 14:318-326.
[4] Evangelopoulos ME, Weis J, Kruttgen A.Neurotrophin effects on neuroblastoma cells: correlation with trk and p75NTR expression and influence of Trk receptor bodies[J].J Neurooncol,2004,66(1-2):101-110.
[5] Fung W, Hasan MY, Loh AH,et al.Gene expression of TRK neurotrophin receptors in advanced neuroblastomas in Singapore--a pilot study[J].Pediatr Hematol Oncol,2011,28(7):571-578.
[6] 李爱敏,李坤霞,张继红.TrKB-BDNF信号通路对神经母细胞瘤细胞分泌血管内皮生长因子的影响[J].中国当代儿科杂志,2011,13:3.
[7] Sun W, Modak S.Emerging treatment options for the treatment of neuroblastoma: potential role of perifosine[J].Onco Targets Ther, 2012,5:21-29.
