紫外线和硫酸二乙酯诱变高产凝乳酶地衣芽孢杆菌的研究
2012-11-15张卫兵乔海军甘伯中
张卫兵,梁 琪,乔海军,米 兰,张 炎,杨 敏,甘伯中
(甘肃农业大学食品科学与工程学院,甘肃省功能乳品工程实验室,甘肃省干酪素工程技术研究中心,甘肃兰州730070)
紫外线和硫酸二乙酯诱变高产凝乳酶地衣芽孢杆菌的研究
张卫兵,梁 琪,乔海军,米 兰,张 炎,杨 敏,甘伯中*
(甘肃农业大学食品科学与工程学院,甘肃省功能乳品工程实验室,甘肃省干酪素工程技术研究中心,甘肃兰州730070)
以产凝乳酶地衣芽孢杆菌为出发菌株,通过紫外线诱变和硫酸二乙酯诱变,提高菌株的凝乳活力。经反复诱变筛选获得一株凝乳活力较高且水解活力较低的突变株DES-6,其凝乳活力为184.65SU/mL,比原菌株增加了15.41%,水解活力为23.35U/mL,比原菌株降低了64.80%。传代实验表明,突变株DES-6具有稳定的遗传性。
凝乳酶,地衣芽孢杆菌,诱变
凝乳酶是奶酪生产中使乳液凝固的关键性酶,又称天冬氨酸蛋白酶,能专一性裂解κ-酪蛋白多肽链的105~106位的苯丙氨酸和甲硫氨酸之间的肽键,形成稳定及亲水性的糖巨肽,评价凝乳酶优劣的两个重要指标是凝乳酶活力和蛋白水解力[1]。目前,国际市场上凝乳酶中动物来源的接近70%,微生物来源的占30%,植物来源的不到1%。微生物生长周期短,产量大,受气候、时间限制小,用其生产凝乳酶成本低、经济效益高,因而利用微生物生产凝乳酶是目前最有前途的发展方向[2-6]。目前关于产凝乳酶菌株的诱变选育的研究大多集中在真菌,对细菌的报道较少。郭光远[7]等人以毛霉Y85-8512作为出发菌,经诱变选育得到酶活比值高且凝乳活力可达5000U/g的菌株。孙建[8]等从17株产凝乳酶的霉菌中通过放射诱变选出一株高产菌株,再进行60Co-γ射线诱变,得到变异株R132,其凝乳活力提高了80%,酶活比值提高了65%。廖亮[9]等以米黑毛霉和黑曲霉为出发菌株,分别进行紫外线照射、脱氧胆酸钠处理和常压低温等离子体诱变,选育到一株凝乳酶产量高,蛋白质水解活力小的黑曲霉L-2-12。邵淑娟[10]等采用微波辐照方法对产凝乳酶的黑曲霉JG进行处理,选育出的突变株WB6-3、WB2-5,凝乳活力分别提高了35%和14%。蒋咏梅[11]以Y-12为出发菌株,经紫外线和硫酸二乙酯处理后,获得3株产酶水平比出发菌株提高200%以上的菌株。Higashio[12]筛选得到了NTG突变株Mucor racemosus No.50,并研究了其在10L的发酵罐中的最佳培养条件。本研究以实验室从甘肃天祝牦牛放牧区土壤中分离的产凝乳酶地衣芽孢杆菌[13]为出发菌株,通过紫外线和硫酸二乙酯两种诱变方式进行诱变,筛选凝乳活力较高而水解活力较低的菌株,为细菌凝乳酶的发酵生产奠定基础。
1 材料与方法
1.1 材料与仪器
地衣芽孢杆菌(Bacillus licheniformis) 甘肃农业大学乳品科学与技术实验室筛选并保存,编号D3.11;干酪素 甘肃华羚生物科技有限公司,食品级;脱脂奶粉 完达山乳业股份有限公司,食品级;麸皮 兰州市安宁区桃海市场,市售;酪蛋白培养基 蛋白胨2.5g,葡萄糖10g,酵母膏1g,干酪素10g,琼脂20g,脱脂乳粉5g,补足蒸馏水1000mL,pH7.0;牛肉膏蛋白胨培养基(液体) 蛋白胨5g,牛肉膏3g,NaCl 5g,蒸馏水1000mL,pH7.4;产酶培养基 称取12g麸皮,加入100mL自来水,煮沸10min,用四层纱布过滤,滤液补水至100mL后分装,121℃下灭菌20min,pH自然。
SW-CJH-1FD单人单面净化工作台 苏州净化设备厂;MICRO17TR冷冻高速离心机 Korea;PHS-3C型雷磁pH计 上海雷磁仪器厂;HZQ-X300恒温振荡培养箱 上海一恒科学仪器有限公司;DC-1006低温恒温槽 宁波江南仪器厂;722型分光光度计 上海棱光技术有限公司。
1.2 实验方法
1.2.1 菌悬液的制备 将菌种活化后,接种于装有20mL液体牛肉膏蛋白胨培养基的50mL三角瓶中,于37℃,170r/min培养15h后,吸取5mL培养液,加入装有45mL生理盐水和玻璃珠的三角瓶中,振荡20min,使菌体在玻璃珠的搅拌下,充分打散。
1.2.2 紫外线诱变处理 将菌悬液用生理盐水稀释至约108~109个/mL,分别吸取9mL菌悬液于4个无菌培养皿中,用30W紫外灯,照射距离30cm,照射时间分别为0、30、60、120、180s,取处理过的菌悬液稀释后涂布于酪蛋白平板上,37℃恒温培养至长出菌落,进行初筛和复筛,分别计算存活率和正突变率。
1.2.3 硫酸二乙酯(DES)诱变处理 在装有20mL菌悬液(108~109个/mL)带玻璃珠三角瓶中,分别加入硫酸二乙酯原液0.2mL,摇床振荡处理30、40、50、60、90min,立即取5mL处理液于无菌试管中,加入1mL 25%硫代硫酸钠溶液终止反应,取处理过的菌悬液稀释后涂布于酪蛋白平板上,37℃恒温培养至长出菌落,进行初筛和复筛,分别计算存活率和正突变率。
1.2.4 初筛 在平板菌落计数后,选取致死率在60%~80%左右的平板,将平板上的菌落分别用无菌接种针挑取到酪蛋白培养基上初筛,37℃培养24h,测量凝乳圈直径和菌落直径,选择凝乳圈直径和菌落直径比值大的菌株进行复筛。
1.2.5 复筛 将突变株活化后,接种于装有20mL产酶培养基的50mL三角瓶中,37℃、170r/min振荡培养48h。将发酵液8000r/min离心5min,得到粗酶液,测定其凝乳活力与蛋白水解活力。
1.2.6 突变株的遗传稳定性 将诱变选出的凝乳活力较高的菌株连续传代8次,测定酶活,通过数据分析,判断传代次数对酶活性变化影响是否显著。
1.3 酶活的测定
1.3.1 凝乳活力测定法[14]吸取在35℃下保温10min的复原脱脂乳液5mL入试管中,添加0.5mL在35℃保温10min的酶液,迅速摇匀并开始计时,当试管壁上出现凝集小颗粒即终止计时,计时以秒为单位。把40min凝固1mL 100g/L脱脂乳的酶量定义为一个索氏单位(Soxhlet Unit,简称SU)。
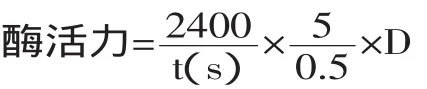
式中:t为凝乳时间(s);D为稀释倍数。
温柔的树袋熊,女(PS:不要问女生年龄),明清史硕士(其实最稀罕魏晋士人来着),喜欢旅游(尤其是不用自己掏荷包那种)。长卷发、天秤座、爱吃辣椒,喜欢传统君子士人:“谦谦君子,温润如玉”,可惜现代社会很难遇见,所以有了这篇文章。
1.3.2 蛋白水解活力测定方法[15]取15×100mm试管3支,编号1、2、3,每管内加入粗酶液1mL,置于40℃水浴中预热2min,再各加入经同样预热的酪蛋白1mL,精确保温10min后,立即再各加入0.4mol/L三氯乙酸2mL,以终止反应。继续置于水浴中保温20min,使残余蛋白质沉淀后过滤。然后另取15×150mm试管3支,编号1、2、3,每管内加入滤液1mL,再加0.4mol/L碳酸钠5mL,已稀释的福林试剂1mL,摇匀,40℃保温发色20min后进行光密度(OD660nm)测定。空白实验也取试管3支,编号1、2、3,测定方法同上。唯在加酪蛋白之前先加0.4mol/L三氯乙酸2mL,使酶失活,再加入酪蛋白。
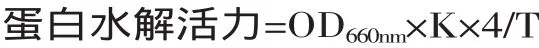
式中:K为每度OD660nm所相当的酪氨酸量;4为4mL反应液取出1mL测定(即4倍);T为反应时间10min。
1.4 致死率和正突变率的计算[16]
将培养好的平板取出进行菌落计数,根据平板上菌落计数结果,计算致死率;根据酶活力测定结果,计算正突变率。

1.5 数据处理
用统计分析软件SPSS15.0对实验数据进行分析。
2 结果与分析
2.1 紫外线对菌株的诱变效应
菌悬液经紫外线照射不同时间后,取样稀释,涂布于酪蛋白培养基上,待长出菌落后进行计数并测定酶活,不同处理时间下致死率和正突变率结果见图1。
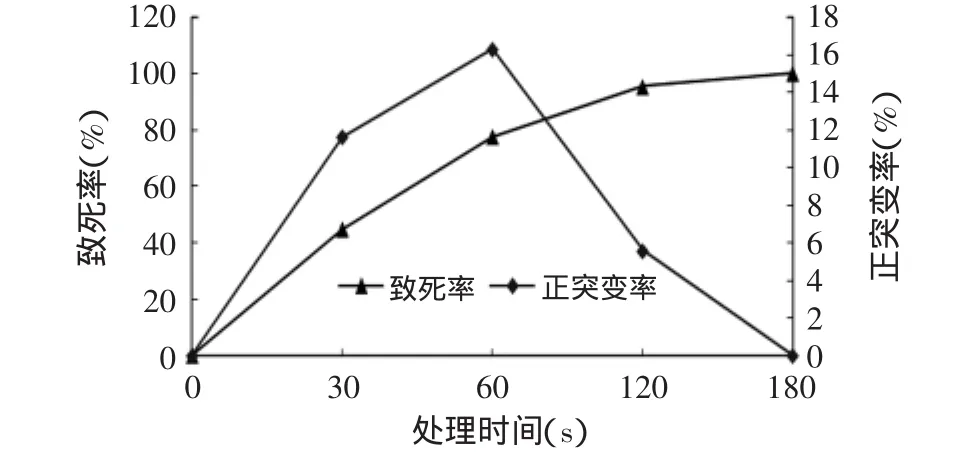
图1 紫外线对菌株的诱变处理Fig.1 The effect of UV treatment on the strains
由图1可看出,该菌株对紫外线照射比较敏感,随照射时间的增加,菌体存活数量逐渐减少,照射60s时致死率达到77.6%,照射180s时,菌体致死率达到100%。正突变率则呈现先增大后减小的趋势,照射60s时正突变率最高,可达16.28%。据报道,经紫外线诱变致死率达到95%~99%的剂量时,往往是回复突变株出现率最高的剂量,紫外线剂量控制在死亡率75%~80%时,菌株诱变效果较好[15]。在本实验中,紫外线照射时间为60s时,致死率达77.6%,正突变率最高,所以选择照射时间60s作为紫外线诱变的处理时间,进行重复诱变。
2.2 紫外诱变的初筛和复筛结果
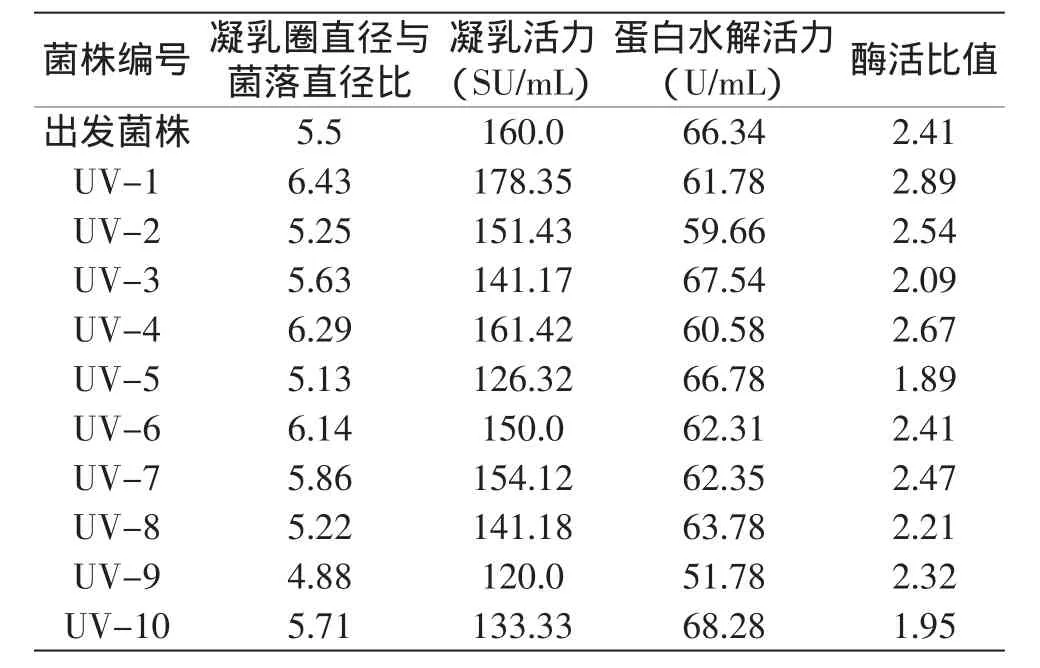
表1 紫外诱变菌株的筛选结果Table 1 The screening result of UV treatment on the strains
由表1可以看出,经过紫外诱变后菌株的凝乳圈直径与菌落直径比增大的占多数,菌株UV-1的凝乳圈直径与菌落直径比值比出发菌株增大16.9%,为增幅最大的菌株。另外所列10株菌都在18s内凝固牛乳且终止pH都在5.8以上,排除了酸凝乳的可能。从酶活测定结果来看,菌株UV-1和UV-4的凝乳活力均比出发菌株增大,其中UV-1凝乳活力比原菌株提高了11.46%,其它菌株凝乳活力都有所减小;大多数菌株的水解活力都比出发菌株减小,其中UV-9凝乳活力减小幅度最大,其水解活力比出发菌株降低了21.9%。从凝乳活力与蛋白水解活力的比值来看,比出发菌株增大的有菌株UV-1、UV-2、UV-4、UV-7,其中菌株UV-1的比值增幅最大,比出发菌株提高了19.92%。
2.3 硫酸二乙酯对菌株的诱变效应
菌悬液经硫酸二乙酯处理不同时间后取样稀释,涂布于酪蛋白分离平板上,待长出菌落后进行计数并测定酶活,计算在处理不同时间后该菌的致死率和正突变率,结果见图2。
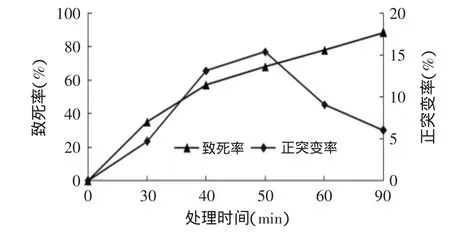
图2 硫酸二乙酯对菌株的诱变处理Fig.2 The effect of diethyl sulfate treatment on the strains
由图2可以看出,随着硫酸二乙酯处理时间的增加,菌体致死率逐渐增大,处理30min时菌体的致死率为35.2%,处理90min时,菌体致死率达到88.54%。正突变率随处理时间的增加先增大后减小,处理50min时正突变率达到15.38%,随后正突变率逐渐减小。综合考虑,选择处理时间60min作为硫酸二乙酯诱变的处理时间,进行诱变处理。
2.4 硫酸二乙酯诱变的初筛和复筛结果
菌株经硫酸二乙酯处理不同时间后,取样稀释,涂布于分离平板上培养,待长出菌落后测定凝乳圈直径、菌落直径、水解活力和凝乳活力,部分菌株的测定结果见表2。
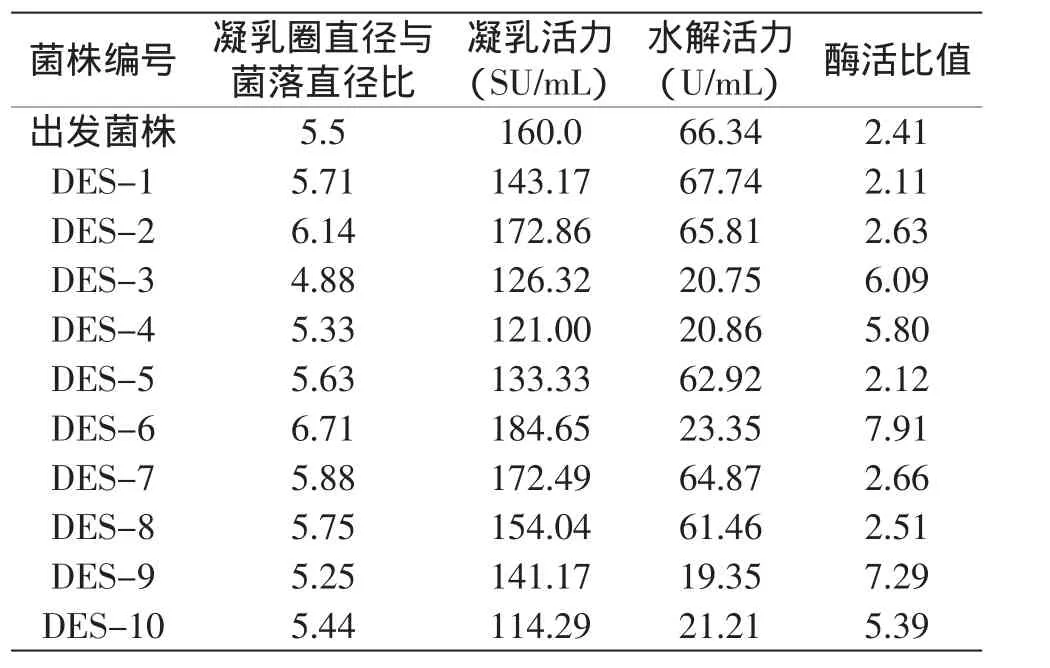
表2 硫酸二乙酯诱变菌株的筛选结果Table 2 The screening result of diethyl sulfate treatment on the strains
由表2可以看出,相对出发菌株,突变株DES-3、DES-4、DES-9和DES-10的凝乳圈直径与菌落直径比值减小,其余菌株凝乳圈直径与菌落直径比值都不同幅度地增大,DES-6的增大幅度最大,比出发菌株增大22%;从酶活测定结果来看,菌株DES-2、DES-6、DES-7的凝乳活力均比出发菌株增大,其中DES-6凝乳活力增加幅度最大,比原菌株提高了15.41%;大多数菌株的水解活力都比出发菌株减小,其中DES-9水解活力减小幅度最大,其水解活力比出发菌株降低了70.83%;从凝乳活力与蛋白水解活力的比值来看,大多数菌株的酶活比值都有所提高,其中DES-6的增幅最大,比出发菌株提高了2.28倍。
2.5 突变株的遗传稳定性
对凝乳活力高的突变株UV-1和DES-6连续传代8代,测定每代菌株的凝乳活力,凝乳活力测定结果分别见表3和表5,方差分析结果分别见表4和表6。

表3 突变株DES-6不同代次的凝乳酶活力(SU/mL)Table 3 Milk-clotting enzyme activity of mutant DES-6 of different generation(SU/mL)
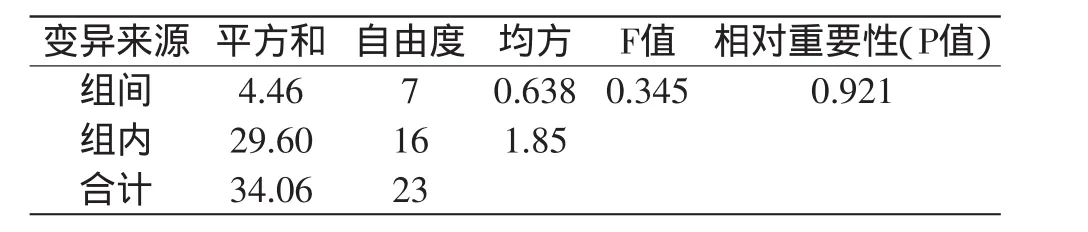
表4 突变株DES-6传代实验的方差分析Table 4 Variance analysis of generation test of mutant DES-6
由表3和表5可以看出,突变株UV-1不同代菌株

表5 突变株UV-1不同代次的凝乳酶活力(SU/mL)Table 5 Milk-clotting enzyme activity of mutant UV-1 of different generation(SU/mL)
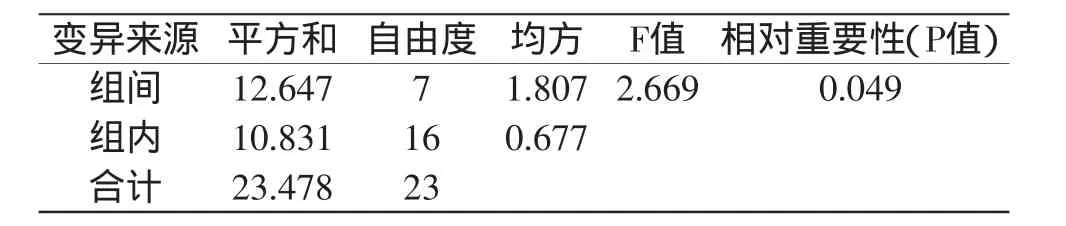
表6 突变株UV-1传代实验的方差分析Table 6 Variance analysis of generation test of mutant UV-1
由表3和表5可以看出,突变株UV-1不同代菌株凝乳酶活力稳定在174.25~177.71SU/mL之间,突变株DES-6不同代菌株凝乳酶活力稳定在184.44~184.88SU/mL之间。通过方差分析(表4和表6)可知,突变株DES-6凝乳酶活力组间差异的P值远远大于0.05,说明传代次数对酶活性变化影响不显著,表明突变株DES-6具有稳定的遗传性。突变株UV-1凝乳酶活力组间差异的P值小于0.05,说明传代次数对酶活性变化影响显著,表明突变株UV-1不具有稳定的遗传性。
3 结论
3.1 通过实验确定了地衣芽孢杆菌紫外线诱变最佳处理时间为60s;硫酸二乙酯诱变的最佳处理时间为60min。
3.2 紫外诱变后,经筛选得到一株凝乳活力增加幅度最大的突变株UV-1,凝乳活力为178.35SU/mL,比原菌株提高了11.46%;硫酸二乙酯诱变后,经筛选得到一株酶活比值大的菌株DES-6,凝乳活力为184.65SU/mL,比原菌株增加了15.41%,水解活力为23.35U/mL,比原菌株降低了64.80%,酶活比值比出发菌株提高了2.28倍。
3.3 对突变株UV-1和DES-6进行传代稳定性实验,结果表明经传代后,突变株DES-6的凝乳活力稳定,遗传性稳定性好,突变株UV-1不具有稳定的遗传性。
[1]周俊清,林亲录,赵谋明.产高效凝乳酶菌株获得方法的探讨[J].食品科学,2005,26(3):253-256.
[2]高维东,甘伯中,丁福军,等.微生物凝乳酶的研究进展[J].中国乳品工业,2009,37(5):34-37.
[3]曾剑超.国内凝乳酶及其代替品的研究进展[J].江苏调味副食品,2008,25(1):13-16.
[4]张红梅,刘仲滨.凝乳酶的研究进展[J].同济大学学报:医学版,2004,25(3):254-256.
[5]王明强,张惟广.发酵法生产凝乳酶的概述[J].四川食品与发酵,2008,44(2):21-24.
[6]周俊清,林亲录.微生物源凝乳酶的研究进展[J].中国食品添加剂,2004(2):6-9.
[7]郭光远,姜成林,马俊.微生物凝乳酶的研究Ⅰ:菌株的筛选、发酵、制备及毒性[J].微生物学通报,1988,15(5):207-210.
[8]孙健,宋晓红,卢孟柱,等.总状毛霉凝乳酶的研制及初步应用[J].微生物学通报,1994,2(1):5-10.
[9]廖亮.凝乳酶高产菌株的选育及其发酵条件、酶学活性的相关研究[D].北京:北京化工大学,2010.
[10]邵淑娟,李铁柱,李倬林,等.产凝乳酶黑曲霉JG的微波诱变育种研究[J].中国酿造,2010(7):47-50.
[11]蒋咏梅,章文贤,施巧琴,等.豆凝乳酶产生菌的筛选及诱变育种[J].福建师范大学学报:自然科学版,2000,16(3):89-93.
[12]Higashio K,Yoshioka Y.Milk clotting enzyme productionby NTG induced mutant of Mucor racemosus No.50.(Studies on milk clotting enzyme from microorganisms.V.)[J].Journal of the Agricultural Chemical Society of Japan,1982,56(9):777-785.
[13]宋曦,甘伯中,贺晓玲,等.天祝放牧牦牛生活环境土壤中一株产凝乳酶细菌的分离与鉴定[J].食品科学,2009,30(11):158-162.
[14]ArimaK,ShinjiroI,GakuzoT.Milk-clotting enzymes from microorganism,Part I,Screening test and identification of potent fungus[J].Agric Biol Chem,1967,31(5):540-545.
[15]SB/T 10317-1999蛋白酶活力测定方法[S].
[16]刘慧.现代食品微生物学实验技术[M].北京:中国轻工业出版社,2006.
Study on mutation breeding of Bacillus licheniformis producing chymosin by ultra violet and diethyl sulfate
ZHANG Wei-bing,LIANG Qi,QIAO Hai-jun,MI Lan,ZHANG Yan,YANG Min,GAN Bo-zhong*
(College of Food Science and Engineering,Gansu Provincial Key Laboratory of Functional Dairy,Gansu Casein Engineering Technical Research Centre,Lanzhou 730070,China)
Bacillus licheniformis producing chymosin was mutated by ultraviolet and diethyl sulfate to improve the ability of producing chymosin.After screening repeatedly,a mutant DES-6 with high activity of chymosin and lower proteolysis was obtained.Compared with the original strain,the activity of chymosin increased by 15.41%,the proteolytic activity reduced by 64.80%.DES-6 had good hereditary stability after several generations. Key words:chymosin;Bacillus licheniformis;mutation
TS201.3
A
1002-0306(2012)05-0174-04
2011-04-28 *通讯联系人
张卫兵(1974-),男,副教授,博士,研究方向:应用微生物。
国家863计划(2011AA100903);甘肃省科技重大专项(0702NKDA034);甘肃农业大学校创新基金(GAU-CX1107)。
